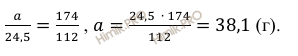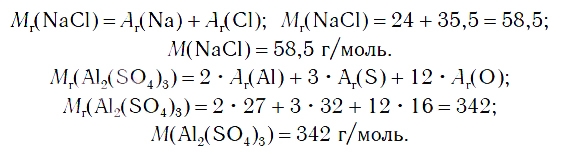Масса образовавшейся соли
К 25 граммам серной кислоты (H2SO4) прилили 25 грамм гидроксида калия (KOH), содержащего 2% примесей. Найдите массу образовавшейся соли.
Решение задачи
Запишем уравнение реакции нейтрализации раствора гидроксида калия (KOH) раствором серной кислоты (H2SO4):
Используя формулу нахождения массовой доли растворенного вещества:
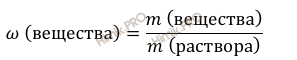
выразим массу вещества:

Найдём массу вещества гидроксида калия (KOH):
m
(вещества KOH) = 25 ∙ 0,98 = 24,5
(г).
Если раствор 98-процентный
(известно, что примеси составляют 2% поэтому: 100% — 2% = 98%), то массовая
доля гидроксида калия (KOH) в нем 0,98.
Учитывая, что молярные массы гидроксида калия (KOH) и серной кислоты (H2SO4) соответственно равны 56 г/моль и 98 г/моль (смотри таблицу Д.И. Менделеева), по уравнению реакции рассчитаем, сколько грамм серной кислоты (H2SO4) нужно для нейтрализации 1,192 г гидроксида калия (KOH):

на
нейтрализацию 112 г KOH
нужно 98 г H2SO4
на
нейтрализацию 24,5 г KOH
нужно х г H2SO4
Откуда:
Это означает, что серная кислота (H2SO4) находится в избытке и
дальнейшие расчеты производим по недостатку, то есть по гидроксиду калия (KOH).
Учитывая, что молярная масса сульфата калия (К2SO4) равна 174 г/моль (смотри таблицу Д.И. Менделеева), по уравнению реакции найдём массу образовавшейся соли:
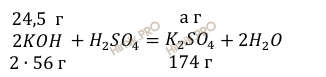
112
г KOH нужно для
образования 174 г соли
24,5
г KOH нужно для
образования а г соли
Откуда масса образовавшейся соли:
Масса образовавшейся соли равна 38,1 грамм.
Ответ:
масса образовавшейся соли равна
38,1 грамм.
Похожие задачи
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 450 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов). Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Несколько миллионов. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества. Обозначается как M
Есть еще молекулярная масса — Mr
Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 гмоль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=mM
n=V22.4 (лмоль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (лмоль)
или вот еще удобная табличка:
Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
В ОГЭ и ЕГЭ по химии задач , в которых нужно было бы найти только объем массу кол-во моль нет — это обычно ЧАСТЬ решения задачи. Однако, чтобы легко решать более сложные задачи, нужно тренироваться на таких вот небольших упражнениях.
Находим количество вещества по массе
1 Какое количество вещества алюминия содержится в образце металла массой 10.8 г?2 Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
3 Определите количество моль брома, содержащееся в массе 12.8 г.
Находим массу по количеству вещества:
4. Определите массу карбоната натрия количеством вещества 0.25 моль.Объем по количеству вещества:
5. Какой объем будет иметь азот при н.у., если его количество вещества 1.34 моль?6. Какой объем занимают при н.у. 2 моль любого газа?
Ответы:/p>
- 0.4 моль
- 0.15 моль
- 0.08 моль
- 26.5 г
- 30 л
- 44.8 л
Категории:
|
Обсуждение: «Основные формулы для решения задач по химии»
(Правила комментирования)
В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).
Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
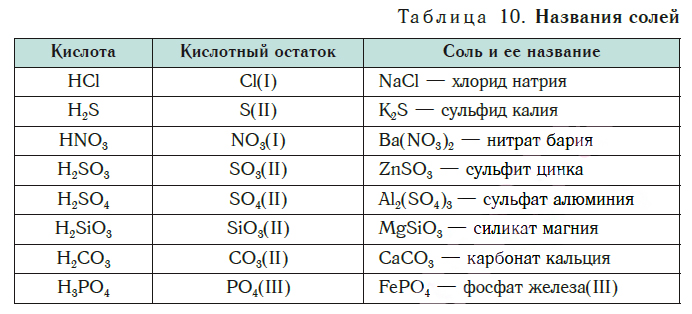
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.
Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Дано:
V(Cl2) = 5,6 л;
m(техн. железа) = 4 г;
омега(примесей в техн. железе) = 10 %.
Найти:
m(FeCl3) – ?
Решение: будем решать задачу по действиям.
1) Для начала запишем уравнение реакции. Нужно вспомнить, обратить внимание на то, что при взаимодействии газообразного хлора с металлическим железом последнее окислится до трёхвалентного состояния. Ну а затем, конечно же, надо расставить коэффициенты. Итак:
2Fe + 3Cl2 = 2FeCl3
2) Найдём количество вещества хлора, который дан у нас в качестве исходного реагента по условию задачи:
ню(Cl2) = V(Cl2)/Vm(газов) = 5,6 л : 22,4 л/моль = 0,25 моль
3) Вычислим массу чистого железа в нашем образце. У нас техническое железо, и по условию 10 % составляют примеси. Значит, чистое железо составляет 90 %.
m(чист. Fe) = m(техн. железа) * [100 % – омега(примесей)] : 100 % = 4 г * (100 % – 10 %) : 100 % = 4 г * 90 % : 100 % = 4 г * 0,9 = 3,6 г.
4) Аналогично пункту № 2 вычислим количество железа как реагента:
ню(Fe) = m(Fe)/M(Fe) = 3,6 г : 56 г/моль = ок. 0,064 моль (взял для результата две значащие цифры, так как числа 3,6 и 56 содержат по 2 зн. цифры каждое).
5) Поскольку у нас есть данные по двум реагентам, значит, это задача на избыток/недостаток. В данном случае будет правильнее прибегнуть к пропорции. Например, рассчитать, сколько молей хлора потребуется для полной реакции с 0,064 моль железа.
2 моль Fe ——— 3 моль Cl2
0,064 моль Fe ——— x моль Cl2
x = 0,064 моль * 3 моль : 2 моль = 0,096 моль.
А сколько у нас хлора как реагента по условию задачи? Согласно пункту № 2, хлора у нас аж 0,25 моль. Это явно больше, чем 0,096 моль.
Значит, приходим к выводу, что хлор у нас в избытке, а железо в недостатке. И массу хлорида железа (III) нужно считать по недостатку, т. е. исходя из данных по металлическому железу.
6) Итак, теперь можно найти количество вещества хлорида железа (III). Согласно уравнению реакции:
ню(FeCl3) = ню(Fe) = 0,064 моль.
7) А сейчас можно найти и массу хлорида железа (III):
m(FeCl3) = ню(FeCl3) * M(FeCl3) = 0,064 моль * 162,5 г/моль = 10,4 г.
Ответ: m(FeCl3) [т. е. масса соли] = 10,4 г.
- Подробности
- Категория: Общая химия
Определение массы соли сульфата железа (lll) в реакции оксида железа (lll) и серной кислоты
Задача 2.
Вычислите массу соли, образовавшейся при взаимодействии оксида железа (lll) с 245г 60%-ного раствора серной кислоты.
Решение:
Уравнение реакции имеет вид:
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
Из уравнения реакции следует, что на образование 1 моля сульфата железа (lll) требуется 3 моля серной кислоты, получим:
n[Fe2(SO4)3] = 3n(H2SO4) или n[Fe2(SO4)3] : 3n(H2SO4);
М(H2SO4) = 98 г/моль; М[Fe2(SO4)3] = 400 г/моль.
Рассчитаем массу и количество серной кислоты, используя данные из условия задачи, получим:
m(H2SO4) = m(р-ра) * w% = (245 г * 60%)/100% = 147 г;
n(H2SO4) = m(H2SO4) /M(H2SO4) = 147 г/98 г/моль = 1,5 моль.
Отсюда находим массу сульфата железа (lll):
1моль[Fe2(SO4)3] : 3моль(H2SO4) = хмоль[Fe2(SO4)3] : 1,5моль(H2SO4);
хмоль[Fe2(SO4)3] = [1моль[Fe2(SO4)3] * 1,5моль(H2SO4)]/ 3моль(H2SO4) = 0,5моль[Fe2(SO4)3].
Отсюда
m[Fe2(SO4)3] = n[Fe2(SO4)3] * M[Fe2(SO4)3] = 0,5 моль * 400 г/моль = 200г.
Ответ: m[Fe2(SO4)3] = 200г.