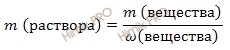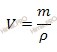Объем раствора азотной кислоты
Какой объем раствора азотной кислоты (HNO3) концентрированного с массовой долей равной 60 % и плотностью раствора 1,37 г/см3 необходимо взять для приготовления 800 см3 раствора с молярной концентрацией вещества, равной 2 моль/л?
Решение задачи
Найдем сколько концентрированной азотной кислоты (HNO3) (в граммах) потребуется для приготовления 800 см3 (или 0,8 л объем раствора азотной кислоты) раствора с молярной концентрацией 2 моль/л. Для расчета будем использовать формулу нахождения молярной концентрации раствора:
где:
CM – молярная концентрация раствора;
n – химическое количество растворенного вещества;
M – молярная масса растворенного вещества;
m – масса растворенного вещества;
V – объем раствора азотной кислоты.
Напомню, что под молярной концентрацией понимают количество (число моль) данного вещества, содержащегося в единице объема раствора. Молярную концентрацию выражают в моль/л или используют сокращение «M».
Из вышеуказанной формулы выразим и рассчитаем массу растворенного вещества:
Учитывая, что молярная масса азотной кислоты (HNO3) равна 63 г/моль (смотри таблицу Менделеева), получаем:
m (HNO3 (конц.)) = 2 моль/л ∙ 63 г/моль ∙ 0,8 л = 100,8 (г).
Используя формулу нахождения массовой доли растворенного вещества:
выразим массу раствора азотной кислоты (HNO3):
Получаем:
m (раствора HNO3 (конц.)) = 100,8 г/ 0,6 = 168 (г).
Если раствор 60-процентный, то массовая доля азотной кислоты (HNO3) в нем 0,6.
Вычислим объем раствора азотной кислоты (HNO3) концентрированного, который потребуется для приготовления 0,8 л раствора с молярной концентрацией 2 моль/л. Будем использовать формулу, устанавливающую связь между объемом раствора азотной кислоты и массой раствора:
Получаем, объем раствора азотной кислоты:
V (раствора HNO3 (конц.)) = 168 г /1,37 г/мл = 122,63 (мл).
Ответ:
объем раствора азотной кислоты концентрированного 122,63 миллилитра.
Похожие задачи
Дано: V (раствора) = 500 мл = 500 см 3 , ω ( HNO 3 ) = 0,4 , ρ (раствора) = 1,25 г / см 3 .
Найти: m ( HNO 3 ) -?
решение:
И способ.
Из формулы ρ (раствора) = m (раствора) / V (раствора) находим массу раствора
m (раствора) = V (раствора) • ρ (раствора) = 500 см 3 • 1,25 г / см 3 = 625 г.
Из формулы ω ( HNO 3 ) = m ( HNO 3 ) / m (раствора находим массу азотной кислоты
m ( HNO 3 ) = ω ( HNO 3 ) • m (раствора) = 0,4 • 625 г = 250 г.
ИИ образом.
Из формулы ρ (раствора) = m (раствора) / V (раствора) находим массу раствора
m (раствора) = V (раствора) • ρ (раствора) = 500 см 3 • 1,25 г / см 3 = 625 г.
Находим массу азотной кислоты. Для этого составляем пропорцию и решаем ее.
То, что массовая доля азотной кислоты составляет 40% означает, что
в 100 г раствора содержится 40 г азотной кислоты, тогда
в 625 г раствора будет содержаться х г азотной кислоты.
100 г / 625 г = 40 г / х г
х г • 100 г = 40 г • 625 г
х = 40 г • 625 г / 100 г = 250 г.
Ответ: m (HNO 3 ) = 250 г.
Дано:
m (NaOH) = 120 г
w% (NaOH) = 16%
w% (HNO3) = 20%
Найти:
m (р-ра HNO3) — ?
Решение:
HNO3 + NaOH = NaNO3 + H2O, — решаем задачу, опираясь на составленное уравнение реакции:
1) Находим массу гидроксида натрия в растворе:
m (NaOH) = 120 г * 0,16 = 19,2 г
2) Находим количество гидроксида натрия, вступившего в реакцию:
n (NaOH) = m : M = 19,2 г : 40 г/моль = 0,48 моль
3) Составляем логическое выражение:
Если 1 моль NaOH требует 1 моль HNO3,
то 0,48 моль NaOH потребует x моль HNO3,
тогда х = 0,48 моль.
4) Находим массу азотной кислоты:
m (HNO3) = n * M = 0,48 моль * 63 г/моль = 30,24 г
5) Находим массу раствора азотной кислоты:
m (р-ра HNO3) = 30,24 г : 0,2 = 151,2 г
Ответ: m (р-ра HNO3) = 151,2 г .
Ответ: 63 г
Дано:
m(NH₄NO₃) = 16 г
ω(HNO₃) = 0,2
Найти:
m(p-pa HNO₃)-?
Объяснение:
M(NH₄NO₃) = 14*2+1*4+16*3 = 80 г/моль
n(NH₄NO₃) = m/M = 16 г/80 г/моль = 0,2 моль
М(HNO₃) = 1+14+16*3 = 63 г/моль
Составляем УХР:
NH₃ + HNO₃ = NH₄NO3
Из УХР видно, что n(HNO₃)=n(NH₄NO₃); n(HNO₃) = 0,2 моль
Находим массу азотной кислоты:
m(HNO₃) = n(HNO₃)*M(HNO₃) = 0,2 моль*63 г/моль = 12,6 г
Находим массу раствора азотной к-ты:
m(p-pa HNO₃) = m(HNO₃)/ω(HNO₃) = 12,6 г/0,2 = 63 г
Ответ: 63 г
Определите молярную концентрацию азотной кислоты полученной смешением 40 мл 96%-ного раствора азотной кислоты (плотность 1,5 гмл) и 30 мл 48%-ного раствора азотной кислоты (плотность 1.3 гмл), если полученный раствор имеет плотность 1,45 гмл.
1. Найдем массы растворов азотной кислоты:
m1р-ра(HNO3)= V1р-ра(HNO3) ρ1(HNO3)= 40⋅ 1,5=60 г
m2р-ра(HNO3)= V2р-ра(HNO3) ρ2(HNO3)= 30⋅ 1,3=39 г
общая масса раствора после смешения mобщ р-ра(HNO3)=60+39=99 г
2. Найдем массы чистой азотной кислоты
m1(HNO3)= m1р-ра(HNO3) ω1(HNO3)= 60 ⋅0,96=57,6 г
m2(HNO3)= m2р-ра(HNO3) ω2(HNO3)= 39⋅ 0,48=18,7 г
общая масса кислоты после смешения: mобщ (HNO3)= 57,6 +18,7 = 76,3г
3. n(HNO3)= mобщ (HNO3)M(HNO3) = 76,363 = 1,2 моль
4. Объем раствора после смешения составит: Vр-ра(HNO3)= mобщ р-ра(HNO3)ρ = 991,45 = 68,3 мл или 0,0683 л
5. С(HNO3)= n(HNO3) Vр-ра(HNO3) = 1,2,0683 = 17,7 мольл.