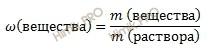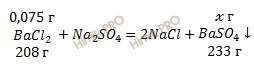Осадок сульфата бария
Найти массу осадка сульфата бария (BaSO4), который образуется при взаимодействии 15 грамм 5% раствора хлорида бария (BaCl2) с сульфатом натрия (Na2SO4).
Решение задачи
Запишем уравнение реакции образования осадка сульфата бария (BaSO4) при взаимодействии раствора хлорида бария (BaCl2) с сульфатом натрия (Na2SO4):
Зная массу и массовую долю раствора хлорида бария (BaCl2), для решения задачи будем использовать формулу нахождения массовой доли растворенного вещества:
Выразим из формулы массу вещества:
Найдем массу хлорида бария (BaCl2), который необходим для образования осадка сульфата бария:
m (BaCl2) = 15 ⋅ 0,05 = 0,075 (г).
Если раствор 5-процентный, то массовая доля соли в нем 0,05.
Рассчитаем молярные массы хлорида бария (BaCl2) и сульфата бария (BaSO4), используя данные таблицы Менделеева:
M (BaCl2) = 137 + 2 ⋅ 35,5 = 208 (г/моль),
M (BaSO4) = 137 + 32 + 4 ⋅ 16 = 233 (г/моль).
Из уравнения реакции взаимодействия раствора хлорида бария (BaCl2) с сульфатом натрия (Na2SO4) найдем массу осадка сульфата бария:
0,075 г BaCl2 участвует в образавании х г осадка сульфата бария
208 г BaCl2 участвует в образавании 233 г осадка сульфата бария
Откуда:
Ответ:
масса осадка сульфата бария равна 0,084 грамма.
Вряд ли эта задачка соответствует уровню 9 класса. Дело в том, что если решать её «в лоб, совсем по-детски», то рассуждения такие: 208 г хлорида бария это 1 моль. 1 моль хлорида бария может прореагировать с 1 молем серной кислоты:
BaCl2 + H2SO4 ——> BaSO4 + 2HCl.
Образуется 1 моль сульфата бария, 2 моля хлористого водорода и останется 3 моля серной кислоты.
Казалось бы и всё. Но в описании задачи не указаны условия. Если реакция проводится в водном растворе, достаточно разбавленном, то всё тем и закончится. А если в более концентрированном? А если между безводными реагентами?
Но если вещества взаимодействуют в безводных условиях, то серная кислота будучи очень сильной, может протонировать сульфат-анион, образуя бисульфат-анион:
H2SO4 + SO4(2-) ——> 2 HSO4(-).
Т.е. по сути образуется некоторое количество бисульфата бария, формально Ba(HSO4)2. Что с ним будет? Растворим ли сульфат бария BaSO4 и бисульфат бария Ba(HSO4)2 в концентрированной серной кислоте? А может ли серная кислота протонировать бисульфат-анион? Что при этом получится? соли пиросерной кислоты?
А если взаимодействие проводится в достаточно концентрированном, но всё в водном растворе? Скорее всего часть осадка сульфата бария превратится в бисульфат бария. Какова растворимость бисульфата бария в воде, в водных растворах серной кислоты? Наверное все эти вопросы кто-то когда-то изучал, но вряд ли результаты изложены в обычных школьных (и даже в вузовских) учебниках. Так что эту задачу ученик 9 класса не сможет решить.
Запишем условия задачи.
- нитрат бария — Ba(NO3)2;
- серная кислота — H2SO4;
- m — масса вещества;
- M — молекулярная масса вещества.
Дано:
m (Ba(NO3)2) = 26,1 г;
m (H2SO4) = 4,5 г;
Найти:
m (осадка) = ?
Напишите уравнение реакции
При взаимодействии кислоты с солью, образуется новая соль и новая кислота. При взаимодействии нитрата бария с серной кислотой, образуется сульфат бария и азотная кислота.
Ba(NO3)2 + H2SO4 = BaSO4 + 2HNO3.
Осадок это нерастворимое вещество, в данном уравнении в осадок выпадает BaSO4 и найти нужно его массу.
Найдите какое вещество в избытке, а какое в недостатке
Когда известна масса двух реагирующих веществ, расчет ведется по веществу, которое в недостатке.
Для определения избытка либо недостатка вещества необходимо:
- найти молекулярные массы веществ;
- найти количество моль каждого вещества;
- сопоставить какого вещества в молях больше, а какого меньше.
M (Ba(NO3)2) = 137 + (14 х 2) + ((16 х 3) х 2) = 261 г/моль.
M (H2SO4) = (1 х 2) + 32 + (16 х 2) = 98 г/моль.
Количество вещества определяем по формуле:
n = m : M.
n (Ba(NO3)2) = 26,1 г : 261 г/моль = 0,1 моль.
n (H2SO4) = 4,5 г : 98 г/моль = 0,04 моль.
Серная кислота в недостатке, значит вычисляем массу осадка по ней.
Найдите массу осадка
Массу осадка найдем по формуле:
m (H2SO4) : M (H2SO4) = m (BaSO4) : M (BaSO4),
отсюда M (BaSO4) = (m (H2SO4) х M (BaSO4)) : M (H2SO4).
Молекулярную массу BaSO4 считаем с помощью таблицы Менделеева:
M (BaSO4) = 137 + 32 + (16 х 4) = 233 г/моль.
Подставляем значения:
m (BaSO4) = (4,5 г х 233 г/моль) : 98 г/моль = 10,69 г.
Ответ: m (осадка) = 10,69 г.
Часто бывает так, что в ходе химической реакции образуется малорастворимое вещество, выпадающее в осадок (к примеру, сульфат бария, фосфат кальция, хлорид серебра и т.д.). Предположим, химику поставлена задача: определить массу этого осадка. Каким образом можно это сделать?
Если вам неизвестны точные количества исходных веществ, то придется действовать опытным путем. То есть сначала отделите осадок от раствора (путем фильтрования или на обычной воронке, или с использованием воронки Бюхнера). После чего тщательно высушите его и взвесьте на аналитических весах. Так вы получите достаточно точный результат.
Ну а если вам известны точные количества веществ, вступавших в реакцию, то все будет гораздо проще. Например, изначально было 28,4 грамма сульфата натрия и 20,8 грамма хлорида бария. Сколько граммовобразовалось?
Напишите правильное уравнение химической реакции: Na2SO4 + BaCl2 = BaSO4 + 2NaCl.В результате этой реакции образуется практически нерастворимое вещество – сульфат бария, мгновенно выпадающий в виде плотного белого осадка.
Вычислите, какое из веществ было взято в недостатке, а какое – в избытке. Для этого подсчитайте молярные массы исходных реагентов:46 + 32 + 64 = 142 г/моль – молярная масса сульфата натрия;
137 + 71 = 208 г/моль – молярная масса хлорида бария.То есть в реакцию вступали 0,2 моля сульфата натрия и 0,1 моля хлорида бария. Сульфат натрия был взят в избытке, следовательно, весь хлорид бария прореагировал.
Подсчитайте количество образовавшегося осадка. Для этого разделите молекулярную массу сульфата бария на молекулярную массу хлорида бария и результат умножьте на количество исходного вещества:20,8 * 233/208 = 23,3 грамма.
А если бы сульфат натрия был в недостатке? Предположим, в реакцию вступило бы не 28,4 грамма этой соли, а в 5 раз меньше – всего 5,68 грамма. И тут нет абсолютно ничего сложного. 5,68 грамма сульфата натрия составляют 0,04 моля. Следовательно, в реакцию с таким количеством этой соли могло вступить также всего 0,04 моля хлорида бария, то есть 0,04 х 208 = 8,32 грамма. Прореагировало только 8,32 грамма из исходных 20,8 граммов.
Умножив эту величину на соотношение молярных масс сульфата бария и хлорида бария, получите ответ: 8,32 * 233/208 = 9,32 грамма осадка.
Дано:
m(р-ра BaCl2)=15г
ω(р-ра ВаСl2)=5%=0,05
m(р-ра Na2SO4)=10г
ω(р-ра Na2SO4)=8%=0,08
Найти:
m(осадка BaSO4)=y г
Решение:
1) Найдем m чистого вещества BaCl2, Na2SO4)
ω=m (раствора)/m(вещества)
то есть
m(вещества)=m(раствора)Хω(раствора)
m(BaCl2 чистого)=15гХ0,05=0,75г
m(чистого Na2SO4)=аналогично=10гХ0,08=0,8г
2) Найдем n(количество вещества) BaCl2, Na2SO4
n(BaCl2)=m/Mч=0,75г/9590г/моль=7,8206моль
Мч(BaCl2)=137+35×2=9590г/моль
n(Na2SO4)=0,8г/140г/моль=0,0057моль
Мч(Na2SO4)=22×2+32+16×4=140/моль
3) По уравнению хим.реакции найдем массу осадка BaCl2
7,8206моль 0,0057моль x моль
BaCl2 + Na2SO4 = BaSO4(осадок, пишем стрелку вниз) + 2NaCl
1 моль 1 моль 1 моль
Сравним дроби
7,8206/1=0,0057/1
7,8206=0,0057
первая дробь больше — избыток
вторая — недостоток
Решаем по недостатку(это правило)
0,0057/1= х/1 (пропорция по ур.реакции. смотри выше)
х = 0,0057х1/1=0,0057
n(BaSO4)=0,0057 моль
4) Найдем массу BaSO4
m(BaSO4)=n(BaSO4)xМч=0,0057мольх233г/моль=1,3281г
Мч(BaSO4)=137+32+16×4= 233г/моль
Ответ: m(осадка BaCl2)=1,3281г