ЭКЗАМЕНЫ НЕ ЗА ГОРАМИ
Подготовка к ЕГЭ по химии
Выполнение заданий высокого уровня сложности
Задачи с расчетами по уравнениям
реакций,
происходящих в растворах
При обучении школьников способам решения задач
очень большое значение придаю применению
алгоритмов. Я считаю, что вначале нужно уверенно
овладеть небольшим числом стандартных приемов,
получить представление о возможных типах задач.
Это позволит ученику выйти на творческий уровень
в своем дальнейшем химическом образовании и
самообразовании.
Одно из заданий высокого уровня сложности (оно
входит в третью часть экзаменационной
работы – задание С4) проверяет умение
производить расчеты по уравнениям реакций,
происходящих в растворах.
В учебной литературе недостаточно подробно
объясняются особенности решения таких задач.
Поэтому мы с учениками вначале разбираем все
моменты, на которые нужно обратить внимание,
записываем алгоритмы в общем виде, рассматриваем
решение задач каждого типа, затем отрабатываем
умения на самостоятельном решении целого ряда
подобных задач.
Прежде всего ученик должен усвоить понятие о
массовой доле растворенного вещества, или, иначе,
процентной концентрации раствора. Эта величина
показывает отношение массы растворенного
вещества к массе раствора:
р.в-во
= mр.в-во / mр-р.
Производные формулы:
mр.в-во = mр-р•р.в-во,
mр-р = mр.в-во / р.в-во.
Если в условии задачи указан объем раствора с
определенной плотностью, то прежде всего находят
массу раствора:
mр-р = Vр-р•р-р,
затем – массу растворенного вещества:
mр.в-во = mр-р•р.в-во.
Количество вещества находят по массе
растворенного вещества:
= mр.в-во
/ М.
Рассмотрим некоторые типы задач с расчетами по
уравнениям реакций, происходящих в растворах.
• Нахождение массовых долей веществ в
растворе после реакции.
При решении таких задач прежде всего нужно
найти количества вещества реагентов. Если задача
на избыток и недостаток, то количества вещества
продуктов реакции находят по веществу, которое
дано в недостатке.
Один из важных моментов – это нахождение
массы раствора после реакции (массы
полученного раствора, mр-р получ). Если
какое-либо вещество взаимодействует с веществом,
находящимся в растворе, то складывают массу
вещества и массу раствора; в случае, когда оба
реагирующих вещества даны в виде растворов,
складывают массы двух растворов. Если в
результате реакции образуется осадок или газ, то
из полученной суммы вычитают массу вещества,
ушедшего из раствора в виде осадка или газа:
mр-р получ = mв-во + mр-р –
mосадок (газ),
mр-р получ = mр-р1 + m
р-р2 – mосадок (газ).
При решении задач на избыток и недостаток нужно
помнить о том, что в растворе после реакции будет
находиться в растворенном виде не только продукт
реакции, но и вещество, которое было дано в
избытке.
Чтобы найти количество вещества, которое не
прореагировало – избытка, нужно от исходного
количества вещества отнять количество
прореагировавшего вещества:
изб
= исх –
прор.
Затем найти его массу и массовую долю в
растворе, полученном после реакции.
Задача 1. 4,8 г магния растворили в 200 мл
12%-го раствора серной кислоты ( = 1,05 г/мл). Найти массовую долю
соли в полученном растворе.
| Дано:
m(Mg) = 4,8 г, Vр-р(H2SO4) = 200 мл,
|
Найти: |
Р е ш е н и е
(Мg) = m / M
= 4,8 (г) / 24 (г/моль) = 0,2 моль.
mр-р(H2SO4) = Vр-р• = 200 (мл)•1,05 (г/мл) = 210
г.
mр.в-во(H2SO4) = mр-р•р.в-во = 210•0,12 =
25,2 г.
р.в-во(H2SO4)
= m/M = 25,2 (г) / 98 (г/моль) = 0,26 моль.
В недостатке – Mg. Следовательно:
(MgSO4) = 0,2
моль,
(H2) = 0,2
моль.
mр.в-во(MgSO4) = M• = 120 (г/моль)•0,2 (моль) = 24 г.
m(H2) = M• = 2 (г/моль)•0,2 (моль) = 0,4 г.
mр-р получ = mр-р(H2SO4)
+ m(Mg) – m(H2) = 210 (г) + 4,8 (г) – 0,4 (г) =
214,4 г.
р.в-во(MgSO4)
= mр.в-во(MgSO4) / mр-р получ =
24 (г) / 214,4 (г) = 0,112, или 11,2 %.
О т в е т. р.в-во(MgSO4) = 11,2 %.
Задача 2. Смешали 250 г раствора сульфата
железа(III) с концентрацией 8 % и 50 г раствора
гидроксида натрия с концентрацией 30 %. Найти
концентрацию веществ в получившемся растворе.
| Дано:
mр-р(Fe2(SO4)3)
mр-р(NaOH) = 50 г,
|
Найти: |
Р е ш е н и е
mр.в-во(Fe2(SO4)3) = mр-р•р.в-во = 250
(г)•0,08 = 20 г.
(Fe2(SO4)3)
= m/M = 20 (г) / 400 (г/моль) = 0,05 моль.
mр.в-во(NaOH) = mр-р•р.в-во = 50 (г)•0,3 = 15 г.
(NaOH) = m/M =
15 (г) / 40 (г/моль) = 0,375 моль.
В недостатке – Fe2(SO4)3.
Следовательно:
(Na2SO4)
= 0,05 (моль)•3 = 0,15 моль.
(Fe(OH)3) = 0,05
(моль)•2 = 0,1 моль.
прор(NaOH) =
0,05 (моль)•6 = 0,3 моль.
изб(NaOH) =
исх –
прор = 0,375
(моль) – 0,3 (моль) = 0,075 моль.
m(NaOH) = M• =
40 (г/моль)•0,075 (моль) = 3 г.
m(Na2SO4) = M• = 142 (г/моль)•0,15 (моль) = 21,3 г.
m(Fe(OH)3) = M• = 107 (г/моль)•0,1 (моль) = 10,7 г.
m р-р получ = mр-р(Fe2(SO4)3
+ mр-р(NaOH) – m(Fe(OH)3) = 250 (г) + 50
(г) –10,7 (г) = 289,3 г.
р.в-ва(Na2SO4)
= m / mр-р = 21,3 (г) / 289,3 (г) = 0,074, или 7,4 %.
р.в-ва(NaOH)
= m / mр-р = 3 (г) / 289,3 (г) = 0,01, или 1 %.
О т в е т. р.в-во(Na2SO4) = 7,4 %,
р.в-во(NaOH) = 1 %.
Задача 3. Карбонат кальция массой 10 г
растворили при нагревании в 150 мл
хлороводородной кислоты ( = 1,04 г/мл) с массовой долей 9 %.
Какова массовая доля хлороводорода в
получившемся растворе?
О т в е т. р.в-во(HCl) = 4,2 %.
Задача 4. 5,6 г железа растворили в 100 мл 10%-го
раствора соляной кислоты ( = 1,05 г/мл). Вычислить массовую долю
хлороводорода в полученном растворе.
О т в е т. р.в-во(HCl) = 2,9 %.
Задача 5. 5,6 г железа растворили в 200 мл
раствора соляной кислоты ( = 1,05 г/мл) с массовой долей 10 %. Найти
массовую долю соли в полученном растворе.
О т в е т. р.в-во(FeCl2) = 5,9 %.
Задача 6. Смешали 110,4 г раствора карбоната
калия с концентрацией 25 % и 111 г раствора
хлорида кальция с концентрацией 20 %. Найти
концентрацию вещества в полученном растворе.
О т в е т. р.в-во(KCl) = 14,8 %.
Задача 7. Смешали 320 г раствора сульфата
меди(II) с концентрацией 5 % и 120 г раствора
гидроксида натрия с концентрацией 10 %. Найти
концентрации веществ в полученном растворе.
О т в е т. р.в-во(Na2SO4) = 3,3 %,
р.в-во(NaOH) = 0,9 %.
• Более сложными являются задачи на
нахождение массы (или объема) вещества, которое
нужно добавить к раствору другого вещества для
того, чтобы его концентрация изменилась в
результате произошедшей реакции.
В этом случае алгоритм решения следующий:
1) нужно обозначить за x количество
добавленного вещества – реагента;
2) выразить через х количества
прореагировавшего с реагентом вещества и
полученного в результате реакции газа или
осадка;
3) найти количество растворенного вещества в
исходном растворе и его количество, оставшееся
после реакции (оставш
= 1 –
прор);
4) выразить через х массу оставшегося в
растворе вещества;
5) найти массу раствора, полученного после
реакции:
mр-р получ = mреаг + mр-р1 –
mосадок (газ);
mр-р получ = mр-р1 + mр-р2 –
m осадок (газ).
6) все данные подставить в формулу:
р.в-во2 = mоставш / mр-р получ.
7) найти количество вещества реагента, его массу
или объем.
Задача 8. Найти массу карбоната
кальция, которую следует добавить к 600 г раствора
азотной кислоты с массовой долей 31,5 %, чтобы
массовая доля кислоты уменьшилась до 10,5 %.
| Дано:
mр-р1(HNO3)
|
Найти: m(CaCO3). |
Р е ш е н и е
(СаСО3) = х
моль; (HNO3)прор
= 2х моль;
(СО2) = х
моль, m(CO2) = 44x г;
m(CaCO3) = M• = 100 (г/моль)•х (моль) = 100х г;
mр.в-во1(HNO3) = mр-р1•р.в-во1 = 600
(г)•0,315 = 189 г;
1(HNO3)
= m р.в-во /М = 189 (г) / 63 (г/моль) = 3 моль,
оставш(HNO3)
= 1 –
прор = 3 – 2х
моль,
mоставш(HNO3) = М• = 63 (г/моль)•(3 – 2х) =
(189 – 126х) г;
mр-р получ = m(CaCO3) + mр-р1(HNO3) –
m(CO2) = 100x + 600 – 44x = 600 + 56x,
р.в-во2(HNO3)
= mоставш(HNO3) / mр-р получ.
0,105 = (189 – 126х) / (600 + 56х),
х = 0,955 моль, (СаСО3)
= 0,955 моль,
m(CaCO3) = M• = 100 (г/моль)•0,955 (моль) = 95,5 г.
О т в е т. m(CaCO3) = 95,5 г.
Задача 9. Найти массу кристаллогидрата CaCl2•6H2O,
которую необходимо добавить к 47 мл 25%-го раствора
карбоната натрия ( = 1,08 г/мл), чтобы получить раствор, в
котором массовая доля карбоната натрия
составила бы 10 %.
| Дано:
Vр-р1(Na2CO3)
|
Найти: m(CaCl2•6H2O). |
Р е ш е н и е
(СaCl2•6H2O)
= x моль, (CaCl2)
= x моль,
прор(Na2CO3)
= х моль, (СаСО3)
= х моль;
m(CaCl2•6H2O) = M• = 219 (г/моль)•х (моль) = 219х г;
m(CaCO3) = M• = 100x г;
mр-р1(Na2CO3) = Vр-р1•р-р1 = 47 (мл)• 1,08
(г/мл) = 50,76 г,
mр.в-во1(Na2CO3) = mр-р1• р.в-во1 = 50,76
(г)•0,25 = 12,69 г,
1(Na2CO3)
= mр.в-во1 / M = 12,69 (г) / 106 (г/моль) = 0,12
моль,
оставш(Na2CO3)
= 1 –
прор = 0,12 – х,
mоставш(Na2CO3) = M• = 106(0,12 – x) =
12,69 – 106x;
mр-р получ = m(CaCl2•6H2O) + mр-р1(Na2CO3) –
m(CaCO3),
219x + 50,76 – 100x = 50,76 + 119x,
р.в-во2 = mоставш(Na2CO3)
/ mр-р получ,
0,1 = 12,69 – 106х / 50,76 + 119х,
х = 0,0646 моль.
m(CaCl2•6H2O) = М• = 219 (г/моль)•0,0646 (моль) = 14,14 г.
О т в е т. m(CaCl2•6H2O) = 14,4 г.
Задача 10. Какой объем 30%-го раствора
аммиака ( = 0,892
г/мл) необходимо добавить к 200 мл 40%-го раствора
соляной кислоты ( = 1,198 г/мл), чтобы массовая доля
кислоты уменьшилась вчетверо?
О т в е т. Vр-р(NH3) = 108,2 мл.
Задача 11. Какой объем углекислого газа
нужно добавить к 100 мл 20%-го раствора гидроксида
натрия ( = 4,1
г/мл), чтобы массовая доля гидроксида натрия
уменьшилась вдвое?
О т в е т. V(CO2) = 10,9 л.
Задача 12. Найти объем раствора соляной
кислоты ( = 1,05
г/мл) с массовой долей 10 %, который нужно
добавить к 350 г раствора гидроксида калия с
массовой долей 10,5 %, чтобы концентрация щелочи
составила 3 %.
О т в е т. Vр-р(HCl) = 135,6 мл.
• Внимание: растворенное вещество –
реагент!
При решении задач на растворы нужно помнить о
том, что при обычных условиях с водой реагируют
следующие вещества:
1) щелочные и щелочно-земельные металлы,
например:
2Na + 2H2O = 2NaOH + H2;
2) оксиды щелочных и щелочно-земельных металлов,
например:
СаО + Н2О = Са(ОН)2;
3) оксиды неметаллов, например:
SO3 + H2O = H2SO4;
4) многие бинарные соединения – гидриды,
карбиды, нитриды и другие, например:
KН + Н2О = KОН + Н2.
Растворение вещества-реагента в воде.
Растворенным веществом в данном случае будет
продукт взаимодействия вещества-реагента с
водой. Масса раствора будет складываться из
массы реагента и массы воды:
mр-р = mреаг + mH2O.
Если в результате реакции выделился газ, то
mр-р = mреаг + mH2O –
mгаз.
Задача 13. В каком объеме воды нужно
растворить 11,2 л оксида серы(IV), чтобы получить
раствор сернистой кислоты с массовой долей 1 %?
| Дано:
V(SO2) = 11,2 л,
|
Найти: V(H2O). |
Р е ш е н и е
(SO2) = V / VM
= 11,2 (л) / 22,4 (л/моль) = 0,5 моль, следовательно, (H2SO3) = 0,5
моль.
mр.в-во(H2SO3) = M• = 82 (г/моль)•0,5 (моль) =
41 г,
mр-р(H2SO3) = mр.в-во(H2SO3)
/ р.в-во(H2SO3)
= 41 (г) / 0,01 = 4100 г;
m(H2O) = mр-р(H2SO3) –
m(SO2),
m(SO2) = M• = 64 (г/моль)•0,5 (моль) = 32 г,
m(H2O) = 4100 (г) – 32 (г) = 4068 г,
V(H2O) = m/ = 4068 (г) / 1 (г/мл) = 4068 мл, или 4 л 68 мл.
О т в е т. V(H2O) = 4068 мл.
Задачи, в которых неизвестна масса
вещества-реагента, необходимого для образования
раствора с определенной концентрацией.
Алгоритм решения следующий:
1) принять количество растворенного реагента за
х моль;
2) согласно уравнению реакции выразить через х
количества продуктов реакции;
3) найти через х массы реагента и продуктов
реакции;
4) найти массу раствора;
5) подставить все данные в формулу для расчета
массовой доли вещества в растворе:
р.в-во(продукт)
= mр.в-во(продукт) / mр-р.
Задача 14. Найти массу гидрида лития,
которую нужно растворить в 100 мл воды, чтобы
получить раствор с массовой долей гидроксида
лития 5 %.
| Дано:
V(H2O) = 100 мл,
|
Найти: m(LiH). |
Р е ш е н и е
Пусть (LiH) = x
моль,
тогда (LiOH) = x
моль, (Н2) = х
моль.
m(LiH) = M•
= 8 (г/моль)•х (моль) = 8х (г),
m(LiOH) = M•
= 24 (г/моль)•х (моль) = 24х г,
m(H2) = M• = 2 (г/моль)•х = 2х г.
mр-р = m(LiH) + m(H2O) – m(H2),
m(H2O) = V• = 100 (мл)•1 (г/мл) = 100 г.
mр-р = 8х + 100 – 2х = 6х + 100.
р.в-во(LiOH)
= mр.в-во(LiOH) / mр-р,
0,05 = 24х / (6х + 100); 0,3х + 5 = 24х,
х = 0,21, (LiH) =
0,21 моль.
m(LiH) = M•
= 8 (г/моль)•0,21 (моль) = 1,7 г.
О т в е т. m(LiH) = 1,7 г.
Растворение вещества-реагента в растворе.
В этом случае растворяемое вещество реагирует
с водой, которая присутствует в растворе. Масса
растворенного вещества во втором растворе
складывается из массы вещества в первом растворе
и массы вещества – продукта реакции:
mр.в-во1 = mр-р1•р.в-во1,
mр.в-во2 = mр.в-во1• mр.в-во(прод.),
mр-р2 = mр-р1 + mреаг,
или mр-р2 = mр-р1 + mреаг –
mгаз.
р.в-во2
= mр.в-во2 / mр-р2.
Задача 15. К 200 г 10%-го раствора
ортофосфорной кислоты добавили 28,4 г фосфорного
ангидрида. Найти массовую долю кислоты в
получившемся растворе.
| Дано:
mр-р1(H3PO4)
m(P2O5) = 28,4 г. |
Найти: |
Р е ш е н и е
(P2O5) =
m / M = 28,4 (г) / 142 (г/моль) = 0,2 моль,
прод(Н3РО4)
= 0,2 (моль)•2 = 0,4 моль.
mпрод(Н3РО4) = М• = 98 (г/моль)•0,4 (моль) =
39,2 г,
mр.в-во1(Н3РО4) = mр-р1•р.в-во1 = 200 (г)
•0,1 = 20 г,
mр.в-во2(Н3РО4) = mр.в-во2(Н3РО4)
+ mпрод(Н3РО4) = 20 (г) + 39,2 (г) = 59,2
г;
mр-р2(Н3РО4) = mр-р1(Н3РО4)
+ mреаг(Р2О5) = 200 (г) + 28,4 (г) = 228,4
г.
р.в-во2(Н3РО4)
= mр.в-во2(Н3РО4) / mр-р2(Н3РО4)
= 59,2 (г) / 228,4 (г) = 0,2592, или 25,92 %.
О т в е т: (Н3РО4) = 25,92 %.
Задача 16. Найти массу фосфорного
ангидрида, которую необходимо добавить к 70 г 10%-го
раствора ортофосфорной кислоты, чтобы получить
40%-й раствор.
| Дано:
mр-р1(Н3РО4)
|
Найти: m(P2O5). |
Р е ш е н и е
Пусть (Р2О5)
= х моль,
тогда (Н3РО4)
= 2х моль.
mпрод(Н3РО4) = М• = 98 (г/моль)•2х
(моль) = 196х г.
mреаг(Р2О5) = М• = 142 (г/моль)•х
(моль) = 142х г,
mр.в-во1(Н3РО4) = mр-р1•р.в-во1 = 70 (г)•
0,1 = 7 г,
mр.в-во2(Н3РО4) = mр.в-во1(Н3РО4)
+ mпрод(Н3РО4) = 7 + 196х, 000000
mр-р2(Н3РО4) = mр-р1(Н3РО4)
+ mреаг(Р2О5) = 70 + 142х,
р.в-во2(Н3РО4)
= mр.в-во2(Н3РО4) / mр-р2(Н3РО4),
0,4 = (7 + 196х) / (70 + 142х),
х = 0,15, (Р2О5)
= 0,15 моль.
m(P2O5) = M• = 142 (г/моль)•0,15 (моль) = 21,3 г.
О т в е т. m(P2O5) = 21,3 г.
Задача 17. В 240 мл воды опустили 69 г натрия.
Найти массовую долю продукта в растворе.
О т в е т. прод = 39,2 %.
Задача 18. Найти массовую долю кислоты в
растворе, полученном при растворении 33,6 л
сернистого газа в 320 г 5%-го раствора сернистой
кислоты.
О т в е т. р.в-во2(Н2SО3) = 33,4 %.
Задача 19. Какую массу оксида серы(VI) нужно
растворить в 150 мл воды, чтобы получить 60%-й
раствор серной кислоты?
О т в е т. m(SO3) = 144 г.
Задача 20. Найти массу оксида серы(VI),
которую необходимо растворить в 99 г 40%-й серной
кислоты, чтобы получить 80%-й раствор.
О т в е т. m(SO3) = 93 г.
Задача 21. Какую массу оксида фосфора(V)
нужно растворить в 120 г воды, чтобы получить 40%-й
раствор ортофосфорной кислоты?
О т в е т. m(P2O5) = 49 г.
Задача 22. К 180 г 50%-го раствора
ортофосфорной кислоты добавили 42,6 г оксида
фосфора(V). Найти массовую долю кислоты в
полученном растворе.
О т в е т. р.в-во2(Н3РО4) = 66,8 %.
Задача 23. В 20 г воды растворили 3,5 г оксида
натрия. Вычислите массовую долю растворенного
вещества.
О т в е т. (NaOH) = 19,2 %.
Задача 24. К 120 г 8%-го раствора гидроксида
натрия добавили 18,6 г оксида натрия. Вычислите
массовую долю гидроксида натрия в
образовавшемся растворе.
О т в е т. р.в-во(NaOH) = 24,2 %.
Задача 25. Найти массу оксида серы(VI),
которую нужно добавить к 2 л 8%-го раствора серной
кислоты ( = 1,06
г/мл), чтобы массовая доля серной кислоты стала
равной 20 %.
О т в е т. m(SO3) = 248,2 г.
Задача 26. Какую массу фосфора необходимо
сжечь в кислороде, чтобы, растворив полученный
оксид в 1000 г раствора ортофосфорной кислоты с
массовой долей 50 %, получить раствор этой
кислоты с массовой долей 75 %?
О т в е т. m(P) = 173,2 г.
Задача 27. Какую массу натрия необходимо
растворить в 120 мл воды для получения раствора
щелочи с массовой долей 18 %?
О т в е т. m(Na) = 13,8 г.
Г.С.ОСНОВСКАЯ,
учитель химии средней школы № 7
(г. Великие Луки, Псковская обл.)
ЗАДАЧИ на Вычисление массы
растворенного вещества
Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе. Элемент ЕГЭ: 4.3.1. Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе».
Расчёты с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
Раствор — это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности. Растворы состоят из растворителя (например, воды) и растворенного вещества.
Массовой долей растворенного вещества (ω) называют отношение его массы m(В) к массе раствора m(p).
ω(В) = m(В) : m(p)
Это безразмерная величина, поэтому выражается в долях единицы (изменяется от 0 до 1), но иногда выражается в процентах (тогда изменяется от 0 до 100 %).
Обозначение ω(В) аналогично обозначению ω(р. в-ва) или ω(в-ва);
обозначение m(В) аналогично обозначению m(р. в-ва) или m(в-ва);
обозначение m(р) аналогично обозначению m(р-ра),
где р-ра – сокращение слова «раствора», а р. в-ва и в-ва – сокращения слов «растворенного вещества».
Обратите внимание также на следующие обозначения:
m(в) — масса безводного вещества;
m(р-ля) — масса растворителя.
Соотношения между величинами, характеризующими раствор
Следует учитывать, что любой способ выражения содержания растворенного вещества в растворе дается в расчете на безводное вещество, даже если для приготовления раствора использован кристаллогидрат. Если для приготовления растворов используют не безводное вещество, а его кристаллогидрат, B • nH20, то масса растворителя (воды) рассчитывается по формуле: m(H20) = m(р) – m(кр.), где m(кр.) — масса кристаллогидрата, в граммах. Следует учитывать, что количество (моль) кристаллогидрата равно количеству (моль) безводного вещества, т.е. m(кр.) : М(кр.) = m(в) : М(в).
Молярная концентрация характеризует количество растворенного вещества, выраженное, в молях, содержащееся в 1 л раствора. Молярная концентрация вычисляется по формуле С = v / V, где С — молярная концентрация (измеряется в моль/л), v — количество вещества, V — объем раствора, измеренный в литрах. Часто размерность молярной концентрации обозначают символом М. Например, раствор с концентрацией 1 М (одномолярный раствор) содержит 1 моль растворенного вещества в 1л раствора, 0,1 М (децимолярный раствор) — 0,1 моль растворенного вещества в 1 л раствора и т. д.
Титр (Т) определяет массу растворенного вещества (в г), содержащуюся в 1 мл раствора: T = m / V.
Растворимость характеризует способность вещества растворяться в том или ином растворителе. Растворимость обозначается символом S, она равна концентрации насыщенного при данной температуре раствора. Чаще всего растворимость измеряют числом граммов вещества, способных раствориться в 100 г растворителя при данной температуре. Важно не путать растворимость с массовой долей вещества в растворе, так как растворимость показывает, сколько граммов растворенного вещества содержится в 100 г растворителя, а массовая доля — сколько граммов растворенного вещества содержится в 100 г раствора. Растворимость веществ зависит от температуры. Растворимость твердых веществ при повышении температуры, как правило, увеличивается, растворимость газов — уменьшается.
Приготовление растворов. Способы приготовления растворов: 1) Разбавление раствора водой; 2) Выпаривание воды из раствора; 3) Сливание двух растворов; 4) Выпадение кристаллов.
Способы приготовления растворов в задачах на Вычисление массы растворенного вещества
РЕШЕНИЯ ЗАДАЧ с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
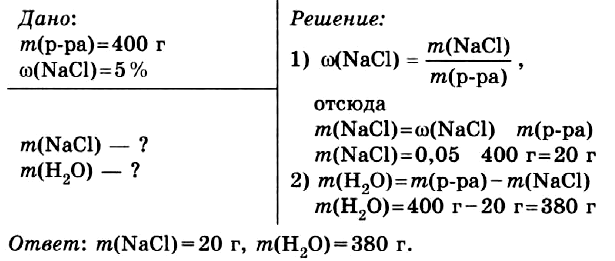
Задача № 1.
Приготовить 400 г водного раствора с массовой долей хлорида натрия в нём 5 %.
Правильный ОТВЕТ: m(NaCl) = 20 г, m(H2O) = 380 г.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 2.
Найти массовую долю растворённого вещества (в %) в растворе, полученном при смешивании 450 г воды и 50 г сахара.
Правильный ОТВЕТ: ω(сах.) = 10%.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 3.
Вычислите молярную концентрацию 4%-ного раствора поваренной соли, плотность которого равна 1,027 г/мл.
Правильный ОТВЕТ: C(NaCl) ≈ 0,7 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 4.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 5.
При 25 °С растворимость хлорида калия в воде составляет 25 г соли на 100 г воды. Вычислите массовую долю соли в насыщенном растворе и его молярную концентрацию, если плотность насыщенного раствора равна 1,132 г/мл.
Правильный ОТВЕТ: ω(KCl) = 20%, С(KCl) = 3,04 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради
Задача № 6.
Массовая доля соли в растворе, насыщенном при температуре 40 °С, равна 35%. При охлаждении 300 г этого раствора до температуры 10 °С в осадок выпадает 45 г соли. Определите растворимость соли при 10 °С.
Правильный ОТВЕТ: S10°С = 30,77 г.
Смотреть РЕШЕНИЯ заданий в тетради
Задачи с ответами
на Вычисление массы растворенного вещества
Задача № 7.
Масса нитрата калия, которую следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%, равна ______. (Записывайте ответ с точностью до десятых.)
Правильный ОТВЕТ: 3,4 г.
Задача № 8.
Плотность 10% -ного раствора хлорида калия составляет 1,063 г/мл. Определите массу (г) хлорида калия, который содержится в 750 мл такого раствора.
Правильный ОТВЕТ: 75,0 г.
Задача № 9.
Рассчитайте массовую долю (%) нитрата натрия в растворе, полученном при смешивании 250 г 10%-ного и 750 г 15%-ного растворов этой соли.
Правильный ОТВЕТ: 13,75 %.
Задача № 10.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Задача № 11.
В 125 г воды растворили 25 г азотной кислоты. Вычислите титр образовавшегося раствора, если его плотность равна 1,095 г/мл.
Правильный ОТВЕТ: T(HNO3) = 0,182 г/мл.
Задача № 12.
Титр раствора сульфата аммония равен 0,223 г/мл, а его плотность — 1,115 г/мл. Рассчитайте массовую долю сульфата аммония в данном растворе и молярную концентрацию раствора.
Правильный ОТВЕТ: ω((NH4)2SO4) = 20%, C((NH4)2SO4) = 1,689 моль/л.
(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «ЗАДАЧИ на Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
Для расчета массы (объема, количества вещества) продукта реакции, если данные по одному из веществ представлены в виде раствора с определенной массовой долей этого растворенного вещества, следует воспользоваться нижеследующим алгоритмом:
1) Прежде всего следует найти массу растворенного вещества. Возможны две ситуации:
* В условии даны масса раствора и массовая доля растворенного вещества (концентрация). В этом случае масса растворенного вещества рассчитывается по формуле:
* В условии даны объем раствора вещества, плотность этого раствора и массовая доля растворенного вещества в этом растворе. В таком случае следует воспользоваться формулой для расчета массы раствора:
После чего следует рассчитать массу растворенного вещества по формуле 1.
2) Рассчитать количество вещества (моль) участника реакции, масса которого стала известна из расчетов выше. Для этого воспользоваться формулой:
3) Записать уравнение реакции и убедиться в правильности расставленных коэффициентов.
4) Рассчитать количество моль интересующего участника реакции исходя из известного количества другого участника реакции, зная, что количества веществ любых двух участников реакции A и B относятся друг к другу как коэффициенты перед этими же веществами в уравнении реакции, то есть:
Если в условии требовалось рассчитать количество вещества, то действия на этом заканчиваются. Если же требуется найти его массу или объем, следует переходить к следующему пункту.
5) Зная количество вещества, определенное в п.4, мы можем рассчитать его массу по формуле:
Также, если вещество является газообразным и речь идет о нормальных условиях (н.у.), его объем может быть рассчитан по формуле:
Рассмотрим пару примеров расчетных задач по этой теме.
Пример 1
Рассчитайте массу осадка, который образуется при добавлении к 147 г 20%-ного раствора серной кислоты избытка раствора нитрата бария.
Решение:
1) Рассчитаем массу чистой серной кислоты:
m(H2SO4) = w(H2SO4) ∙ m(р-ра H2SO4)/100% = 147 г ∙ 20% /100% = 29,4 г
2) Рассчитаем количество вещества (моль) серной кислоты:
n(H2SO4) = m(H2SO4) / M(H2SO4) = 29,4 г/98 г/моль = 0,3 моль.
3) Запишем уравнение взаимодействия серной кислоты с нитратом бария:
H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3
4) В результате расчетов стало известно количество вещества серной кислоты. Осадок представляет собой сульфат бария. Зная, что:
n(BaSO4)/n(H2SO4) = k(BaSO4)/k(H2SO4), где n — количество вещества, а k — коэффициент в уравнении реакции,
можем записать:
n(BaSO4) = n(H2SO4) ∙ k(H2SO4)/k(BaSO4) = 0,3 моль ∙ 1/1 = 0,3 моль
5) Тогда масса осадка, т.е. сульфата бария, может быть рассчитана следующим образом:
m(BaSO4) = M(BaSO4) ∙ n(BaSO4) = 233 г/моль ∙ 0,3 моль = 69,9 г
Пример 2
Какой объем газа (н.у.) выделится при растворении необходимого количества сульфида железа (II) в 20%-ном растворе соляной кислоты с плотностью 1,1 г/мл и объемом 83 мл.
Решение:
1) Рассчитаем массу раствора соляной кислоты:
m(р-ра HCl) = V(р-ра HCl) ∙ ρ(р-ра HCl) = 83 мл ∙ 1,1 г/мл = 91,3 г
Далее рассчитаем массу чистого хлороводорода, входящего в состав кислоты:
m(HCl) = m(р-ра HCl) ∙ w(HCl)/100% = 91,3 г ∙ 20%/100% = 18,26 г
2) Рассчитаем количество вещества хлороводорода:
n(HCl) = m(HCl)/M(HCl) = 18,26 г/36,5 г/моль = 0,5 моль;
3) Запишем уравнение реакции сульфида железа (II) с соляной кислотой:
FeS + 2HCl = FeCl2 + H2S↑
4) Исходя из уравнения реакции следует, что количество прореагировавшей соляной кислоты с количеством выделившегося сероводорода связано соотношением:
n(HCl)/n(H2S) = 2/1, где 2 и 1 — коэффициенты перед HCl и и H2S соответственно
Следовательно:
n(H2S) = n(HCl)/2 = 0,5/2 = 0,25 моль
5) Объем любого газа, находящегося при нормальных условиях, можно рассчитать по формуле V(газа) = Vm ∙ n(газа), тогда:
V(H2S) = Vm ∙ n(H2S) = 22,4 л/моль ∙ 0,25 моль = 5,6 л
Автор: С.И. Широкопояс https://scienceforyou.ru/
Задачи на растворы.
Задача №1.Смешали 200 г воды и 50 г гидроксида натрия. Определить массовую долю вещества в растворе.
Задача №2.Определить массу соли и объем дистиллированной воды, необходимых для получения 230г 12% поваренной раствора.
Задача №3. 180г 15%-ного раствора хлорида бария выпарили до массы раствора 145г. Какова стала процентная концентрация раствора?
Задача №4. Смешали 250г 30% и 150г 20% растворов серной кислоты. Выразите содержание вещества в процентах в приготовленном растворе.
Задача №5. Определите массу и концентрацию раствора, который нужно добавить к 13г 8% раствора, чтобы получить 40г 14% раствора.
Задача №6. Определить массу 10% раствора карбоната натрия, который нужно добавить к 1020г 2%-ного раствора, чтобы получить 3%-ный раствор.
Задача №7. Определить массу 7%-ного раствора соли, в котором необходимо растворить ещё 20г этой соли, чтобы получить 12 %-ный раствор.
Самостоятельная работа.
Задача 1. Рассчитайте массы 10 и 50%-ных растворов гидроксида калия, необходимых для приготовления 400г 25%-ного раствора.
Задача 2. Определить массу 20%-ного раствора соли, который нужно добавить к 40г 10%-ного раствора той же соли, чтобы получить 17%-ный раствор.
Рассмотрим несколько способов решения задач на приготовление растворов.
Раствор состоит из двух частей: растворенного вещества и растворителя.
Чаще всего растворителем является вода. Массовая доля растворённого вещества зависит от содержания вещества в растворе и может быть выражена в процентах или долях.
; W%любого чистого вещества равна 100%. W% воды равна нулю, то есть, вещества в чистой воде нет. При этом сумма веществ в исходных растворах равна содержанию вещества в конечном растворе.
Первый способ последовательный.
Решается с оформлением данных и использованием формул.
1) ; 2)
; 3)
Если дается объем раствора, его надо пересчитать на массу. m(р-ра)= V×ρ.
Если надо рассчитать объем раствора, сначала рассчитывается масса, а затем объем.
Если не известна масса раствора, и масса вещества, но известна массовая доля, (например она = 20%),
тогда масса раствора выражается через X; m(р-ра) = X;====m(в-ва) = m(р-ра) × W в данном случае m (в-ва) = X× 0,2
Второй способ алгебраический.
Исходим из того, что массы веществ исходных растворов равны массе вещества конечного раствора. При этом масса вещества рассматривается как произведение массы раствора и массовой доли вещества в растворе. (W, удобнее выразить от единицы в долях).
m(р-ра)1×w+ m( р-ра)2×w =m(р-ра)3 ×w
Третий способ диагональный или метод креста.
В данном случае массовые доли располагаются следующим образом: слева сверху самая большая из приведённых в условии, под ней самая маленькая, в центре средняя, по диагонали вычитаем от большей массовой доли меньшую, записываем результат. Параллельно массовым долям на расстоянии от диагонали указываем соответствующие массы растворов.
НАПРИМЕР: в правой части диагонали получились три % отношения, мы выбираем наиболее удобное, так как при расчете любого отношения получим одинаковый результат. W берется в процентах.
|
|
|
10 |
m(р-ра)100% |
|
|
20% |
+ |
|||
|
|
|
|
||
|
10% |
80 |
m(р-ра) 10% |
||
|
90 |
m(ра-ра) 20% |
Примеры решения задач
а) На приготовление растворов
Задача №1.Смешали 200 г воды и 50 г гидроксида натрия. Определить массовую долю вещества в растворе.
1 способ
|
Дано: |
Решение |
|
m(H2O)= 200г m(NaOH)= 50г |
т(р-ра) =m(в-ва) +m(H2O) m(р-ра) = 50+ 200 = 250
|
|
w% =? |
Ответ:ω=20% |
2 способ РЕШЕНИЕ
|
1 |
0 |
Х |
|
|
+ |
= |
50 × 1+200×0=250×Х; 50=250Х; Х= 0,2 или 20%
Дано:
|
m(H2O)200г————0% |
Предполагаем значение Х 0Х |
|
m(в-ва)50г ————-100% |
|
|
m(р-ра)250г————x% |
3 способ РЕШЕНИЕ
|
|
|
Х |
___50г |
|
|
Х% |
+ |
|||
|
|
|
Ответ: ω=20% |
||
|
0% |
100-Х |
___200 |
||
|
100 |
250 |
Задача №2.Определить массу соли и объем дистиллированной воды, необходимых для получения 230г 12% поваренной раствора.
1 способ
|
Дано: |
Решение |
|
m(р-ра)=230г W% =12% |
V= m×ρ; ρ(H2O)=1г⁄л отсюда m(H2O)=V(H2O m(H2O)= m(р-ра) – m(H2O); m(H2O) =230 – 27,6 =202,4г V(H2O) =m(H2O) Ответ. m(в-ва)=27,6г, V(H2O)=202,4мл |
|
m(в-ва)-?, V(H2O)-? |
Ответ: m(в-ва)=27,6г; V(H2O)= 202,4мл |
2 способ. РЕШЕНИЕ
|
1 |
0 |
0,12 |
||
|
|
+ |
|
= |
|
|
В-ВО |
ВОДА |
Р-Р |
x×1+(230-x)×0=230×0,12; x=27,6; m(H2O)= 230-27,6=202,4г
3 способ
Дано:
|
m(р-ра)230г____________12% |
|
|
m(в-ва)x________________100% |
|
|
m(H2O)230-x____________ 0% |
РЕШЕНИЕ
|
|
12 |
___Хг |
||
|
|
||||
|
|
+ |
|||
|
|
Ответ: m(в-ва)=27,6г; V(H2O)= 202,4мл |
|||
|
0% |
88 |
___230-Х |
||
|
100 |
230 |
б) На смешивание растворов
Задача №1. Смешали 250г 30% и 150г 20% растворов серной кислоты. Выразите содержание вещества в процентах в приготовленном растворе.
2 Способ РЕШЕНИЕ
|
0,3 |
0,2 |
Х |
||
|
|
+ |
|
= |
|
|
Р-Р |
Р-Р |
Р-Р |
250×0,3 +150×0,2 = 400×x;
75+30 = 400x; x=0,26 или 26%
Ответ. W% = 26%
3 Способ
|
Дано: |
Предполагаем значение Х 30×20 |
|
m(р-ра №1)250г ———30% |
|
|
m(р-ра №2)150г———-20% |
|
|
m(р-ра №3)400г———-x% |
РЕШЕНИЕ
|
|
|
Х-20 |
______250г |
Ответ. W% = 26% |
|
|
+ |
|||
|
|
||||
|
20% |
30-Х |
______150 |
||
|
10 |
400 |
Задача №2. Определите массу и концентрацию раствора, который нужно добавить к 13г 8% раствора, чтобы получить 40г 14% раствора.
2 способ РЕШЕНИЕ
|
0,08 |
х |
0,14 |
||
|
|
+ |
|
= |
|
|
Р-Р |
Р-Р |
Р-Р |
13×0,08 + 27x =40×0,14; 1,04 + 27x = 5,6; 27x =5,6 – 1,04; 27x =4,56; ×= 0,169 или16,9%
Ответ. W% = 16,9%
3Спосб
Дано:
|
m(р-ра1)13г———8% |
Предполагаем значение Х 148 |
|
m(р-ра2)40-13——x% |
|
|
m(р-ра3)40г——-14% |
РЕШЕНИЕ
|
|
|
6 |
____27г |
(× — 8)×27 =6×40; 27x -216 =240; 27x =240-216; 27x =456; x =16,9% Ответ: W% = 16,9% |
|
|
+ |
|||
|
|
||||
|
8% |
Х-14 |
_____13г |
||
|
Х-8 |
40г |
в) На упаривание
Задача №1. 180г 15%-ного раствора хлорида бария выпарили до массы раствора 145г. Какова стала процентная концентрация раствора?
2Способ РЕШЕНИЕ
|
0,15 |
0 |
Х |
||
|
|
— |
|
= |
|
|
Р-Р |
вода |
Р-Р |
180×0,15 – (35×0) =145×x; 27 =145x; x= 0,186 или 18,6%; Ответ. W% = 18,6%
3 способ
Дано:
|
m(р-ра1)180г—-15% |
Предполагаем значение Х 15 0 |
|
m(воды)180-145г—0% |
|
|
m(р-ра3)145г——-x |
РЕШЕНИЕ
|
|
|
15 |
______145г |
Ответ: ω=18,6% |
|
15% |
+ |
|||
|
|
|
|||
|
0% |
Х-15 |
______35 |
||
|
Х |
180 |
г) Действия с одним известным раствором
Задача №1. Определить массу 10% раствора карбоната натрия, который нужно добавить к 1020г 2%-ного раствора, чтобы получить 3%-ный раствор.
1Способ
|
Дано: |
Решение |
|
m(р-ра) = 1020г W%(1) =2% W%(2) =10% W%(3) =3% |
1.рассчитаем массу вещества в 2-х%-ном растворе m(в-ва) =1020×0,02 = 20,4г 2.выразим массу 10%-ного раствора через х m10%-ного р-ра =х тогда m(в-ва) =Х× 0,1 3.выразим массу 3-х%-ного раствора m 3-х%-ного =1020 + Х m(в-ва) =(1020+Х) × 0,03 ∑m(в-в) исходных растворов = m(в-ва) конечного раствора 20,4 + 0,1Х = (1020+Х)× 0,03; 20,4 +0,1Х = 30,6 +0,03Х; 0,1Х – 0,03Х =30,6- 20,4; 0,07Х =10,2; Х = 145,7(10%) m 3%-ного р-ра = 1020+145,7 = 1165,7г Ответ. m 10% = 145,7г |
|
m 10%-? |
2Способ РЕШЕНИЕ.
|
0,02 |
0,1 |
0,03 |
||
|
|
+ |
|
= |
|
|
Р-Р |
Р-Р |
Р-Р |
1020×0,02 +Х×0,1 =(1020 +Х)×0,03
20,4 + 0,1Х =30,6 + 0,03Х; 0,1Х – 0,03Х =10,2; Х = 145,7г.
3Способ
Дано:
|
m(р-ра1)1020г ———-2% |
Предполагаем значение Х 0Х |
|
m (р-ра2)Хг ————-10% |
|
|
m(р-ра3)1020+Х———3% |
РЕШЕНИЕ
|
|
1 |
____Хг |
||
|
|
||||
|
|
+ |
|||
|
|
Ответ:145г |
|||
|
2% |
7 |
_____1020г |
||
|
8 |
1020+Х |
Задача №2. Определить массу 7%-ного раствора соли, в котором необходимо растворить ещё 20г этой соли, чтобы получить 12 %-ный раствор.
1 Способ
|
Дано: |
Решение |
|
m(в-ва)=20г W%=7% W%=12% |
m 7%=Х тогда m(в-ва)=Х×0,07 m 12% =Х+ 20 тогда m(в-ва) =(Х+ 20) ×0,12 ∑m(в-в) исходных растворов = m(в-ва) конечного раствора 20 + 0,07Х=(Х+20)×0,12 17,6 =0,05Х; Х =352г |
|
m7%- ? |
Ответ:m 7% = 352г |
2 Способ РЕШЕНИЕ.
|
1 |
0,07 |
0,12 |
||
|
|
+ |
|
= |
|
|
В-во |
Р-Р |
Р-Р |
20 + 0,07Х = (20+Х)× 0,12; Х = 352г
3 Способ
Дано:
|
m(в-ва)20г——100% |
|
|
m(р-ра)Хг——— 7% |
|
|
m(р-ра)20+Х——12% |
РЕШЕНИЕ
|
|
5 |
______20г |
||
|
|
||||
|
|
+ |
|||
|
|
Ответ:352г |
|||
|
7% |
88 |
_____Х |
||
|
93 |
20+Х |
Задача №3. Определить массу 20%-ного раствора соли, который нужно добавить к 40г 10%-ного раствора той же соли, чтобы получить 17%-ный раствор.
1Способ
|
Дано: |
Решение |
|
m(р-ра) = 40г W%= 10% W% = 20% W% =17% |
m(в-ва) = 40× 0,1 =4г m(20%) =Х тогда m(в-ва) =Х×0,2 m(17%)= 40 +Х тогда m(в-ва) =(40 + Х) × 0,17 ∑m(в-в) исходного раствора = m(в-в) нового раствора 4 + 0,2Х =(40+Х)× 0,17 4+ 0,2Х =6,8 + 0,17Х; 0,2Х – 0,17Х =6,8 – 4; 0,03Х = 2,8; Х =93,3г |
|
m(20%) = ? |
Ответ: m 20% = 93,3г |
2Способ РЕШЕНИЕ.
|
0,1 |
0,2 |
0,17 |
||
|
|
+ |
|
= |
|
|
Р-Р |
Р-Р |
Р-Р |
40× 0,1 + 0,2Х = (40 +Х) × 0,17; 4 +0,2Х = 6,8 + 0,17Х; 0,03Х =2,8; Х =93,3г
3Способ Дано:
|
m(р-ра)40г——10% |
|
|
m(р-ра)Х ——-20% |
|
|
m(р-ра)40+Х—17% |
РЕШЕНИЕ
|
|
|
7 |
______Хг |
Ответ:93,3г |
|
|
+ |
|||
|
|
||||
|
10% |
3 |
_____40 |
||
|
10 |
40+Х |
Задача №4. Рассчитайте массы 10 и 50%-ных растворов гидроксида калия, необходимых для приготовления 400г 25%-ного раствора.
1Способ РЕШЕНИЕ.
|
Дано: |
Решение |
|
m(р-ра)=400г W% =25% W% =10% W% =50% |
m(в-ва) = 400 ×0,25 =100г m(р-ра 10%) = Х тогда m(в-ва) =0,1Х m(р-ра50%) =400-Х тогда m(в-ва) =(400-Х)× 0,5 = 200 – 0,5Х ∑веществ исходных растворов =массе вещества в новом растворе. 0,1Х+ 200 – 0,5Х = 100 100 = 0,4Х; Х = 250г(это 10%) m(20%) =400 – 250 =150г Ответ: m 10% =250г, m 50% = 150г |
|
m(10%)=? m(50%)=? |
2Способ РЕШЕНИЕ.
|
0,1 |
0,5 |
0,25 |
||
|
|
+ |
|
= |
|
|
Р-Р |
Р-Р |
Р-Р |
0,1Х + (400-Х)× 0,5 = 400 × 0,25; 0,1х + 200 – 0,5х =100; х = 250Г(10%); 400-250=150(50%)
3Способ Дано:
|
m(р-ра)400г—-25% |
|
|
m(р-ра)Хг ——10% |
|
|
m(р-ра)400- Х—50% |
РЕШЕНИЕ
|
|
|
15 |
____400-Х |
400 – 250 = 150(50%) Ответ: m 10% =250г, m 50% = 150г |
|
|
+ |
|||
|
|
||||
|
10% |
25 |
____Хг |
||
|
40 |
400г |
д) Расчёты с использованием кристаллогидратов
Задача №1. К 200г 20%-ного раствора сульфата меди прибавили 50г медного купороса. Определите массовую долю растворённого вещества полученного раствора.
2Способ РЕШЕНИЕ.
|
0,64 |
0,2 |
Х |
||
|
|
+ |
|
= |
|
|
Медный купорос |
Р-Р |
Р-Р |
CuSO4 5H2O
Mr(CuSO4 5H2O)= 160+90= 250
W%(CuSO4)=160/250 =0,64
50 × 0,64 + 200×0,2 =250Х; 32+40=250Х; 72=250Х; Х=0,288 или 28,8%
Ответ. W%(CuSO4)=28,8%
3Способ Дано:
|
m(крист. гид.)50——64% |
Предполагаем значение Х 64 Х 20 |
|
m(р-ра)200г————20% |
|
|
m(р-ра)250г————Х% |
РЕШЕНИЕ
|
|
|
Х-20 |
____50г |
(Х-20)×250=44×50 250Х-5000=2200 250Х =7200; Х=28,8% Ответ:ω=28,8% |
|
|
+ |
|||
|
|
||||
|
20% |
64-Х |
____200 |
||
|
44 |
250 |
е) Расчёты с использованием молярной концентрации
Задача №1.Каким объёмом воды нужно разбавить 500мл 0,5М раствор глюкозы, чтобы получить физиологический 0,1М-ый раствор?
Дано:
|
V(воды)Хл———0М |
|
|
V(р-ра)0,5л——-0,5М |
|
|
V(р-ра)0,5+Х——0,1М |
РЕШЕНИЕ
|
0,5М |
|
0,1 |
____0,5л |
|
|
0,1М |
+ |
|||
|
|
|
Ответ:V(воды)= 2л |
||
|
0М |
0,4 |
____Хл |
||
|
0,5 |
0,5+Х |
Или 0,5М/0М также как 0,1М/0,4М; 0,4 больше 0.1 в 4 раза тогда V(H2O) больше V0,5М раствора тоже в 4 раза отсюда 0,5 × 4 = 2
ж) Не стандартные задачи
Задача №1.Смешали два раствора массой 8кг и 2кг, получили 12%-ный раствор. Потом смешали те же растворы одинаковой массы и получили 15%-ный раствор. Рассчитать концентрации исходных растворов.
Составим математическое выражение. Выразим концентрацию через Х и У
_________________________. ____________________________________.
-6У = -1,2 6Х = 0,6
У =0,2 или 20% Х =0,01 или 10%
Задача №2. В свежих грибах 92% воды, а в сухих 8% воды, сколько сухих грибов можно получить из 23кг свежих?
-
W% грибов в свежих грибах 100 – 92% = 8%
-
W% грибов в сухих грибах100 – 8% =92%
|
0,08 |
0 |
0,92 |
||
|
|
— |
|
= |
|
|
Свежие грибы |
Вода |
Сухие грибы |
23×0,08 -0 =(23-Х)×0,92; 1,84 =21,16 -0,92Х; 0,92Х =19,32; Х= 21кг(это вода)
Масса сухих грибов =23 -21 =2кг.
Ответ m сухих грибов=2кг
Задача №3. В каком отношении надо смешать 5% и70%-ные растворы азотной кислоты, чтобы получить 20%-ный раствор?
|
|
|
15г |
Надо смешать 5% и70%-ные растворы азотной кислоты 50/15 или 5/3 тогда получим 20% раствор. Ответ. 5: 3 |
|
|
|||
|
|
|||
|
5% |
50г |
з) Расчёты, связанные с растворимостью и кристаллизацией Задача
Задача №1.Массовая доля хлорида меди (2) в насыщенном при t=20грС растворе этой соли равна 42,7%. Определите коэффициент растворимости хлорида меди(2), при данной t.
Коэффициент растворимости – это растворимость вещества в 100граммах воды, при данной t. Чтобы его рассчитать, надо определить содержание соли и воды в 42,7%-ном растворе.
1.Рассчитаем содержание воды и вещества в растворе.
100 -42,7 =57,3г(воды)
2.Рассчитаем, сколько соли растворяется в 100г воды.
Ответ. коэффициент растворимости=74,5г
Задача №2. Насыщенный при 60°C раствор соли в количестве 20кг был охлаждён снегом, какое количество соли выпало в осадок, если при 60°C растворимость соли составляет110г, а при 0°C -13,1г. Рассчитайте выход продукта в процентах.
|
60°C к.р.——110г |
0°C к.р.——-13,1г |
|
m(р-ра)20кг=20000г ——- 1.Приготовим стандартный раствор 100+110=210 2.Рассчитаем массу вещества в 20000г р-ра 3.Ррассчитаем массу воды 20000 -10476,2 = 9523,8г |
———↓ ? 4.Рассчитаем массу вещества растворённого в 9523,8г воды при 0°C. 5.Рассчитаем массу осадка 10476,2 – 1247,6 =9228,6г 6.Выразим массу ↓ в %-тах |
Ответ. η = 88,1%
Задача №3. При перекристаллизации соли, растворимость которой при 100°C =48,6г, а при 20°C=16,45г, было получено при охлаждении в интервале указанных температур 0,5кг вещества. Сколько было взято соли и воды для перекристаллизации?
|
100°C К. Р.——-48,6Г |
20°C к.р. ————16,45г |
|
m(в-ва)—?, m(воды)—-? ———— 2.Рассчитаем массу вещества 3.Расчитаем массу воды |
———m↓ 500г 1.Рассчитаеммассу стандартного осадка. m ↓= 48,6 -16,45 =32,15г. |
Ответ m(в-ва)= 755,73г, m(воды)= 1555г.
Задача №4. Растворимость хлората калия при 70°C =30,2г, а при 30°C =10,1г в 100г воды. Сколько граммов вещества выделится из 70г насыщенного при 70°C раствора, если его охладить до 30°C?
|
70°C к.р.———30,2г |
30°C к.р. ————10,1г |
|
m(р-ра)= 70г ————— 1.Рассчитаем массу стандартного раствора 100+30,2=132,2г 2.Рассчитаем массу вещества в 70г раствора 3.Рассчитаем массу воды 70- 16,24 = 53,76г |
———↓ -? 4.Рассчитаем массу вещества для 53,76г воды при 30°C 5.Рассчитаем массу осадка 16,24 – 5,43 = 10,81г |
Или можно массу осадка рассчитать через воду
m↓ = 30,2- 10,1 =20,1
Ответ m(в-ва)= 10,8г
Задача №5. При н.у. в воде массой 100г растворяется хлороводород объёмом 50,5л. При t= 50°C и нормальном давлении коэффициент растворимости хлороводорода равен 59,6г. Насыщенный при t = 0°C раствор соляной кислоты массой 40г нагрет до t=50°C. Определите массу полученного раствора.
|
50°C к.р. ——-59,6г |
0°Cг к.р.———-50,5л |
|
m(р-ра)—-? 5.Рассчитаем массу вещества растворившегося в 22г воды 6.Ррассчитаем массу раствора 22 + 13,1 = 35,1г |
———— m(р-ра)=40г 1.Переведем объём в массу М(НСI)=36,5г/моль 2.Рассчитаем массу стандартного раствора 100+82,3=182,3г 3.Рассчитаем массу воды в 40г раствора 4.Рассчитаем массу вещества 40 – 22 = 18г |
Ответ m(р-ра)= 35,1г
Или можно через стандартные массы растворов
1.Рассчитаем стандартные массы растворов
|
50°C; 100+59,6=159,6г |
0°C; 100+82,3=182,3 |
Алгоритм нахождения массы растворенного вещества и массы воды, необходимые для приготовления раствора.
Задача.
Вычислить
массу соли и воды, необходимые для
приготовления 40 г раствора NаСl
с массовой долей 5%.
1.
Запишите условие задачи с помощью
общепринятых обозначений
Д
m р-ра
= 40г
ω = 5%
m (NаСl)
— ?
m (Н2О)
— ?
Решение:
1. Рассчитайте
массу растворенного вещества по формуле:
m в-ва=
ω ∙
m р-ра/100%
m
(NаСl)
= 5% · 40г/100% = 2г
2. Найдите массу
воды по разности между массой раствора
и массой растворенного вещества:
m р-ля
= m р-ра
– m в-ва
m
(Н2О)
= 40г – 2г = 38 г.
3.
Запишите
ответ.
Ответ: для
приготовления раствора необходимо
взять 2г соли и 38г воды.
Алгоритм нахождения массовой доли растворенного вещества при разбавлении (упаривании) раствора
Задача
К
15% раствору, масса которого 80г, добавили
30г воды. Какой стала массовая доля
растворённого вещества в полученном
растворе?
1. Запишите условие
задачи с помощью общепринятых обозначений.
Д
ω1
= 15%
mр-ра1=80г
m(Н2О)
= 30г
ω2-?
Решение:
1. В результате
разбавления (упаривания) раствора масса
раствора увеличилась (уменьшилась), а
вещества в нём осталось столько же.
Рассчитайте массу
растворённого вещества, преобразуя
формулу:
ω = m в-ва
/m р-ра
∙ 100%
m в-ва
= ω1·
mр-ра1
/100%
m
в-ва
= 15% · 80г = 12г
2. При разбавлении
раствора общая масса его увеличивается
(при упаривании — уменьшается).
Найдите массу
вновь полученного раствора:
m
р-ра2
= m
р-ра1 +
m(H2O)
m р-ра2
= 80г + 30г=110г
3. Рассчитайте
массовую долю растворённого вещества
в новом растворе:
ω2
= m в-ва /
m р-ра2
∙ 100%
ω2
= 12г/ 110г· 100% = 10,9%
4. Запишите ответ
Ответ:
массовая доля растворенного вещества
в растворе при разбавлении равна 10,9%
Алгоритм решения задач по «правилу креста»
Для получения
раствора с заданной массовой долей (%)
растворенного вещества путем смешивания
двух растворов с известной массовой
долей растворенного вещества пользуются
диагональной схемой («правило креста»).
Сущность этого
метода состоит в том, что по диагонали
из большей величины массовой доли
растворенного вещества вычитают меньшую.
|
a с – в / с / в а – с |
где а – большая, |
Разности (с-в) и
(а-с) показывают, в каких соотношениях
нужно взять растворы а и в, чтобы получить
раствор с.
Если
для разбавления в качестве исходного
раствора используют чистый растворитель,
например, Н20,
то концентрация его принимается за 0 и
записывается с левой стороны диагональной
схемы.
Задача
Для
обработки рук хирурга, ран, послеоперационного
поля используется йодная настойка с
массовой долей 5%. В каком массовом
соотношении нужно смешать растворы с
массовыми долями йода 2,5% и 30%, чтобы
получить 330 г йодной настойки с массовой
долей йода 5%?
1. Запишите условие
задачи с помощью общепринятых обозначений.
Д
ω1
= 30%
ω2
= 2,5%
ω3
= 5%
m3
= 330г
m1
= ?
m2
= ?
Решение:
1. Составьте
«диагональную схему». Для этого
запишите массовые доли исходных растворов
друг под другом, по левую сторону креста,
а в центре заданную массовую долю
раствора.
2,5
/
5
/
30
2.
Вычитают из бóльшей массовой доли
меньшую (30–5=25; 5–2,5=2,5) и находят результаты.
Записывают найденные
результаты с правой стороны диагональной
схемы: при возможности сокращают
полученные числа. В данном случае 25 в
десять раз больше, чем 2,5, то есть вместо
25 записывают 10, вместо 2,5 пишут 1.
30 2,5 (1)
/
5
/
2,5 25 (10)
Числа
(в данном случае 25 и 2,5 или 10 и 1)называют
массовыми числами. Массовые числа
показывают, в каком соотношении необходимо
взять исходные растворы, чтобы получить
раствор с массовой долей йода 5%.
3. Определите массу
30% и 2,5% раствора по формуле:
m
р-ра
= число частей · m3/
сумму массовых частей
m1(30%)
= 1· 330г /1+10 = 30г
m2(2,5%)
= 10 · 330г/ 1+10 = 300г
4. Запишите ответ.
Ответ:
для приготовления 330 г раствора с массовой
долей йода 5% необходимо смешать 300 г
раствора с массовой долей 2,5% и 30 г с
массовой долей 30%.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #







 100%
100%