Zn+2HCl = ZnCl2 + H2
Из стехиометрических коэффициентов уравнения реакции можно сделать вывод, что 1 моль цинка взаимодействует с 2 моль соляной кислоты с образованием 1 моль хлорида цинка и 1 моль газообразного водорода. Из условия задачи следует, что получено 10 моль соли, а исходя из анализа уравнения делаем вывод, что для получения 10 моль соли было взято 10 моль цинка и 20 моль соляной кислоты.
M (Zn) = 65 г/моль
m (Zn) = n (Zn) * M (Zn) = 10 моль*65 г/моль = 650 г
M (HCl) = 36.5 г/моль
m (HCl) = n (HCl) * M (HCl) = 20 моль*36,5 г/моль = 730 г
Ответ: Для получения 10 моль соли было израсходовано 10 моль или 650 г цинка и 20 моль или 730 г соляной кислоты.
Zn+2HCl = ZnCl2 + H2
Из стехиометрических коэффициентов уравнения реакции можно сделать вывод, что 1 моль цинка взаимодействует с 2 моль соляной кислоты с образованием 1 моль хлорида цинка и 1 моль газообразного водорода. Из условия задачи следует, что получено 10 моль соли, а исходя из анализа уравнения делаем вывод, что для получения 10 моль соли было взято 10 моль цинка и 20 моль соляной кислоты.
M(Zn) = 65 г/моль
m(Zn) = n(Zn)*M(Zn) = 10 моль*65 г/моль = 650 г
M(HCl) = 36.5 г/моль
m(HCl) = n(HCl)*M(HCl) = 20 моль*36,5 г/моль = 730 г
Ответ: Для получения 10 моль соли было израсходовано 10 моль или 650 г цинка и 20 моль или 730 г соляной кислоты.
Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического»
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход:
I. Первый тип задач
Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
| 1. Записываем краткое условие задачи |
Дано: m (Mg) = 1,2 г m практическая(MgSO4) = 5,5 г _____________________ Найти: |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(Mg) = 24 г/моль M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль |
| 5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим |
II. Второй тип задач
Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
|
1. Записываем краткое условие задачи |
Дано: m(CaO) = 16,8 г
___________________ Найти: m практ (CaC2) = ? |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
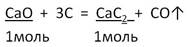 |
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(CaO) = 40 + 16 = 56 г/моль M(CaC2) = 40 + 2 · 12 = 64г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль |
|
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
|
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г Ответ: m практич (CaC2) = 15,36 г |
III. Третий тип задач
Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
| 1. Записываем краткое условие задачи |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = 28,56 л = 85% или 0,85 ____________________ Найти: m(Na2CO3) =? |
| 2. Находим по ПСХЭ молярные массы веществ, если это необходимо | M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль |
|
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы: |
Vтеоретич(CO2) = = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 5. Находим количество вещества реагента по УХР |
По УХР:
ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
6. Определяем массу (объём) реагента по формуле: m = ν · M V = ν · Vm |
m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г |
IV. Решите задачи
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Задача №2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Задача №3. Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Задача №4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
Опубликовано 22.08.2017 по предмету Химия от Гость
>> <<
Вычислите массу и количество вещества исходных веществ израсходованных на получение 10 моль соли. Схема уравнения : Zn + HCl → ZnCl2 + H2
Ответ оставил Гость
Zn+2HCl = ZnCl2+H2
n(Zn)=10 моль
m(Zn)=10*65=650 г
n(HCl)=10*2=20 моль
m(HCl)=36.5*20=730 г
n(ZnCl2)=10 моль
m(ZnCl2)=10*136=1360 г
n(H2)=10 моль
m(H2)=10*2=20 г
Оцени ответ
Подпишись на наш канал в телеграм. Там мы даём ещё больше полезной информации для школьников!

Найти другие ответы
Загрузить картинку
Дано:
m(соли) = ?
V(H₂O) = ?
m(р-ра) = 240г.
ω(р-ра) = 6%
Решение:
ω(р-ра) = (m(в-ва)/m(р-ра) · 100, где m(р-ра) = m(H₂O) + m(в-ва)
6 =
x = 14,4
m(в-ва) = 14,4г.
240 = x + 14,4
x = 225,6
m(H₂O) = 225,6
n =
Mr(H₂O) = 2 + 16 = 18 г/моль
n(H₂O) = моль.
V(H₂O) = n · Vm = 12,5 · 22,4 = 280л.
Ответ: m(соли) = 14,4 г. V(H₂O) = 280л.

