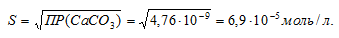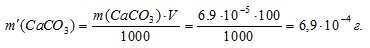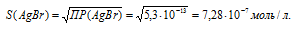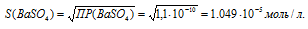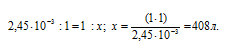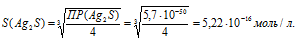Решение задач по хими на вычисления с использованием значения произведения растворимости соли
Задача 563.
Исходя из произведения растворимости карбоната кальция, найти массу СаСО3, содержащуюся в 100 мл его насыщенного раствора.
Решение:
ПР(СаСО3) = 4,76 . 10-9.
Обозначим искомую растворимость соли СаСО3 через S моль/л. Тогда в насыщенном растворе соли содержится по S моль/л ионов Ca2+ и CO32-.
Выражение произведения растворимости карбоната кальция можно записать как:
ПР(СаСО3) = [Ca2+] . [CO32-] = S . S = S2.
Отсюда
Теперь рассчитаем массу СаСО3 в 1 л насыщенного раствора его:
m(СаСО3) = S . M(СаСО3) = (6,9 . 10-5) . 100 = 6,9 . 10-2.
Находим массу СаСО3 в 100 мл насыщенного раствора его:
Ответ: 6,9 . 10-4 г.
Задача 564.
Найти массу серебра, находящегося в виде ионов в 1 л насыщенного раствора АgВг.
Решение:
ПР(АgВг) = 5,3 . 10-13.
Обозначим искомую растворимость соли АgВг. через S моль/л. Тогда в насыщенном растворе соли содержится по S моль/л ионов Ag+ и Br—.
Выражение произведения растворимости бромида серебра можно записать как:
ПР(AgBr = = [Ag+] . [Br—] = S . S = S2.
Отсюда
Рассчитаем массу АgВг в 1л раствора, учитывая, что M(Ag+) = 107,688 г/моль, получим:
m(Ag+) = S . M(Ag+) = (7,28 . 10-7) . 107,688 = 7,85 . 10-5 г.
Ответ: 7,85 . 10-5 г.
Задача 565.
Вычислить объем воды, необходимый для растворения при 25°С 1 г ВаSO4.
Решение:
ПР(ВаSO4) = 1 . 10-10.
Уравнение диссоциации ВаSO4 имеет вид:
ВаSO4 ⇔ Ba2+ + SO42-.
Обозначим искомую растворимость соли ВаSO4 через S моль/л. Тогда в насыщенном растворе соли содержится по S моль/л ионов Ba2+ и SO42-.
Выражение произведения растворимости сульфата бария можно записать как:
ПР(AgBr) = [Ba2+] . [SO42-] = S . S = S2.
Отсюда
Рассчитаем массу ВаSO4 в 1л раствора, учитывая, что M(ВаSO4) = 233,39 г/моль, получим:
m(ВаSO4) = S . M(ВаSO4) = (1,049 . 10-5) . 233,39 = 2,45 . 10-3 г.
Находим объём воды, в котором растворится 1 г ВаSO4 для получения насыщенного раствора его из пропорции:
Ответ: 408 л.
Задача 566.
В каком объеме насыщенного раствора Ag2S содержится 1 мг растворенной соли?
Решение:
M(Ag2S) = 247,796 г/моль.
Обозначим искомую растворимость соли Ag2S через S моль/л. Тогда в насыщенном растворе соли содержится 2S моль ионов Ag+ и 1 моль ионов S2-.
Выражение произведения растворимости сульфида серебра можно записать как
ПР(Ag2S) = [Ag+]2 . [S2-] = 2S2 . S = 4S3.
Отсюда
Рассчитаем массу Ag2S в 1л раствора, учитывая, что M(Ag2S) = 247,796 г/моль, получим:
m(Ag2S) = S . M(Ag2S) = (5,22 . 10-16) . 247,796 = 1,3 . 1013 г или 1,3 . 1010 мг.
Находим объём воды, в котором можно растворить 1 мг сульфида серебра из пропорции:
Ответ: 7,69 . 10-11 л.
Найдите правильный ответ на вопрос ✅ «Найти массу серебра. находящегося в виде ионов в 1 л насыщенного раствора AgBr. ПР. agbr равно 6*10^ (-13) …» по предмету 📘 Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Главная » Химия » Найти массу серебра. находящегося в виде ионов в 1 л насыщенного раствора AgBr. ПР. agbr равно 6*10^ (-13)
Задача на произведение растворимости.
(1) Пишем реакцию, по коэффициентам находим отношение молей исходных веществ:
2 AgNo3+Na2CO3=Ag2CO3+2NaNO3
2 моль 1 моль
(2) находим количества веществ в исходных растворах, для AgNO3 n=m/M (перевести мг —> г), для Na2CO3 n=V*C (перевести мл —> л):
n(AgNO3)=m/M=85/170=0,5 ммоль
n(Na2CO3)=V*c=0,47*0,01=0,47 ммоль
(3) В рез. реакции получились по стехиометрии 0,5 ммоль осадка Ag2CO3, в избытке остаются 0,47-0,25=0,22 ммоль осадителя Na2CO3, общий объем раствора V=47+53=100 мл=0,1л
Избыточная концентрация осадителя:
C(Na2CO3)=0,22/100 = 2,2*10^-3 ммоль/мл=2,2*10^-3 (моль/л)
Растворимость Ag2CO3 в избытке растворителя (формула 41):
S (Ag+)= Ks (Ag2CO3)/C(Na2CO3)=1,2*10^-12/2,2*10^-3=5,5*10^-10 (моль/л)
Тогда: m(Ag+)= S*V*M(Ag+)=5,5*10^-10*0,1*108=5,94*10^-9 (г)
Вася Иванов
Мореплаватель — имя существительное, употребляется в мужском роде. К нему может быть несколько синонимов.
1. Моряк. Старый моряк смотрел вдаль, думая о предстоящем опасном путешествии;
2. Аргонавт. На аргонавте были старые потертые штаны, а его рубашка пропиталась запахом моря и соли;
3. Мореход. Опытный мореход знал, что на этом месте погибло уже много кораблей, ведь под водой скрывались острые скалы;
4. Морской волк. Старый морской волк был рад, ведь ему предстояло отчалить в долгое плавание.
Предмет: Химия,
автор: zdenis07
Ответы
Автор ответа: HUH39I
0
ПР(AgBr) = моль²/л²
V = л
Найти:
Решение:
В насыщенном растворе AgBr устанавливается равновесие: (тв.)
(водн.) +
(водн.)
Из ПР(AgBr) (справочная величина) найдем концентрацию ионов :
ПР = моль²/л²;
моль/л.
Найдем количество вещества ионов :
моль.
Найдем массу ионов в растворе:
г.
Ответ: г.
Предыдущий вопрос
Следующий вопрос
Интересные вопросы
Предмет: Қазақ тiлi,
автор: cheranyov06
Берілген тезисті жалғастыр. Жақсы өмір дегеніміз – бұл ……..
помогите плеез!
5 лет назад
Предмет: География,
автор: nk9897213
добывающая промышленность…
5 лет назад
Предмет: История,
автор: 11laura11
Напишите территорию гуннов, соседние государства и направлення
миграции
5 лет назад
Предмет: Математика,
автор: milaska547
(2хв кубе+х в квадрате-4х+3)/(2х+1)
8 лет назад
Предмет: Биология,
автор: Dimulia1408
в каких местообитаниях следует искать растения занесенные и прижившиеся в средней россии?
8 лет назад