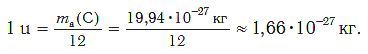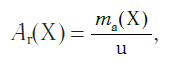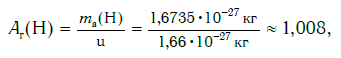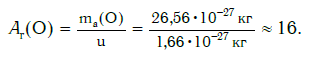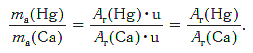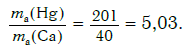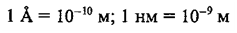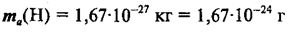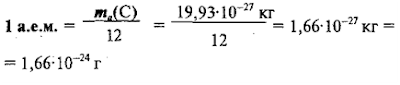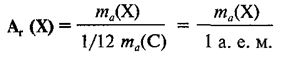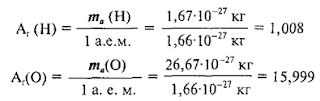В уроке 2 «Относительная атомная масса химических элементов» из курса «Химия для чайников» рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается.
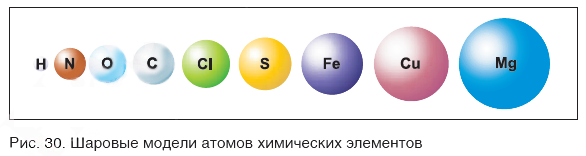
Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.
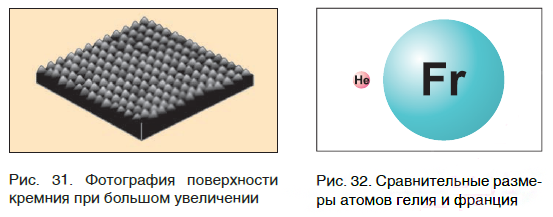
На заметку: В конце XX в. у ученых появились более совершенные микроскопы, позволяющие достигать увеличения в несколько десятков миллионов раз. Они называются туннельными микроскопами. На рисунке 31 показана фотография поверхности кремния. На ней отчетливо видны отдельные атомы, расположенные на поверхности этого вещества.
Размеры и масса атомов
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода. Его масса равна 0,0000000000000000000000000016735 кг. Самым маленьким является атом гелия He. Диаметр этого атома равен приблизительно 0,00000000098 м. Записывать и читать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10−27 кг и 9,8·10−10 м. Атомы большинства химических элементов по своим размерам значительно больше атома гелия. Самый большой из них — атом элемента франция Fr. Его диаметр в 7 раз больше диаметра атома гелия (рис. 32).
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом ma и выражается в единицах массы СИ (кг). Так, например, масса атома углерода равна: ma(С) = 19,94·10−27 кг, а атома кислорода — ma(О) = 26,56·10−27 кг. Масса атома самого тяжелого из существующих на Земле элементов — урана U — почти в 237 раз больше массы атома водорода.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.
В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода (рис. 33). Она получила название атомной единицы массы (а. е. м.). Ее международное обозначение — u (от английского слова «unit» — единица):
Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10−27 кг.
Относительная атомная масса
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента — это физическая величина, которая показывает, во сколько раз масса атома данного химического элемента больше 1/12 части массы атома углерода.
Относительная атомная масса обозначается символами Ar (А — первая буква английского слова «atomic» —атомный, r — первая буква английского слова «relative», что значит относительный), следовательно:
где Х — символ данного элемента.
Например, относительная атомная масса водорода:
а кислорода:
Как видите, относительная атомная масса показывает, во сколько раз масса атома данного элемента больше атомной единицы массы u.
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными до целых значениями этих величин (см. урок 1).
Внимание! Очень часто относительную атомную массу называют просто атомной массой. Однако следует отличать атомную массу — величину относительную (например, Ar(О) = 16) — от массы атома — величины, выражаемой в единицах массы — килограммах (ma(O) = 26,56·10−27 кг) или атомных единицах массы (ma(O) = 16·u).
Пример. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны: Ar(Hg) = 201 и Ar(Ca) = 40.
Масса атома ртути равна: ma(Hg) = Ar(Hg)·u (кг).
Масса атома кальция равна: ma(Са) = Ar(Са)·u (кг).
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс. Следовательно, отношение масс атомов ртути и кальция равно:
Ответ: в 5,03 раза.
Краткие выводы урока:
- Атомная единица массы представляет собой 1/12 часть массы атома углерода.
- Относительная атомная масса химического элемента равна отношению массы его атома к 1/12 части массы атома углерода.
- Относительная атомная масса химического элемента является величиной безразмерной и показывает, во сколько раз масса атома данного элемента больше атомной единицы массы.
Надеюсь урок 2 «Относительная атомная масса химических элементов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,660 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,971 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
2.2. Размеры атомов. Абсолютные и
относительные атомные массы
Атомы
различных элементов имеют разные размеры и разные массы. Так как атомы имеют
форму шара, их размеры характеризуются диаметром
или радиусом.
Для выражения
малых величин часто используются единицы длины, которые называются ангстренами и нанометрами (нм):
Массы
атомов также являются очень малыми величинами. Массы атомов, которые выражены в
обычных единицах массы (кг или г), называются абсолютными атомными массами и обозначаются символом mа.
Самую
маленькую массу имеет атом водорода:
Абсолютные
массы атомов углерода и кислорода имеют следующие значения:
Использовать
такие малые величины очень неудобно. Поэтому в химии вместо абсолютных атомных
масс обычно используются относительные
атомные массы.
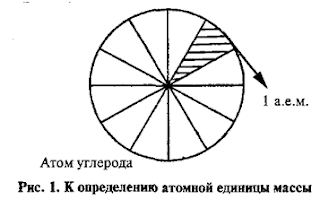
За
единицу атомных масс принимается 1/12 часть абсолютной массы атома углерода С. Если представить атом углерода в виде шарика
и мысленно разделить его на 12 равных частей, то масса одной части и есть атомная единица массы.
Абсолютной
единицей массы (а.е.м.) – это 1/12 часть абсолютной массы атома углерода.
Зная
абсолютную массу атома углерода, можно выразить а.е.м. в кг
или г:
Относительная
атомная масса элемента – это число, которое показывает, во сколько раз
абсолютная масса атома данного элемента больше 1/12 части абсолютной массы
атома углерода, т.е. атомной единицы массы.
Относительная
атомная масса обозначается символом Аr
( индекс «r» — первая буква англ.слова – относительный).
Относительная
атомная масса элемента Х равна:
Рассчитаем,
например, относительные атомные массы водорода и кислорода:
Таким
образом, масса атома водорода приблизительно равна массе 1/12 части атома
углерода, а масса атома кислорода приблизительно в 16 раз больше массы 1/12
части атома углерода.
Обратите
внимание,
что относительные атомные массы элементов, как и любые относительные величины,
являются безразмерными.
Обычно
используют приблизительные значения относительных атомных масс.
УПРАЖНЕНИЯ
1.
Определите
массу одного атома кальция.
Решение: Атомная масса кальция составляет Аr (Са)=40
г/моль. Масса одного атома кальция окажется равной:
m(Ca)= Аr(Ca) :
NA =40 : 6,02·1023 = 6,64·10-23 г.
____________________________________________________________
2.
Определите
массу одной молекулы серной кислоты.
Решение: Молярная масса серной кислоты равна Мr
(H2SO4) = 98. Масса одной молекулы m(H2SO4)
равна:
m(H2SO4) = Мr(H2SO4)
: NA = 98:6,02·1023 = 16,28·10-23 г.
___________________________________________________________
3.
Относительная
молярная масса серной кислоты:
Мr(H2SO4)
= 2Ar(H) + Ar(S) + 4Ar(O) = 2·1
+ 32 + 4·16 = 98.
Решение: Величины абсолютных масс атомов и молекул
находятся делением массы 1 моль вещества на число Авогадро.
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.
Чем
характеризуются размеры атомов.
2.
Какие единицы
длины используются для выражения диаметров или радиусов атомов.
3.
Что называется
абсолютной атомной массой.
4.
Какие атомные
массы обычно используют в химии.
5.
Что принимают
за единицу атомных масс.
6.
Что такое
относительная атомная масса химического элемента. Каким символом она
обозначается.
7.
Диаметр атома
хлора равен 1,8 * 10-8см. Выразите его в ангстремах и нанометрах.
8.
Сколько
ангстремов и нанометров в а) 1 м; б) 1
см.
9.
Рассчитайте,
сколько атомных единиц массы в: а) 1 кг;
б) 1 г.
10.
Используя
относительные атомные массы элементов (см. табл.), рассчитайте, во сколько раз
масса атома меди больше массы а) атома серы;
б) атома кислорода; в) атома
водорода.
|
1. В каких единицах не может выражаться масса атомов и молекул: |
|
|
а) г |
б) а.е.м. |
|
в) кг |
г) моль |
|
2. Чему равна масса атома фтора: |
|
|
а) 19 |
б) 19 а.е.м. |
|
в) 19 г |
г) 19 кг |
|
3. Масса молекулы фосфора при некоторых условиях |
|
|
а) 2 |
б) 4 |
|
в) 3 |
г) 8 |
|
4. В результате протекания любой химической реакции |
|
|
а) число молекул |
б) число атомов |
|
в) нет верного ответа |
г) природа веществ |
|
5. Относительная атомная масса элемента: |
|
|
а) единица измерения – г/моль |
б) равна отношению массы атома к 1 |
|
в) единица измерения — моль |
г) равна отношению массы атома к массе |
|
6. Атом какого |
|
|
а) серы |
б) кислорода |
|
в) азота |
г) неона |
|
7. Масса молекулы О3 равна: |
|
|
а) 16 а.е.м. |
б) 32 а.е.м. |
|
в) 48 |
г) 7,97*10-23 г |
|
8. Что означает запись 4CO2: |
|
|
а) |
б) восемь молекул кислорода |
|
в) |
г) |
|
9. Сколько атомов серы в 5Na2S2O3: |
|
|
а) 15 |
б) 10 |
|
в) 5 |
г) 7 |
|
10. Относительная атомная |
|
|
а) 32 |
б) 16 |
|
в) 32 г/моль |
г) 16 |
Ответы:
|
1 |
г |
|
2 |
б |
|
3 |
а |
|
4 |
б |
|
5 |
б |
|
6 |
б |
|
7 |
г |
|
8 |
а |
|
9 |
б |
|
10 |
а |
Вычислить массу одного атома кальция в граммах.
Найди верный ответ на вопрос ✅ «Вычислить массу одного атома кальция в граммах. …» по предмету 📙 Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
Вес 1 моля Са = 40 г (молярная масса).
В 1 моле вещества содержится 6,022*10^23 структурных единиц, в данном случае — атомов.
Тогда масса одного атома кальция составит 40 / 6,022*10^23 =
6,64452E-23
= 6,6445*10^(-23) г.
(20 оценок)