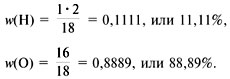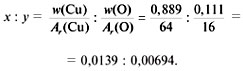найди число атомов каждого элемента в молекуле оксида углерода, если массовая доля углерода в нём равна (42,86) %, а массовая доля кислорода — (57,14) %.
1. Примем массу оксида равной (100) г. Масса углерода в такой порции равна (42,86) г, а масса кислорода — (57,14) г.
2. Находим относительные атомные массы элементов в Периодической таблице:
3. Обозначаем число атомов углерода как (x), а число атомов кислорода — (y), и записываем отношение масс:
.
4. Получаем выражение:
5. Находим отношение (x : y):
.
В молекуле оксида углерода на (1) атом углерода приходится (1) атом кислорода.
О.С.ГАБРИЕЛЯН,
И.Г.ОСТРОУМОВ,
А.К.АХЛЕБИНИН
СТАРТ В ХИМИЮ
7 класс
Продолжение. Начало см. в № 1, 2, 3, 4, 5/2006
Глава 2. Математика в химии
§ 10. Относительная атомная и
молекулярная массы

внимательно посмотрим на таблицу Д.И.Менделеева
и выберем один из элементов. Например, обитатель
шестой «квартиры» – углерод. Что изображено в
этой клетке? Знак (символ) химического элемента и
его название. В верхнем левом углу – порядковый
номер элемента, под символом элемента – его
название. А что означает записанное под
названием число 12,011?
Это число называется относительной атомной
массой элемента, в нашем случае – углерода.
Как вы помните, одно из важнейших свойств
атомов химических элементов – их масса.
Статья опубликована при поддержке группы компаний «Евроинжиниринг». Бензогенераторы, дизельгенераторы, снегоуборщики, блоки автоматического запуска, комплекты для ТО, предпусковые подогреватели, контейнеры для генераторов и другие товары от ведущих мировых производителей. Доставка по всей России, наличный и безналичный расчёт, гарантия качества. Доступна услуга выездного обслуживания бензиновых и дизельных генераторов. Всю подробную информацию Вы найдёте на сайте: http://energyprofessional.ru.
Размерность массы вам хорошо известна: ее
выражают в граммах, килограммах, миллиграммах.
Существуют, конечно, и другие единицы массы:
тонны, например, или центнеры. Однако в
повседневной жизни бывает удобно оперировать не
точной массой предмета, а сравнением ее с
чем-либо. Поскольку массы атомов и молекул
чрезвычайно малы, их сравнивают с массой атома
самого легкого элемента – водорода. Такое
сравнение позволяет утверждать, что масса атома
углерода в 12 раз больше массы атома водорода.
Масса атома кислорода больше массы атома
водорода в 16 раз, а масса атома железа – в 56 раз.
Величина, показывающая, во сколько раз масса
атома данного элемента больше массы атома
водорода, принятой за единицу, называется
относительной атомной массой элемента.
Относительную атомную массу элемента
обозначают символом Аr. Подстрочная
буква r – это первая буква английского слова relative,
что значит относительный. Например: Аr(Н) =
1,
Аr(С) = 12, Аr(N) = 14, Аr(О) = 16, Аr(Fe)
= 56, Аr(Cl) = 35,5.
Обычно относительные атомные массы всех
элементов округляют до целых чисел, кроме хлора
(Аr(Cl) = 35,5), хотя в таблице Д.И.Менделеева
они приведены с большей точностью.
Обратите внимание, что относительная атомная
масса хотя массой и называется, но размерности не
имеет.
Обладают ли массой молекулы веществ? Конечно!
Можете ли вы ответить на вопрос, во сколько раз
молекула воды тяжелее атома водорода? Это очень
просто: надо сложить относительные атомные массы
всех атомов, входящих в состав молекулы (рис. 56):
Mr(H2O) = 2Ar(H) + Ar(O)
= 2•1 + 16 = 18.
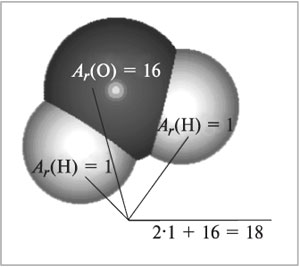 |
Рис. 56.
|
Величина Mr(H2O) – это относительная
молекулярная масса воды. Правильнее было бы
называть ее относительной формульной массой.
Во-первых, не все вещества состоят из молекул (мы
уже приводили в пример железо и графит).
Во-вторых, при расчете этой величины нужно
внимательно смотреть на формулу вещества и не
забывать про индексы, указывающие на число
атомов каждого элемента:
Mr(СH4) = Ar(С) + 4Ar(Н)
= 12 + 4•1 = 16,
Mr(SO2) = Ar(S) + 2Ar(O)
= 32 + 2•16 = 64.
Таблица относительных атомных масс Дж.Дальтона
была далека от совершенства, содержала довольно
много ошибок. Но благодаря ей стало возможным
определять формулы химических веществ по
соотношению масс входящих в их состав элементов.
Как это делалось, мы расскажем на следующем
уроке.
1.
Что такое относительная атомная масса? Почему
эта величина не имеет размерности?2. Что такое относительная молекулярная
масса? Как она рассчитывается?3. В состав молекулы фосфорной кислоты
входят три атома водорода, один атом фосфора и
четыре атома кислорода. Найдите относительную
молекулярную массу этого вещества.4. Рассчитайте относительные молекулярные
массы веществ по их формулам: Br2, H2O, CO2,
H2SO4, KOH, BaCl2. Значения
относительных атомных масс найдите по таблице
Д.И.Менделеева, округлите их до целых чисел (за
исключением хлора,
Ar(Cl) = 35,5).
5.
Атом серы образует с атомами кислорода два
сложных вещества (их называют оксидами) разного
состава. Относительная молекулярная масса
первого оксида равна 64, а второго – 80. Выведите
формулы этих оксидов.6. Не производя расчетов, а только на
основании значений относительных атомных масс
(найдите их по таблице Д.И.Менделеева) определите,
у какого из веществ, формулы которых приведены
ниже, наибольшая и наименьшая относительные
молекулярные массы: а) селеноводорода H2Se; б)
воды Н2О;
в) теллуроводорода H2Te; г) сероводорода H2S.
§11. Массовая доля элемента в сложном
веществе
С XVII в. химия перестала быть описательной
наукой. Ученые-химики стали широко использовать
измерение вещества. Все более
совершенствовалась конструкция весов,
позволяющих определять массы образцов. Для
газообразных веществ помимо массы измеряли
также объем и давление. Применение
количественных измерений дало возможность
понять сущность химических превращений,
определять состав сложных веществ.
Как вы уже знаете, в состав сложного вещества
входят два или более химических элементов.
Очевидно, что масса всего вещества слагается из
масс составляющих его элементов. Значит, на долю
каждого элемента приходится определенная часть
массы вещества.
Массовой долей элемента называется отношение
массы этого элемента в сложном веществе к массе
всего вещества, выраженное в долях единицы (или в
процентах):
Массовая доля элемента в соединении
обозначается латинской строчной буквой w
(«дубль-вэ») и показывает долю (часть массы),
приходящуюся на данный элемент в общей массе
вещества. Эта величина может выражаться в долях
единицы или в процентах. Конечно, массовая доля
элемента в сложном веществе всегда меньше
единицы (или меньше 100%). Ведь часть от целого
всегда меньше целого, как долька апельсина
меньше всего апельсина.
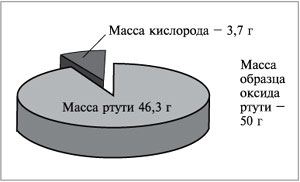
Например, в состав оксида ртути входят два
элемента – ртуть и кислород. При нагревании 50 г
этого вещества получается 46,3 г ртути и 3,7 г
кислорода (рис. 57). Рассчитаем массовую долю ртути
в сложном веществе:
|
|
Рис. 57.
|
Массовую долю кислорода в этом
веществе можно рассчитать двумя способами. По
определению массовая доля кислорода в оксиде
ртути равна отношению массы кислорода к массе
оксида:
Зная, что сумма массовых долей элементов в
веществе равна единице (100%), массовую долю
кислорода можно вычислить по разности:
w(O) = 1 – 0,926 = 0,074,
или
w(О) = 100% – 92,6% = 7,4%.
Для того чтобы найти массовые доли элементов
предложенным способом, необходимо провести
сложный и трудоемкий химический эксперимент по
определению массы каждого элемента. Если же
формула сложного вещества известна, та же задача
решается значительно проще.
Для расчета массовой доли элемента нужно его
относительную атомную массу умножить на число
атомов (n) данного элемента в формуле и
разделить на относительную молекулярную массу
вещества:
Например, для воды (рис. 58):
Mr(H2O) = 1•2 + 16 = 18,
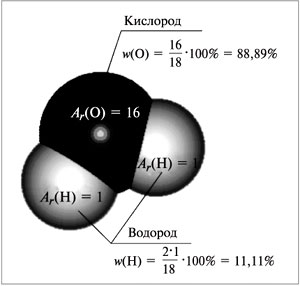 |
Рис. 58.
|
Далее рассмотрим решение задач на
вычисление массовых долей элементов в сложных
веществах.
Задача 1. Рассчитайте массовые доли
элементов в аммиаке, формула которого NH3.
Дано:
вещество аммиак NH3.
Найти:
w(N), w(H).
Решение
1) Рассчитаем относительную молекулярную массу
аммиака:
Mr(NH3) = Ar(N) + 3Ar(H)
= 14 + 3•1 = 17.
2) Найдем массовую долю азота в веществе:
3) Вычислим массовую долю водорода в аммиаке:
w(H) = 1 – w(N) = 1 – 0,8235 = 0,1765, или 17,65%.
Ответ. w(N) = 82,35%, w(H) = 17,65%.
Задача 2. Рассчитайте массовые доли
элементов в серной кислоте, имеющей формулу H2SO4.
Дано:
серная кислота H2SO4.
Найти:
w(H), w(S), w(O).
Решение
1) Рассчитаем относительную молекулярную массу
серной кислоты:
Mr(H2SO4) = 2Ar(H)
+ Ar(S) + 4Ar(O) = 2•1 + 32 + 4•16 = 98.
2) Найдем массовую долю водорода в веществе:
3) Вычислим массовую долю серы в серной кислоте:
4. Рассчитаем массовую долю кислорода в
веществе:
w(O) = 1 – (w(H) + w(S)) = 1 – (0,0204 +
0,3265) = 0,6531, или 65,31%.
Ответ. w(H) = 2,04%, w(S) = 32,65%, w(O) = 65,31%.
Чаще химикам приходится решать обратную
задачу: по массовым долям элементов определять
формулу сложного вещества. То, как решаются
подобные задачи, проиллюстрируем одним
историческим примером.
Из природных минералов – тенорита и куприта –
были выделены два соединения меди с кислородом
(оксиды). Они отличались друг от друга по цвету и
массовым долям элементов. В черном оксиде
массовая доля меди составляла 80%, а массовая доля
кислорода – 20%. В оксиде меди красного цвета
массовые доли элементов составляли
соответственно 88,9% и 11,1%. Каковы же формулы этих
сложных веществ? Проведем несложные
математические расчеты.
Пример 1. Расчет химической формулы черного
оксида меди (w(Cu) = 0,8 и w(О) = 0,2).
1) Обозначим формулу вещества с помощью
индексов х, у – по числу атомов химических
элементов в его составе: СuxOy.
2) Отношение индексов равно отношению частных
от деления массовой доли элемента в соединении
на относительную атомную массу элемента:
3) Полученное соотношение нужно привести к
соотношению целых чисел: индексы в формуле,
показывающие число атомов, не могут быть
дробными. Для этого полученные числа разделим на
меньшее (т.е. любое) из них:
Получилась формула – СuO.
Пример 2. Расчет формулы красного оксида
меди по известным массовым долям w(Cu) = 88,9% и w(O)
= 11,1%.
Дано:
w(Cu) = 88,9%, или 0,889,
w(O) = 11,1%, или 0,111.
Найти:
формулу.
Решение
1) Обозначим формулу оксида СuxOy.
2) Найдем соотношение индексов x и y:
3) Приведем соотношение индексов к отношению
целых чисел:
Ответ. Формула соединения – Cu2O.
А теперь немного усложним задачу.
Задача 3. По данным элементного
анализа состав прокаленной горькой соли,
использовавшейся еще алхимиками в качестве
слабительного средства, следующий: массовая доля
магния – 20,0%, массовая доля серы – 26,7%, массовая
доля кислорода – 53,3%.
Дано:
w(Mg) = 20,0%, или 0,2,
w(S) = 26,7%, или 0,267,
w(O) = 53,3%, или 0,533.
Найти:
формулу.
Решение
1) Обозначим формулу вещества с помощью
индексов x, y, z: MgxSyOz.
2) Найдем соотношение индексов:
3) Определим значение индексов x, y, z:
Ответ. Формула вещества – MgSO4.
1.
Что называется массовой долей элемента в сложном
веществе? Как рассчитывается эта величина?2. Рассчитайте массовые доли элементов в
веществах: а) углекислом газе CO2;
б) сульфиде кальция СаS; в) натриевой селитре NaNO3;
г) оксиде алюминия Al2O3.3. В каком из азотных удобрений массовая
доля питательного элемента азота наибольшая: а)
хлориде аммония NH4Cl; б) сульфате аммония (NH4)2SO4;
в) мочевине (NH2)2CO?
4.
В минерале пирите на 7 г железа приходится 8 г
серы. Вычислите массовые доли каждого элемента в
этом веществе и определите его формулу.5. Массовая доля азота в одном из его оксидов
равна 30,43%, а массовая доля кислорода – 69,57%.
Определите формулу оксида.
6. В средние века из золы костра выделяли
вещество, которое называли поташ и использовали
для варки мыла. Массовые доли элементов в этом
веществе: калий – 56,6%, углерод – 8,7%, кислород –
34,7%. Определите формулу поташа.
Содержание:
- Химические формулы
- Составление химических формул по валентности
- Относительная молекулярная масса
Химическая формула — условное обозначение химического состава и структуры соединений с помощью символов химических элементов, числовых и вспомогательных знаков (скобок, тире и т. п.). Химические формулы являются составной частью языка химии.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Химические формулы
Химическая формула — это условная запись состава вещества с помощью символов химических элементов и индексов. Вы знаете, что символ химического элемента показывает один атом этого элемента, а индекс — число атомов данного химического элемента в молекуле и пишется в формуле после знака химического элемента внизу.
Вспомните, молекулы каких простых веществ состоят из двух атомов. Выучите их формулы: H2, N2, O2, F2, Cl2, Br2, I2.
Химическая формула показывает качественный и количественный состав вещества.
Чтобы указать число свободных атомов химического элемента или число молекул вещества, пользуются коэффициентом, который записывается перед символом химического элемента или перед химической формулой (табл. 13).
Таблица 13
Химические формулы
| Состав молекулы | Химическая формула | Рисунок молекулы | Прочтение формулы |
| Два атома водорода | H2 |  |
«аш-два» |
| Один атом серы и три атома кислорода | SO3 |  |
«эс-о-три» |
| Два атома калия, один атом серы и четыре атома кислорода | K2SO4 |  |
«калий-два-эс-о-четыре» |
| Три молекулы аммиака | 3NH3 |  |
«три-эн-аш-три» |
Химические формулы можно вывести на основе данных о составе веществ. Однако чаще всего при составлении химических формул учитывается валентность элементов.
Валентность — это свойство атомов химического элемента присоединять определенное число атомов другого химического элемента.
За единицу валентности принята валентность атома водорода. Если к одному атому данного элемента присоединяется один атом водорода, то элемент одновалентен, если два — двухвалентен и т. д.
Например: 
Водородные соединения известны не для всех элементов, но практически все элементы образуют соединения с кислородом. Кислород постоянно двухвалентен, поэтому валентность определяют также по кислороду. Например: MgO, СаО, так как кислород двухвалентен и в этих оксидах на один атом элемента приходится по одному атому кислорода, то магний и кальций двухвалентны.
Многие элементы в соединениях проявляют постоянную валентность. Но есть элементы, обладающие переменной валентностью (табл. 14). Сера в химическом соединении SO2 имеет валентность, равную четырем, а в соединении SO3 валентность серы равна шести.
Таблица 14
Валентность некоторых химических элементов
| Валентность | Химические элементы |
| С постоянной валентностью | |
| I | H, Na, K, Li |
| II | O, Be, Mg, Ca, Ba, Zn |
| III | Al, B |
| С переменной валентностью | |
| I и II | Cu |
| II и III | Fe, Co, Ni |
| II и IV | Sn, Pb |
| III и V | P |
| II, III и VI | Cr |
| II, IV и VI | S |
Составление химических формул по валентности
Вещество, состоящее из двух элементов, называется бинарным соединением. Примером бинарных соединении являются оксиды. Чтобы составлять их химическую формулу, необходимо знать валентность элементов, образующих данное химическое соединение (табл. 14). Будем составлять формулы в соответствии с алгоритмом.
1) записываем рядом символы химических элементов:
NaO, AlO, РО
2) ставим над химическими элементами их валентности римскими цифрами:
3) находим наименьшее общее кратное чисел, выражающих валентность обоих элементов:
4) делим его на валентности элементов и находим индексы соответствующего элемента (индекс 1 не пишется):
Na2O, Al2O3, P2O5
Знаешь ли ты?
Самым длинным химическим названием обладает ДНК, выделенная из митохондрии человека. Полное название этого соединения, рассчитанное теоретически, должно содержать около 207 тыс. знаков.
Если у данного элемента валентность переменная» то ее указывают в скобках. Например, FeO — оксид железа (II), Fе2О3 — оксид железа (III). А также, зная формулу вещества, можно определить валентность элементов. Например, в оксиде алюминия Al2O3 валентность кислорода равна двум. Общее число единиц валентностей трех атомов кислорода равно шести (2*3). Следовательно, шесть валентностей кислорода приходятся на два атома алюминия, а на один атом алюминия приходится три единицы валентности (6:2).
Знаешь ли ты?
Если 100 миллионов атомов водорода расположить рядом друг с другом, то они образуют цепочку длиной 1 см.
Относительная молекулярная масса
Масса молекулы, выраженная в атомных единицах массы, называется молекулярной массой данного вещества.
Относительная молекулярная масса (Мr) вещества показывает, во сколько раз масса молекулы больше 1/12 массы атома углерода. Например, молекула водорода в два раза тяжелее, чем атомная единица массы (рис. 28).
Рис. 28. Молекула водорода в два раза тяжелее, чем атомная единица массы
По химической формуле вещества можно вычислить его относительную молекулярную массу, исходя из величин относительных атомных масс элементов вещества. Относительная молекулярная масса является безразмерной величиной, потому что атомные массы элементов, входящих в состав молекулы, также безразмерные величины. Относительная молекулярная масса обозначается символом (Мr).
Относительная молекулярная масса вещества вычисляется следующим образом: относительная атомная масса каждого элемента умножается на число его атомов в составе молекулы и полученные величины суммируются (см. табл. 15).
Теперь можно выяснить, что показывает химическая формула. Рассмотрим это на примере воды и сульфида магния (см. табл. 16).
Пользуясь химическими формулами, производят различные расчеты. Рассмотрим, как по химическим формулам вычисляется отношение масс атомов элементов в сложном веществе.
• Задача. Вычислите массовое соотношение элементов в карбонате магния (MgCO3).
Решение. Зная относительные атомные массы элементов и число атомов, входящих в состав химического соединения, можно определить массовое соотношение этих элементов;
w(Mg) : w(C): w(O)= 24 : 12 : 48 = 2 : 1: 4:
2 + 1 + 4 = 7.
Это означает, что на 7 мас. ч. карбоната магния приходится 2 мас. ч, магния, 1 мас. ч. углерода и 4 мас. ч. кислорода. Массовые части можно измерить любыми единицами (г, кг, т). 7 г карбоната магния содержат 2 г магния, 1 г углерода и 4 г кислорода.качестве чистящего средства. В виде медицинского раствора оно служит для обработки ран.
Таблица 15
Относительные молекулярные массы
| N2 |  |
Mr(N2) = 2 • 14 = 28 |
| SO3 |  |
Mr(SO3) = 32 + 3 • 16 = 80 |
| H2SO4 |  |
Mr(H2SO4) = 1 • 2 + 32 +4 • 16 = 98 |
| Fe(NO3)2 |  |
Mr(Fe(NO3)2) = 56 + 2 • (14+3 • 16) = 180 |
Таблица 16
| 1 | Химическая формула вещества | H2O | MgS |
| 2 | Название вещества | Вода | Сульфид магния |
| 3 | Одна молекула данного вещества | Одна молекула воды | Одна молекула сульфида магния |
| 4 | Качественный состав (из каких химических элементов состоит данное вещество) | В состав воды входят химические элементы водород Н и кислород О | В состав сульфида магния входят химические элементы магний Мg и сера S |
| 5 | Количественный состав | Молекула воды образована двумя атомами водорода Н и одним атомом кислорода О | В состав сульфида магния входят один атом магния и один атом серы |
| 6 | Массовые отношения элементов в этом веществе | m(H) : m(O) = 2:16 = 1 : 8 | m(Mg) : m(S) = 24 : 32 = 3 : 4 |
| 7 | Относительная молекулярная масса | Mr(H2O) = 2 • 1+16 = 18 | Mr(MgS) = 24 + 32 = 56 |
Знаешь ли ты?
Молекулярная формула перекиси водорода H2O2. Это вещество часто используют для осветления волос и в качестве чистящего средства. В виде медицинского раствора оно служит для обработки ран.
Самое важное
Химическая формула — это условное обозначение состава вещества с помощью символов химических элементов и индексов. Химическая формула показывает количественный и качественный состав вещества. Индекс показывает количество атомов элемента в химической формуле. Коэффициент показывает количество атомов или молекул. Вещество, состоящее из двух элементов, называется бинарным соединением. Валентность — это свойство атомов одного химического элемента присоединять определенное число атомов другого химического элемента. Валентность бывает постоянной и переменной.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Воздух
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
Развитие химии показало, что наряду с соединениями постоянного состава существуют соединения переменного состава. По предложению Н.С. Курнакова первые названы дальтонидами (в память английского химика и физика Дальтона), вторые — бертоллидами (в память французского химика Бертолле, предвидевшего такие соединения). Состав дальтонидов выражается простыми формулами с целочисленными стехиометрическими индексами, например, Н2О, НCl, ССl4, СO2. Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям.
В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение.
Cостав соединений молекулярной структуры, т.е. состоящих из молекул, — является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
Расчёты на основе закона постоянства состава
Задача №1. В каких массовых отношениях соединяются химические элементы в серной кислоте, химическая формула которой H2SO4?
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(H)=1, Ar(S)=32, Ar(O)=16.
Определим массовые отношения этих элементов в формуле H2SO4
m(H) : m(S) : m(O) = 2Ar(H) : Ar(S) : 4Ar(O) = 2 : 32 : 64 = 1 : 16 : 32
Таким образом, чтобы получить 49 г серной кислоты (1+16+32=49), необходимо взять 1 г — Н, 16 г — S и 32 г — О.
Задача №2. Водород соединяется с серой в массовых отношениях 1 : 16. Используя данные об относительных атомных массах этих элементов, выведите химическую формулу сероводорода.
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(H)=1, Ar(S)=32.
Обозначим количество атомов водорода в формуле — х, а серы — у: НхSу
m(H) : m(S) = хAr(H) : уAr(S)= х1 : у32 = (2*1) : (1*32) = 2 : 32 = 1 : 16
Следовательно, формула сероводорода Н2S
Задача №3. Выведите формулу сульфата меди, если массовые отношения в нём меди, серы и кислорода соответственно равны 2:1:2?
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(Cu)=64, Ar(S)=32, Ar(O)=16.
Обозначим количество атомов меди в формуле — х, серы — у, а кислорода — z: CuxSyOz
m(Cu) : m(S) : m(O) = хAr(Cu) : уAr(S) : zAr(O) = x64 : y32 : z16 = (1*64) : (1*32) : (4*16) = 64:32:64 = 2:1:2
РЕШИТЕ ЗАДАЧИ
№1. Применяя сведения об относительных атомных массах химических элементов, вычислите массовые отношения элементов в угольной кислоте, химическая формула которой H2CO3.
№2. Определите массу кислорода, реагирующего без остатка с 3 г водорода, если водород и кислород в данном случае соединяются соответственно в соотношении 1 : 8?
№3. Углерод и кислород в углекислом газе соединяются в массовых отношениях 3 : 8.
Выведите химическую формулу углекислого газа
№4. Определите массу водорода, реагирующего без остатка с 48 г кислорода, если водород и кислород в данном случае соединяются в соотношении 1:8.
Алгоритм определения массовых соотношений
элементов в соединении
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
Определить массовые соотношения |
|
2.Запишите |
Fe2O3
|
|
3.Найдите |
3.Решение: Mr(Fe2O3) = 2Ar(Fe) + |
|
4.Вычислите |
4. |
|
5.Запишите |
Ответ: В |
Алгоритм определения молекулярной формулы
вещества по массовым соотношениям элементов
|
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ |
ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
|
1.Прочитайте текст задачи. |
Химическое соединение содержит по |
|
2.Запишите |
2.Дано:
NaxCryOz= ? |
|
3.Запишите |
3.Решение: Ar(Na) = 23 Ar(Cr) = 52 Ar(O) = 16 |
|
4.Составьте |
4. x : y : z= 0,763 |
|
5. |
x : y : z= 2·1 : |
|
6.Запишите |
Ответ: Простейшая |
Нахождение молекулярной массы вещества.
1.
Найти молярную массу сульфата алюминия. Указать относительную молекулярную
массу вещества.
Дано:
АІ2(SО4)3
Найти:
М[АІ2(SО4)3] -? Мr[АІ2(SО4)3] -?
Решение:
М[АІ2(SО4)3]
= А(АІ) · n(АІ) + А(S) · n(S) + А(О) · n(О)
М[АІ2(SО4)3]
= 27 · 2 + (32 + 16 · 4) · 2 = 54 + 96 · 3 =
=
54 + 288 = 342 г/моль
Мr[АІ2(SО4)3]
= Аr(АІ) · n(АІ) + Аr(S) · n(S) + Аr(О) · n(О)
Мr[АІ2(SО4)3]
= 27 · 2 + (32 + 16 · 4) · 2 = 54 + 96 · 3 =
=
54 + 288 = 342 .
Ответ:
М[АІ2(SО4)3] = 342 г/моль; Мr[АІ2(SО4)3] = 342.