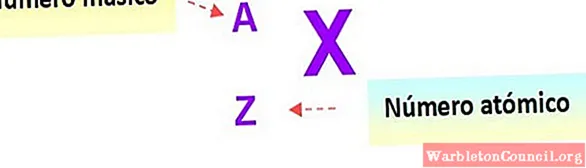Согласно протонно-нейтронной модели строения атомного ядра, заряд ядра должен быть равен сумме зарядов всех протонов, которые входят в его состав. Так как заряд протона равен элементарному заряду, то можно считать, что:
(q) — заряд ядра,
(e) — элементарный заряд,
()
Z
() — количество протонов в ядре.
Количество протонов в ядре
Z
называется зарядовым числом атомного ядра.
Экспериментально было доказано, что число Z совпадает с порядковым номером химического элемента в Периодической системе Менделеева.
Обрати внимание!
Количество протонов в ядре атома совпадает с номером химического элемента в Периодической системе химических элементов и называется зарядовым числом (
Z
).
Массовое число
Количество нейтронов в ядре атома принято обозначать N. Тогда количество протонов и нейтронов в ядре атома можно вычислить как:
A=Z+N.
— количество нуклонов в атоме называется массовым числом.
Изотопы
Химические свойства атома определяются зарядовым числом, так как это число указывает на номер атома в периодической системе, т. е. определяет, какой именно это химический элемент. Физические свойства атома могут быть разными в зависимости от массового числа. Действительно, экспериментально было доказано, что ядра одного и того же химического элемента могут обладать разными массами. Например, в природе существует несколько видов атомов водорода: водород, дейтерий и тритий. Масса дейтерия приблизительно в два, а трития — в три раза больше массы водорода.
Атомы одного и того же химического элемента, но с разными массами, называются изотопами.
Так как изотопы — это атомы одного и того же химического элемента, то зарядовое число у изотопов одинаковое, а массовые числа различные. Это означает, что ядра изотопов содержат одинаковое число протонов и разное количество нейтронов.
Изотопы принято обозначать:
XZA, где
XZA — химический элемент,
A — массовое число,
Z — зарядовое число.
Пример:
— водород,
H12
— дейтерий,
H13
— тритий.
If you have a given mass of a compound, you can calculate the number of moles. Conversely, if you know how many moles of the compound you have, you can calculate its mass. For either calculation, you need to know two things: the chemical formula of the compound and the mass numbers of the elements that comprise it. An element’s mass number is unique to that element, and it’s listed right underneath the element’s symbol in the periodic table. The mass number of an element is not the same as its atomic number.
TL;DR (Too Long; Didn’t Read)
The atomic mass number of each element appears under its symbol in the periodic table. It’s listed in atomic mass units, which is equivalent to grams/mole.
Atomic Number and Atomic Mass Number
Every element is characterized by a unique number of positively charged protons in its nucleus. For example, hydrogen has one proton, and oxygen has eight. The periodic table is an arrangement of the elements according to increasing atomic number. The first entry is hydrogen, the eighth is oxygen and so on. The place an element occupies in the periodic table is an immediate indication of its atomic number, or the number of protons in its nucleus.
Besides protons, the nuclei of most elements also contains neutrons. These fundamental particles don’t have a charge, but they have roughly the same mass as protons, so they must be included in the atomic mass. The atomic mass number is the sum of all protons and neutrons in the nucleus. The hydrogen atom may contain a neutron, but it usually doesn’t, so the mass number of hydrogen is 1. Oxygen, on the other hand, has an equal number of proteins and neutrons, which raises its mass number to 16. Subtracting an element’s mass number from its atomic mass tells you the number of protons in its nucleus.
Finding the Mass Number
The best place to look for an element’s atomic mass number is in the periodic table. It’s displayed under the symbol for the element. You might be mystified by the fact that in many versions of the periodic table, this number contains a decimal fraction, which you wouldn’t expect if it was derived simply by adding protons and neutrons.
The reason for this is that the number displayed is the relative atomic weight, which is derived from all the naturally occurring isotopes of the element weighted by the percentage of each that occurs. Isotopes are formed when the number of neutrons in an element is more or less than the number of protons. Some of these isotopes, such as carbon-13, are stable, but some are unstable and decay over time to a more stable state. Such isotopes, such as carbon-14, are radioactive.
Virtually all elements have more than one isotope, so each has an atomic mass that contains a decimal fraction. For example, the atomic mass of hydrogen listed in the periodic table is 1.008, that for carbon is 12.011 and that for oxygen is 15.99. Uranium, with an atomic number of 92, has three naturally occurring isotopes. Its atomic mass is 238.029. In practice, scientists usually round mass number to the nearest integer.
Units for Mass
The units for atomic mass have been refined over the years, and today scientists use the unified atomic mass unit (amu, or simply u). It is defined to be equal to exactly one-twelfth the mass of an unbound carbon-12 atom. By definition, the mass of one mole of an element, or Avogadro’s number (6.02 x 1023) of atoms, is equal to its atomic mass in grams. In other words, 1 amu = 1 gram/mole. So if the mass of one hydrogen atom is 1 amu, the mass of one mole of hydrogen is 1 gram. The mass of one mole of carbon is therefore 12 grams, and that of uranium is 238 grams.
Физика 9 класс
Тема: Строение атома и атомного ядра. Использование энергии атомных ядер
Урок 56. Состав атомного ядра. Массовое число. Зарядовое
число. Ядерные силы
Ерюткин Евгений Сергеевич
учитель физики высшей категории ГОУ СОШ №1360
Москва
2011
Здравствуйте! Сегодняшний урок будет посвящен вопросу, связанному с обсуждением строения ядра атома, зарядовому числу, массовому числу, поговорим также о том, что такое ядерные силы. Наш урок – это подведение некоторого промежуточного итога по всем ранее изученным вопросам. Мне бы хотелось сказать то, что мы изучали вопросы, связанные со строением атома и строением ядра. Поэтому сегодня мы поговорим именно об этом. Некоторый итог предыдущим темам, предыдущим вопросам. Прежде чем мы перейдем к тому вопросу, который обозначен первым, мы поговорим вот о чем. На предыдущем уроке мы говорили, что Резерфорд в своих экспериментах установил, что существует такая частица, как протон. Через некоторое время в 1932 году Чедвик установил, что существует еще одна частица, которая называется нейтрон. После этого открытия независимо друг от друга два человека, русский ученый Иваненко и немецкий ученый Гейзенберг, предложили протонно-нейтронную модель строения ядра атома. По этой теории Иваненко – Гейзенберга, ядро любого атома содержит протоны и нейтроны. Эти протоны и нейтроны вместе, те, которые находятся в ядре атома, было решено называть нуклонами. Таким образом, «нуклон» (от лат. «ядро») – общее название для протонов и нейтронов. Те частицы, которые имеют заряд, и те частицы, которые заряд не имеют, нейтроны, эти все частицы вместе называются нуклонами. Давайте еще вот о чем поговорим. Идея о заряде ядра была впервые выдвинута в 1913 году английским ученым Генри Мозли. Он предложил, что, раз атом электронейтрален, порядковый номер элемента, умноженный на элементарный электрический заряд, это и есть заряд ядра. Каким образом Мозли пришел к такому заключению? Дело в том, что количество электронов в атоме соответствует порядковому номеру. Значит, заряд всех электронов – это произведение порядкового номера на заряд одного электрона. Поскольку в ядре сосредоточен положительный заряд, значит, то же самое можно говорить и о ядре. Давайте посмотрим на то, как пришел Мозли именно к тому, что мы называем зарядовым числом. Посмотрите:
qЯ = Z. |e|
qЯ – заряд ядра
е – заряд электрона
Z – число протонов в ядре, зарядовое число
Заряд числа, по такому утверждению, определяется как произведение порядкового номера на элементарный электрический заряд. В данном случае е – это заряд электрона, элементарный электрический заряд его называют, и взят он по модулю, потому что понятно, что заряд ядра у нас положительный. В этом случае порядковый номер стали называть зарядовым числом, порядковый номер – это число, соответствующее числу протонов в ядре. Таким образом, мы, говоря о порядковом номере, можем говорить о количестве протонов в ядре. Следующее число, о котором необходимо сказать, – это число массы. Оно, это число, обозначено буквой А, и это самое число берут то же из таблицы Менделеева и округляют его до целых. Дальше мы можем говорить о том уравнении, которое называется во всем мире уравнением Иваненко – Гейзенберга. Это уравнение состоит из трех чисел: массового числа, зарядового числа и числа нейтронов. Давайте посмотрим, как оно записывается и как обозначаются данные величины.
Уравнение Иваненко — Гейзенберга
А = Z + N
А – массовое число,
Z – порядковый номер элемента,
N – число нейтронов в ядре
Посмотрите: массовое число А говорит о том, какое количество нуклонов входит в ядро. Оказалось, что, по таблице Менделеева определяя массовое число химического элемента, мы определяем число нуклонов в ядре атома.
Z, как мы говорили, будет порядковый номер и число протонов в ядре. N в данном случае – это число нейтронов. Таким образом, мы можем из этого уравнения определить число нейтронов, число протонов, зная массовое число и порядковый номер. Здесь необходимо отметить важный момент. Дело в том, что в 1913 году еще один ученый Содди (вы помните, что этот человек работал вместе с Резерфордом) установил интересную вещь. Выяснено было, что существуют химические элементы с абсолютно одинаковыми химическими свойствами, но разным массовым числом. Такие элементы, у которых одинаковые химические свойства, но разное массовое число, стали называть изотопами. Изотопы – это химические элементы с одинаковыми химическими свойствами, но с различной массой атомных ядер.
Еще надо добавить, что у изотопов разная радиоактивность. Все это вместе привело к изучению этого вопроса. Здесь показаны изотопы легких и тяжелых элементов химических. Давайте посмотрим. Мы выбрали специально разные области таблицы Менделеева, чтобы показать, что практически все элементы химические имеют изотопы.
Изотопы:



U

У водорода этих изотопов три. Первый изотоп 

Следующий вопрос, который мы должны затронуть, вытекает из сказанного. Как эти частицы, эти нуклоны удерживаются внутри ядра? Мы назвали различные химические элементы, изотопы различные, особенно у тяжелых элементов, там, где нуклонов, т.е. протонов и нейтронов, много. Как, каким образом они удерживаются внутри ядра? Мы знаем, что в маленьком ядре расстояния, размеры ядра очень и очень малы, бывает собрано большое количество частиц нуклонов. Как эти нуклоны там так плотно, тесно удерживаются, какими силами? Ведь за счет электростатического отталкивания эти частицы должны очень быстро распадаться, разлетаться. Мы знаем, что разноименные только заряды притягиваются, частицы, заряженные разноименными зарядами. Если частицы заряжены одноименно, понятно, что они должны отталкиваться. Внутри ядра находятся протоны. Они положительно заряжены. Размер ядра очень мал. В этом же ядре находятся еще и нейтроны, значит, должны быть силы, которые удерживают вместе те и другие частицы. Эти самые силы называют ядерными силами. Ядерные силы – это силы притяжения, действующие между нуклонами. Можно сказать, что у этих сил существуют свои особые свойства.
Первое свойство, о котором мы должны сказать, – это то, что ядерные силы должны превосходить силы электростатического отталкивания. И это так, когда удалось их определить, то выяснилось, что они в 100 раз превосходят силы электростатического отталкивания. Еще одно очень важное замечание, что действуют ядерные силы на малом расстоянии. Например, 10-15м – это и есть диаметр ядра, эти силы действуют. Но стоит только увеличиться размеру ядра до 10-14, казалось, совсем немного, то это приводит к тому, что ядро обязательно распадется. На этом расстоянии уже ядерные силы не действуют. А силы электростатического отталкивания продолжают действовать и именно они отвечают за то, что ядро распадается.
Еще можно сказать о ядерных силах то, что они не центральны, т.е. они не действуют вдоль прямой, соединяющей эти частицы. И то, что ядерные силы не зависят от того, обладает частица зарядом или не обладает, потому что в ядро входят и протоны, и нейтроны. Вместе эти частицы находятся. Таким образом, вывод: эти частицы, нуклоны, удерживаются в ядре за счет ядерных сил, и эти силы действуют только в ядре. Еще можно отметить, что ядерные силы имеют важное значение в плане стабильности ядра. Отвечают за долговременность существования этого элемента. В заключение мы можем отметить еще одно: когда мы будем говорить об энергетике, вот здесь именно ядерные силы будут играть основную роль. Об этом мы поговорим на следующих уроках. До свидания.
Задание к уроку.
1. Определите нуклонный состав ядер железа 
2. В ядре атома химического элемента 22 протона и 26 нейтронов. Назовите этот химический элемент.
3. Оцените силу гравитационного взаимодействия между двумя нейтронами в ядре. Масса нейтрона примерно равна 1,7*10-27 кг, расстояние между нейтронами примите равным 10-15 м, значение гравитационной постоянной 6,67*10-11 (Н*м2)/кг2.
Содержание
- Примеры массовых чисел
- Водород
- Кислород
- Углерод
- Уран
- Как получить массовое число?
- Обозначения для атомов
- Изотопы
- Изотопы углерода
- Таблица природных изотопов углерода
- Примеры работы
- — Пример 1
- Ответить
- — Пример 2
- Ответить
- Ссылки
В массовое число Массовое число атома — это сумма количества протонов и количества нейтронов в ядре. Эти частицы взаимозаменяемо обозначаются именем нуклоны, поэтому массовое число представляет их количество.
Пусть N — количество присутствующих нейтронов, а Z — количество протонов, если мы назовем A массовым числом, тогда:
А = N + Z
Примеры массовых чисел
Вот несколько примеров массовых чисел для хорошо известных элементов:
Водород
Самый стабильный и многочисленный атом водорода также самый простой: 1 протон и один электрон. Поскольку ядро водорода не имеет нейтронов, верно, что A = Z = 1.
Кислород
В ядре кислорода 8 нейтронов и 8 протонов, поэтому A = 16.
Углерод
Жизнь на Земле основана на химии углерода, легкого атома с 6 протонами в ядре плюс 6 нейтронов, поэтому A = 6 + 6 = 12.
Уран
Этот элемент, намного тяжелее предыдущих, хорошо известен своими радиоактивными свойствами. В ядре урана 92 протона и 146 нейтронов. Тогда его массовое число A = 92 + 146 = 238.
Как получить массовое число?
Как упоминалось ранее, массовое число A элемента всегда соответствует сумме числа протонов и числа нейтронов, содержащихся в его ядре. Это тоже целое число, но … есть ли какое-нибудь правило относительно соотношения между двумя величинами?
Посмотрим: все перечисленные элементы легкие, кроме урана. Атом водорода, как мы уже сказали, самый простой. В нем нет нейтронов, по крайней мере, в его наиболее распространенной версии, а в кислороде и углероде есть равное количество протонов и нейтронов.
То же самое происходит и с другими легкими элементами, такими как азот, еще один очень важный для жизни газ, который имеет 7 протонов и 7 нейтронов. Однако по мере того, как ядро становится более сложным, а атомы становятся тяжелее, количество нейтронов увеличивается с другой скоростью.
В отличие от легких элементов, уран с 92 протонами имеет примерно в 1 ½ раза больше нейтронов: 1 ½ x 92 = 1,5 x 92 = 138.
Как видите, это довольно близко к 146 — количеству нейтронов, которое он имеет.
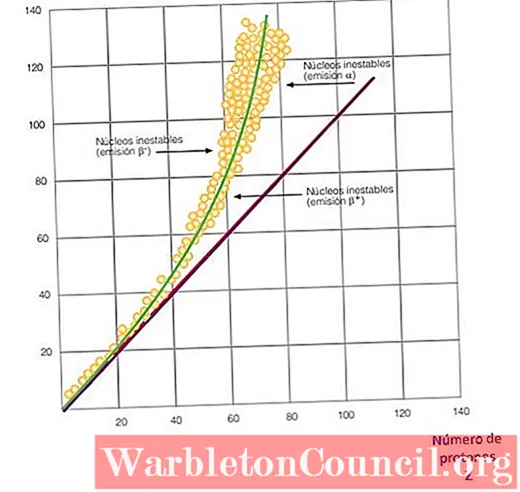
Все это становится очевидным на кривой на рисунке 2. Это график зависимости N от Z, известный каккривая ядерной устойчивости. Там вы можете увидеть, как легкие атомы имеют такое же количество протонов, что и нейтроны, и как с Z = 20 количество нейтронов увеличивается.
Таким образом, большой атом становится более стабильным, так как избыток нейтронов уменьшает электростатическое отталкивание между протонами.
Обозначения для атомов
Очень полезная запись, которая быстро описывает тип атома, следующая: символ элемента и соответствующие атомные и массовые числа записываются, как показано ниже на этой диаграмме:
В этих обозначениях атомы в предыдущих примерах будут:
Иногда используются другие более удобные обозначения, в которых для обозначения атома используются только символ элемента и массовое число, без атомного номера. Таким образом, 12 6C просто записывается как углерод-12, 16 8Или кислород — 16 и так далее для любого элемента.
Изотопы
Число протонов в ядре определяет природу элемента. Например, каждый атом, ядро которого содержит 29 протонов, является атомом меди, несмотря ни на что.
Предположим, атом меди по какой-то причине теряет электрон, это все равно медь. Однако теперь это ионизированный атом.
Атомному ядру сложнее получить или потерять протон, но в природе это может происходить. Например, внутри звезд более тяжелые элементы непрерывно образуются из легких элементов, поскольку звездное ядро ведет себя как термоядерный реактор.
И прямо здесь, на Земле, есть феномен радиоактивный распад, в котором некоторые нестабильные атомы изгоняют нуклоны и излучают энергию, превращаясь в другие элементы.
Наконец, существует вероятность того, что атом определенного элемента имеет другое массовое число, в данном случае это изотоп.
Хороший пример — всем известный углерод-14 или радиоуглерод, который используется для датировки археологических объектов и как биохимический индикатор. Это тот же углерод с идентичными химическими свойствами, но с двумя дополнительными нейтронами.
Углерод-14 менее распространен, чем углерод-12, стабильный изотоп, а также радиоактивен. Это означает, что со временем он распадается, выделяя энергию и частицы, пока не станет стабильным элементом, которым в его случае является азот.
Изотопы углерода
Углерод существует в природе как смесь нескольких изотопов, наиболее распространенными из которых являются уже упомянутые 126С или углерод-12. А кроме углерода-14 есть 136C с дополнительным нейтроном.
Это обычное явление в природе, например, известно 10 стабильных изотопов олова. С другой стороны, из бериллия и натрия известен только один изотоп.
Каждый изотоп, природный или искусственный, имеет разную скорость превращения. Таким же образом можно создавать искусственные изотопы в лаборатории, которые, как правило, нестабильны и радиоактивно распадаются за очень короткий период долей секунды, в то время как для других требуется гораздо больше времени, равное возрасту Земли или больше.
Таблица природных изотопов углерода
| Изотопы углерода | Атомный номер Z | Массовое число A | Изобилие% |
|---|---|---|---|
| 12 6 C | 6 | 12 | 98.89 |
| 13 6 C | 6 | 13 | 1.11 |
| 14 6 C | 6 | 14 | Следы |
Примеры работы
— Пример 1
В чем разница между137 N и 147 N?
Ответить
Оба являются атомами азота, так как их атомный номер равен 7. Однако один из изотопов с A = 13 имеет на один нейтрон меньше, а 147 N — самый распространенный изотоп.
— Пример 2
Сколько нейтронов находится в ядре атома ртути, обозначаемого как 20180 Hg?
Ответить
Поскольку A = 201 и Z = 80, а также зная, что:
А = Z + N
N = А — Я = 201 — 80 = 121
И делается вывод, что в атоме ртути 121 нейтрон.
Ссылки
- Коннор, Н. Что такое нуклон — Структура атомного ядра — Определение. Получено с: period-table.org.
- Найт, р. 2017. Физика для ученых и инженерии: стратегический подход. Пирсон.
- Сирс, Земанский. 2016. Университетская физика с современной физикой. 14-го. Ред. Том 2.
- Типпенс, П. 2011. Физика: концепции и приложения. 7-е издание. Макгроу Хилл.
- Википедия. Массовое число. Получено с: en.wikipedia.org.
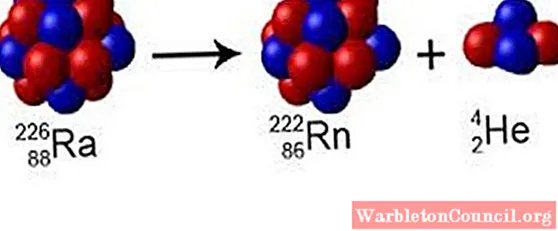
Практически сразу после
открытия нейтрона советским физиком Дмитрием Иваненко и немецким учёным
Вернером Гейзенбергом была предложена протонно-нейтронная модель атомного ядра.
Согласно ей, ядра всех химических элементов (за исключением водорода) состоят
из двух видов частиц: протонов и нейтронов. Протоны и нейтроны называют
нуклонами (от латинского «нуклеус» — ядро), а ядра атомов — нуклидами.
Общее число нуклонов в ядре
называют массовым числом и обозначают
буквой А. Оно ставится вверху перед буквенным обозначением химического
элемента.
Например, массовое число
кислорода равно 16, а углерода — 12.
Мы уже говорили о том, что массовое
число принято выражать в атомных единицах массы (сокращённо, а. е. м.) и
округлять до целых чисел. Напомним также, что атомную единицу массы
выражают через массу атома углерода; она равна 1/12 части массы атома углерода:
Число протонов в ядре
соответствует порядковому или атомному номеру элемента в таблице Менделеева и
называется зарядовым числом,
поскольку оно определяет заряд ядра. Обозначается зарядовое число буквой Z.
В наших примерах, зарядовое
число кислорода равно восьми, а углерода — 6.
Как видно из приведённых
примеров, зарядовое число ставится внизу перед буквенным обозначением элемента.
Напомним, что заряд протона положителен
и равен элементарному электрическому заряду. Следовательно, зарядовое число
численно равно заряду ядра, выраженному в элементарных электрических зарядах.
Так как атом в целом
электрически нейтрален, то зарядовое число определяет одновременно и число
электронов в атоме.
Число нейтронов в ядре обозначают большой буквой N. Нетрудно
догадаться, что оно равно разнице между массовым и зарядовым числом:
Таким образом, ядро любого
атома обозначается буквенным символом элемента. Вверху указывается значение его
массового числа, а внизу — зарядового.
В общем случае любой
химический элемент периодической таблицы Дмитрия Ивановича Менделеева можно
представить в виде:
где под X
подразумевается символ химического элемента.
Ещё раз уточним, каким образом
определяется число протонов, электронов и нейтронов в ядре атома любого
химического элемента. Во-первых, необходимо посмотреть в таблице Менделеева
порядковый номер интересующего нас химического элемента. Таким образом мы
найдём зарядовое число, то есть количество протонов и электронов в ядре. Затем,
всё в той же таблице, необходимо посмотреть атомную массу этого элемента и
округлить её до целых. Тем самым мы найдём массовое число, то есть общее
количество нуклонов в ядре. И наконец, чтобы определить количество нейтронов в
ядре атома, мы должны будем вычесть из массового числа зарядовое.
На основе новой,
протонно-нейтронной модели строения атомных ядер, было дано объяснение многим
экспериментальным фактам. Так, например, ещё в 1906—1907 годах учёными было
выявлено, что продукт радиоактивного распада урана — ионий и продукт
радиоактивного распада тория — радиоторий имеют те же химические свойства, что
и торий, но отличаются от него атомной массой и характеристиками радиоактивного
распада. При этом атомы обладали одинаковыми химическими свойствами, а отделить
их друг от друга было невозможно никакими химическими методами. Впервые, на
существование таких атомов обратил внимание Фредерик Содди в 1910 году. Он
предложил называть такие разновидности атомов одного и того же химического
элемента изотопами (что по-гречески означает «равноместные»), так как по
своим химическим свойствам они должны быть помещены в одну и ту же клетку
таблицы Менделеева.
На основании многих
экспериментов, было установлено, что изотопы одинаково вступают в химические
реакции и образуют одинаковые соединения. Это говорило о том, что число
электронов в электронных оболочках, а, значит, и заряд ядра у изотопов
одинаковы. Следовательно, ядра изотопов различаются только числом нейтронов.
Иными словами, химические свойства элементов определяются не атомной массой, а
зарядовым числом ядра. Действительно, например, нуклиды водорода-три и гелия-три
имеют близкие по величине атомные массы, но принципиально разные химические
свойства.
Из всех известных на
сегодняшний день изотопов (а они есть у всех химических элементов) только изотопы
водорода имеют названия:
Протий является самым
распространённым изотопом в природе, а его ядро содержит только один протон.
Изотоп дейтерия (его ещё называют тяжёлой водой), содержит в своём ядре один
протон и один нейтрон. Соответственно, у трития — один протон и два нейтрона. В
настоящее время в лабораториях получены изотопы водорода и с большим числом
нейтронов: тремя, четырьмя, пятью и даже шестью.
Следует отметить, что у разных
атомов существует разное количество изотопов. Например, у урана их 26, но
самыми распространёнными в природе являются два — это уран-235 (около 0,7 %), и
уран-238 (чуть более 99 %). Вы, наверное, обратили внимание на то, что мы не
называли зарядового числа изотопов урана. Дело в том, что обычно изотопы
называют по их массовым числам, так как зарядовые числа у них одинаковые.
Отметим, что изотопы бывают
устойчивые (или стабильные) и неустойчивые (то есть радиоактивные). Стабильные
изотопы сохраняются сколь угодно долго.
А нестабильные изотопы со
временем превращаются в другие химические элементы в результате радиоактивных
превращений.
В настоящее время известно
около 280 стабильных изотопов химических элементов и более 2 тыс. радиоактивных
изотопов.
Как правило, природные
элементы представляют собой смесь нескольких изотопов, поэтому возникает
задача их разделения. Как мы уже знаем, магнитное поле искривляет траекторию
движения заряженных частиц. На этом свойстве магнитного поля основано действие
устройства, называемого масс-спектрографом, который используется для
разделения изотопов по массовому числу.
Закрепления материала.
В заключении отметим, что предложенная
Иваненко и Гейзенбергом протонно-нейтронная модель строения ядра впоследствии
полностью была подтверждена экспериментально. Однако оставался нерешённым ещё
один вопрос: почему ядра атомов не распадаются на отдельные нуклоны?
Действительно, ведь мы знаем, что ядра атомов являются весьма устойчивыми
образованиями, хотя в их состав входят одинаково заряженные частицы — протоны.
А поскольку размеры ядер очень малы, то между протонами должны существовать
огромные силы электрического отталкивания — порядка 230 ньютонов, что для
частиц с массой порядка 10–27 степени килограмм является очень
большой силой. Поэтому возникает вопрос: какое взаимодействие препятствует
взаимному отталкиванию между одноимённо заряженными частицами?
Мы знаем, что, кроме
электромагнитных сил, в природе существуют также гравитационные силы. Может
быть, стабилизирующую роль в ядрах играет именно гравитационное взаимодействие
между нуклонами?
Нет, так как расчёты
показывают, что сила гравитационного притяжения между двумя протонами в ядре
пренебрежимо мала по сравнению с силой электростатического отталкивания. Этот
результат позволяет сделать вывод о том, что между ядерными частицами,
по-видимому, действуют силы особой природы, радикально отличающиеся от
гравитационных и электромагнитных сил. Эти силы принято называть ядерными
силами. А так как ядерное взаимодействие во много раз превосходит
электромагнитное, то его ещё называют сильным взаимодействием.
Другой особенностью ядерных
сил является то, что они очень быстро убывают с увеличением расстояния между
ядерными частицами. Проще говоря, они действуют на расстояниях, сравнимыми с
размерами самих ядер.