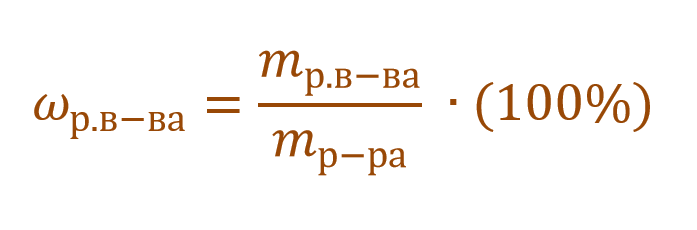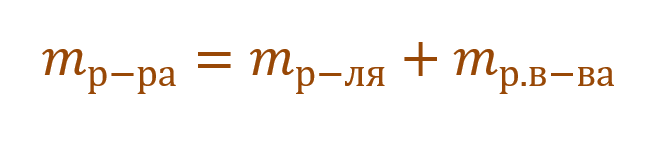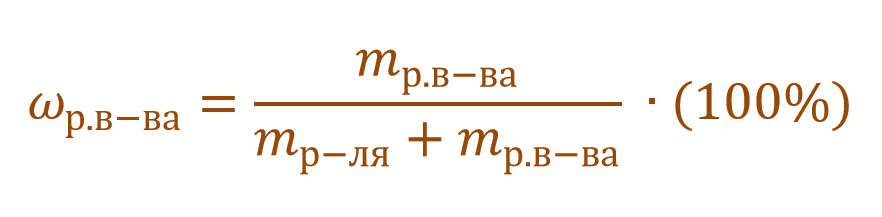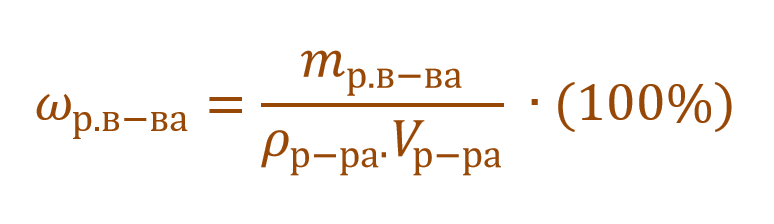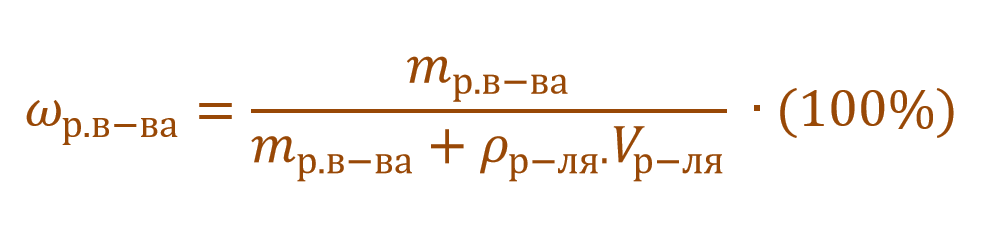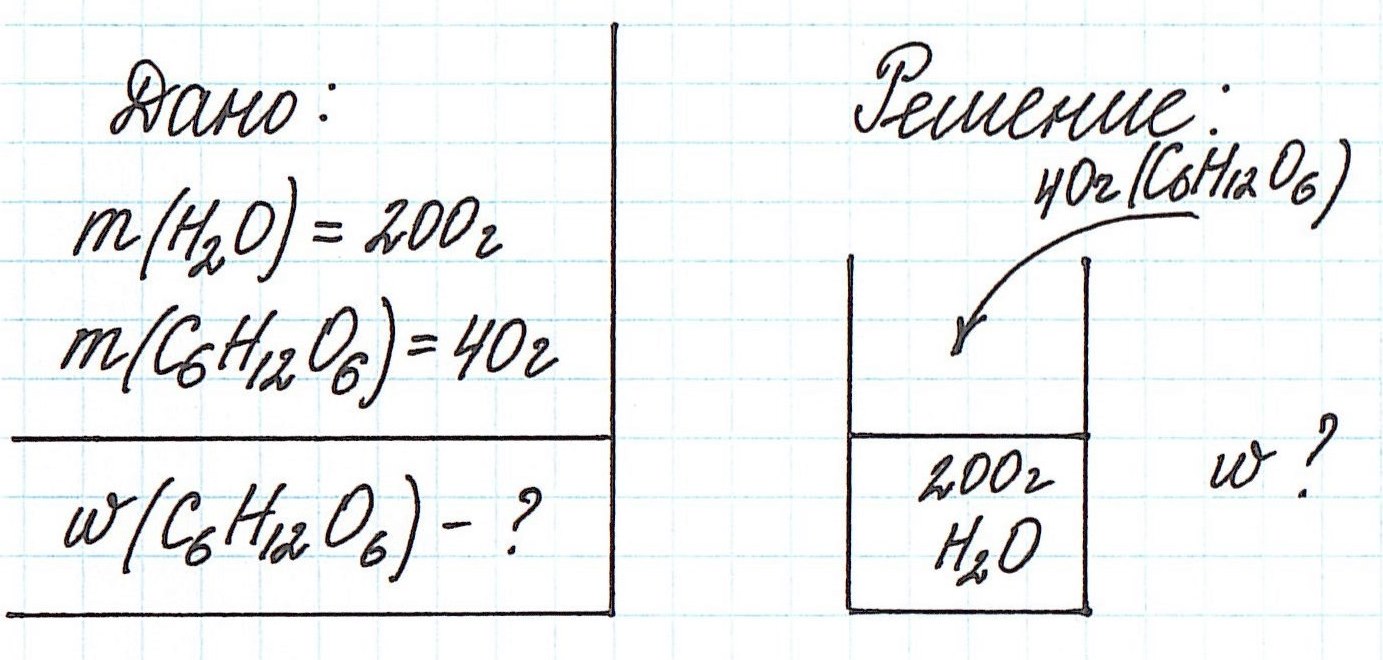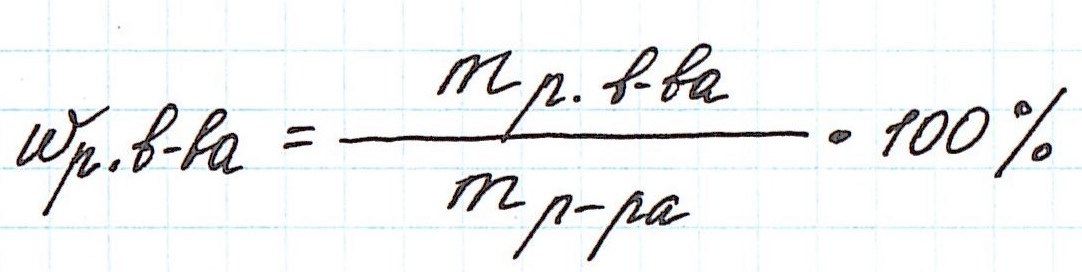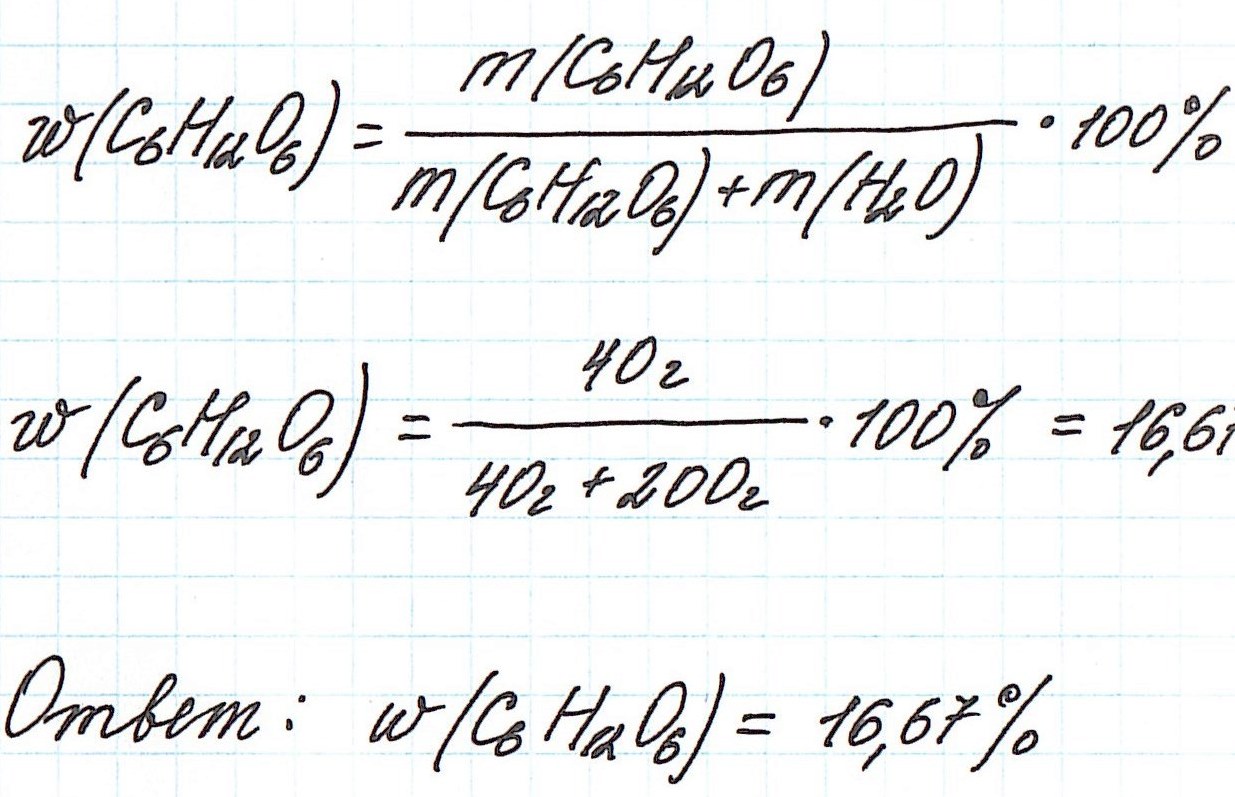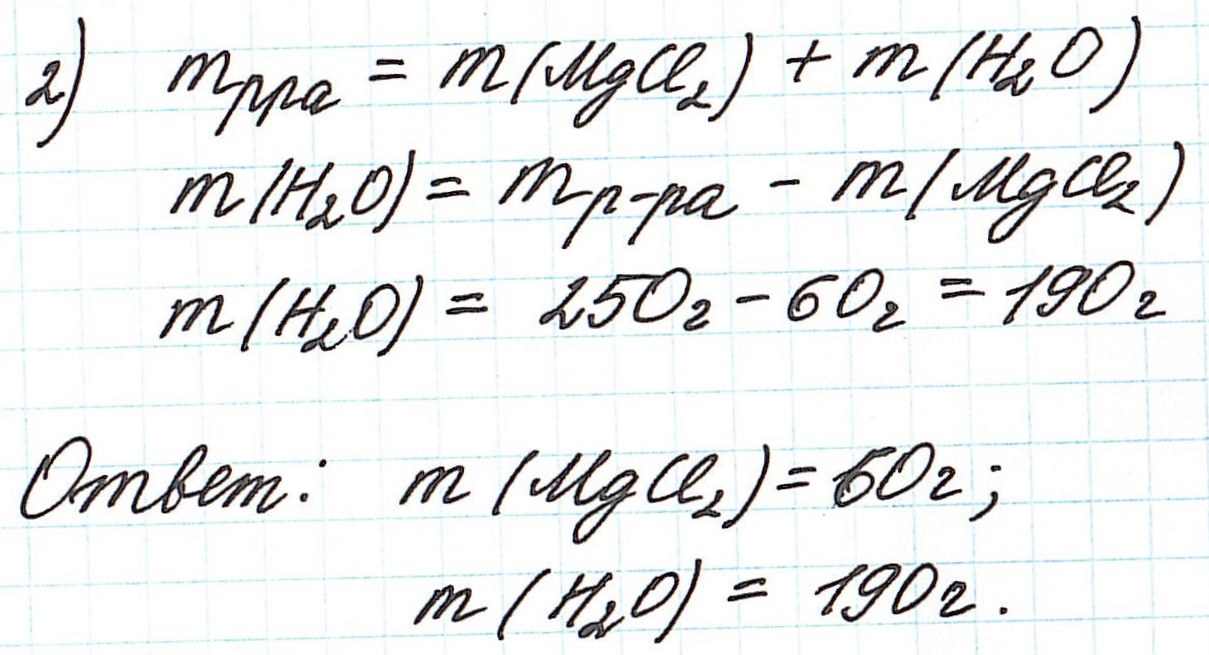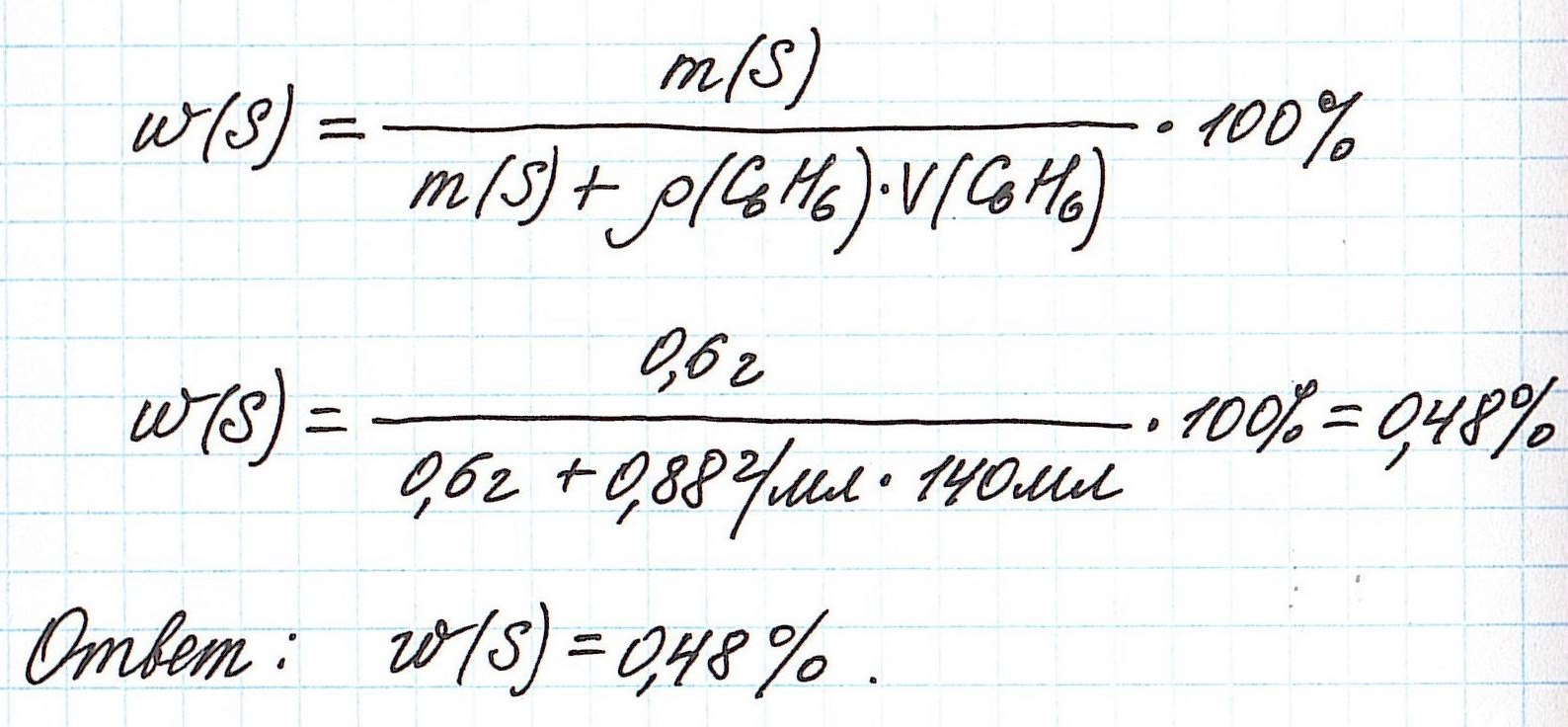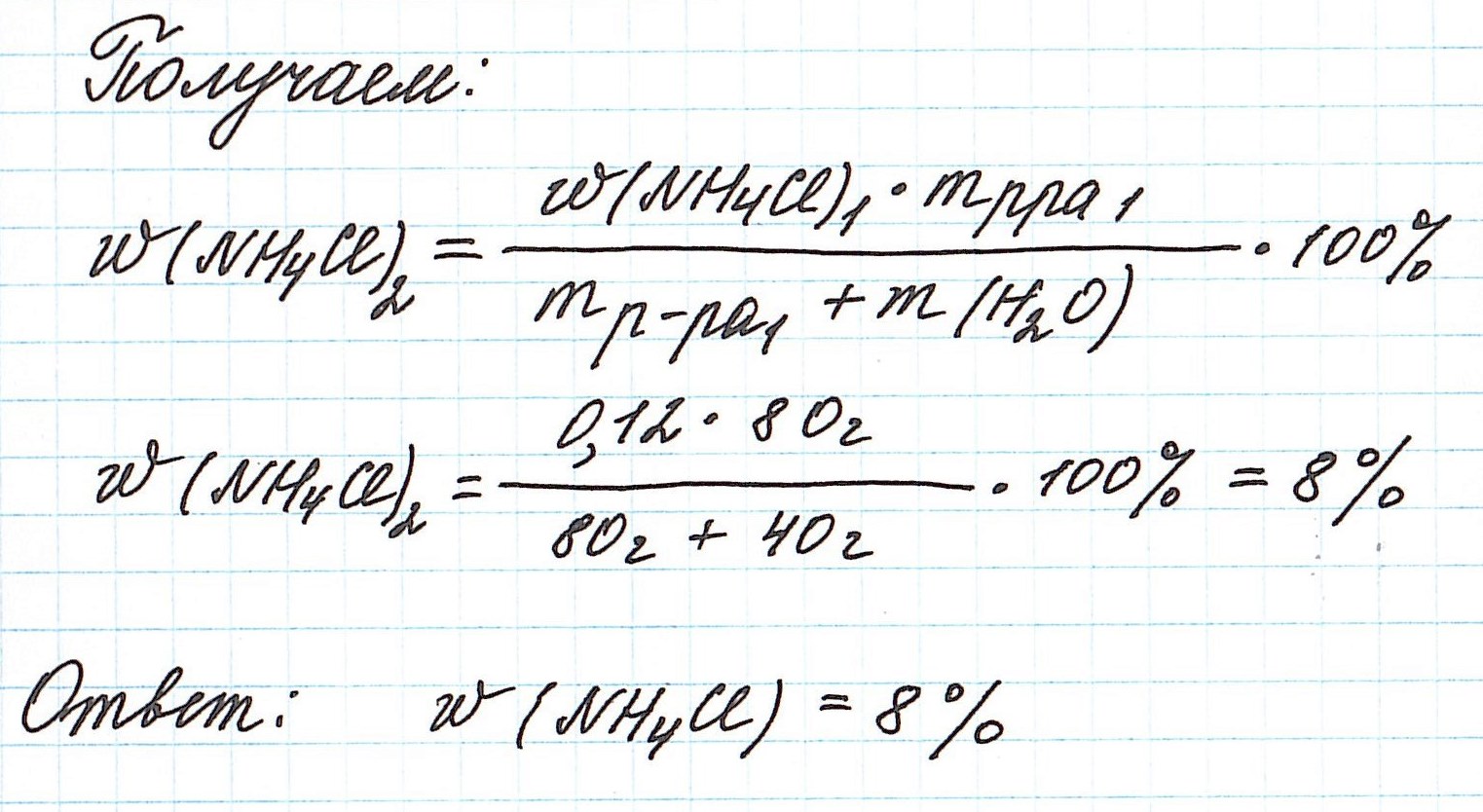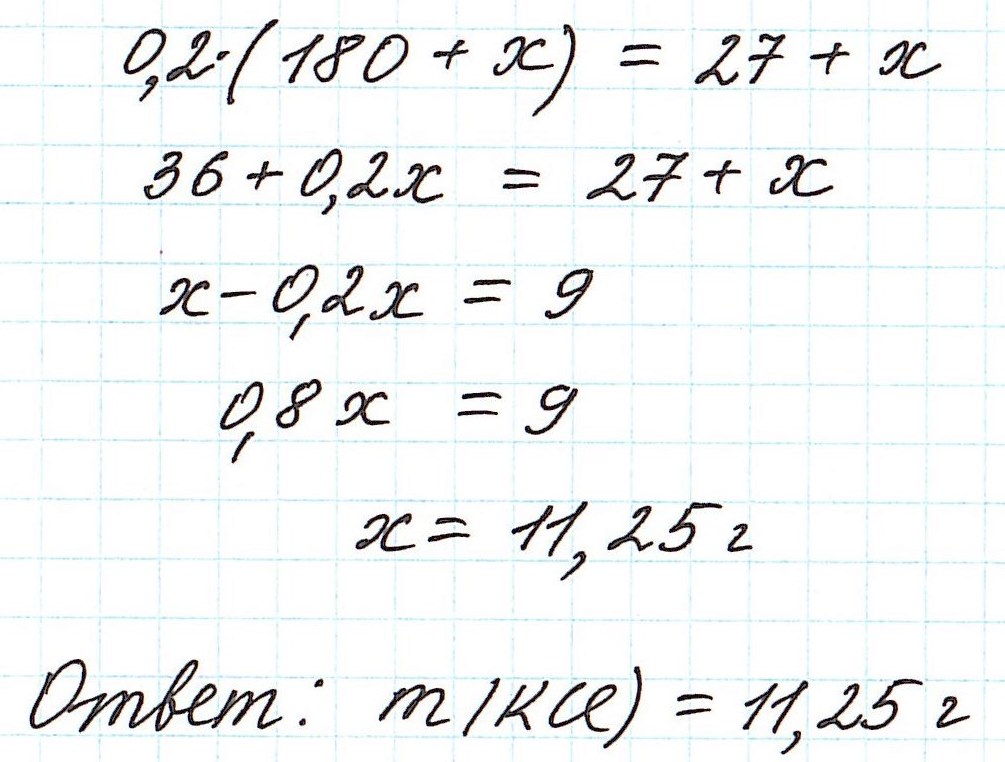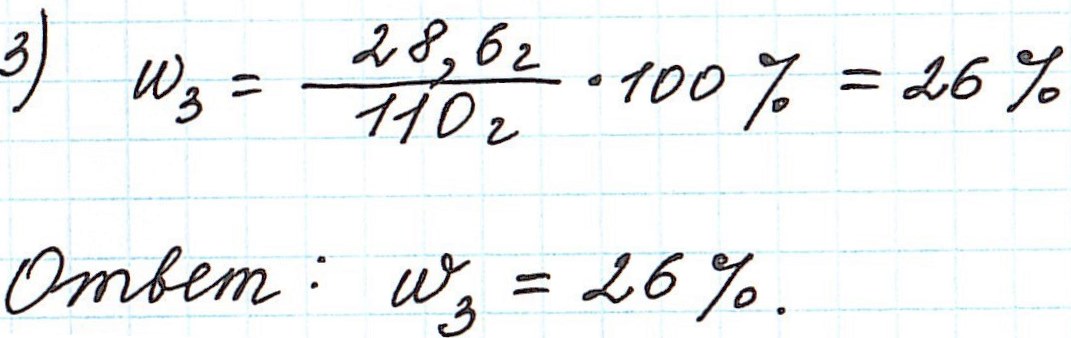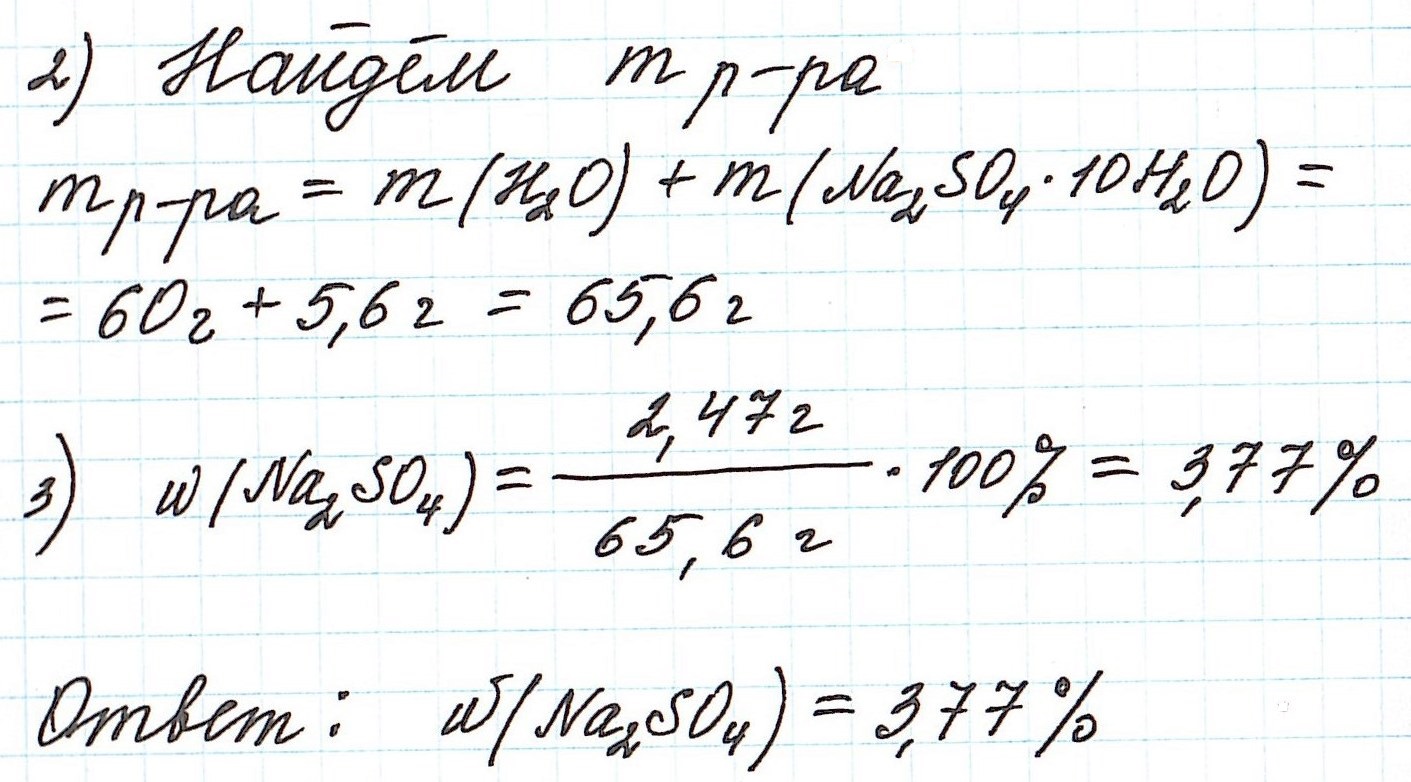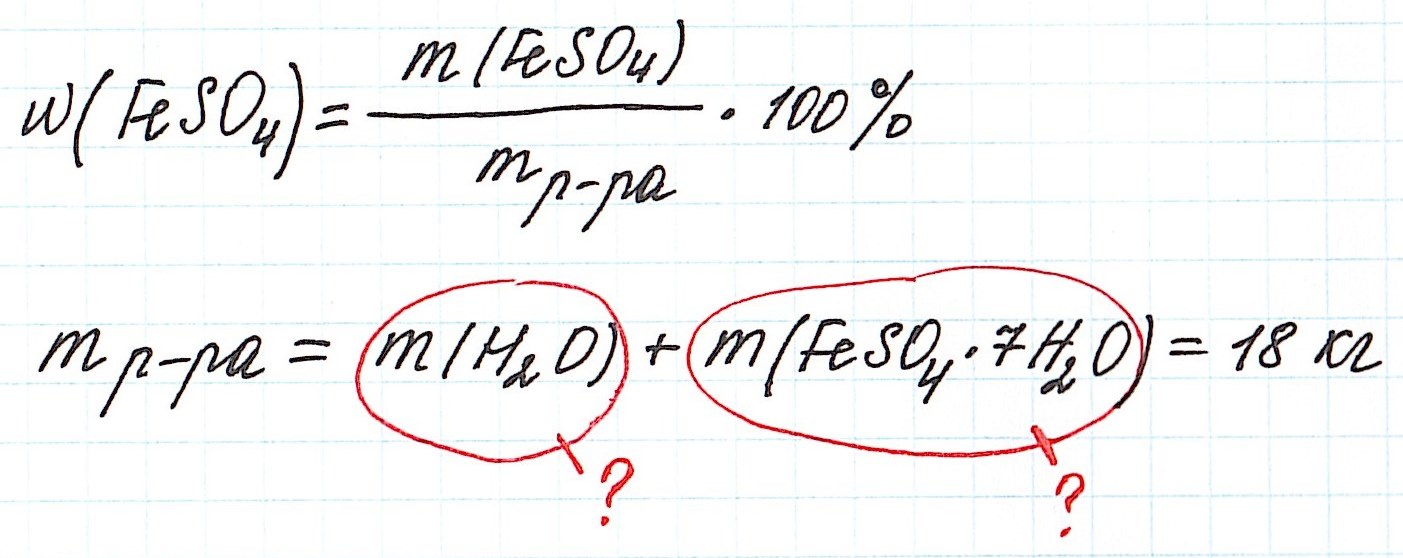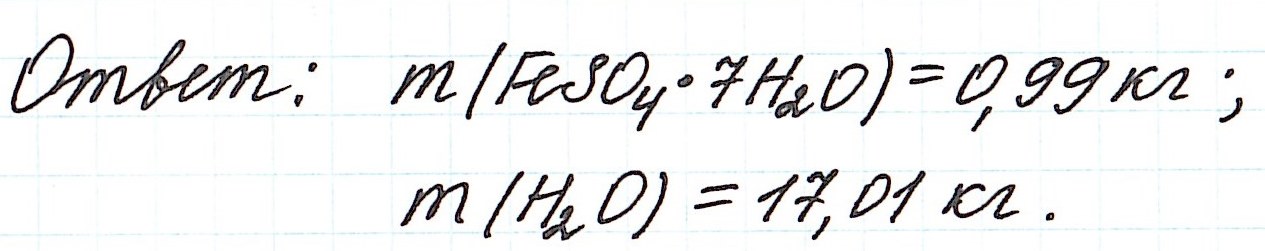Загрузить PDF
Загрузить PDF
В химии концентрация раствора показывает, как много растворенного вещества содержится в растворителе. Согласно стандартной формуле C = m/V, где C — концентрация, m — масса растворенного вещества и V — общий объем раствора. При малых концентрациях удобнее вычислять концентрацию в миллионных долях (ppm). Во время лабораторной работы вас могут попросить также вычислить молярность, или молярную концентрацию раствора.
-
1
Найдите массу растворенного вещества. Это вещество добавляют в растворитель, чтобы получить раствор. Если в условии дана масса растворенного вещества, запишите ее и укажите соответствующие единицы измерения. Если эту массу необходимо найти, взвесьте то вещество, которое вы собираетесь растворить, на лабораторных весах и запишите результат измерений.[1]
- Если растворенное вещество имеет жидкую форму, можно вычислить массу с помощью формулы для плотности D = m/V, где m — масса жидкости и V — ее объем. Чтобы найти массу, умножьте плотность жидкости на объем.
Совет: если необходимо использовать весы, вычтите из общей массы массу емкости, в которой находится взвешиваемая жидкость, чтобы получить правильный результат.
-
2
Запишите общий объем раствора. Этот объем равен сумме объема растворителя и растворенного вещества. Если необходимо измерить объем в лаборатории, приготовьте раствор в мерной пробирке или мензурке и определите объем. Чтобы получить более точный результат, определите объем по верхнему краю поверхности раствора (мениска). Запишите найденную величину.[2]
- Если вы не измеряете объем раствора самостоятельно, возможно, потребуется вычислить его по массе и плотности.
- Например, если следует найти концентрацию 3,45 грамма соли, растворенной в 2 литрах воды, можно определить объем по формуле для плотности. Найдите плотность соли в справочнике или интернете и решите уравнение относительно массы m. В данном случае плотность соли составляет 2,16 г/мл (грамма на миллилитр). Получаем 2,16 г/мл = (3,45 г)/V. Умножим обе части равенства на V и получим V(2,16 г/мл) = 3,45 г. После этого поделим каждую часть на 2,16 и найдем объем: V = (3,45 г)/(2,16 г/мл) = 1,60 мл.
- Прибавьте к объему растворенного вещества объем растворителя. В нашем примере имеем 2 л + 1,6 мл = 2000 мл + 1,6 мл = 2001,6 мл. Можно оставить найденный объем в миллилитрах или перевести его в литры: 2,002 л.
-
3
Поделите массу растворенного вещества на общий объем раствора. Запишите уравнение C = m/V, где m — масса растворенного вещества и V — общий объем раствора. Подставьте величины массы и объема и выполните деление, чтобы определить концентрацию раствора. Не забудьте записать в ответе правильные единицы измерения.[3]
- В нашем примере для концентрации 3,45 грамма соли в 2 литрах воды имеем C = (3,45 г)/(2,002 л) = 1,723 г/л.
- В некоторых задачах требуется найти концентрацию в определенных величинах. Не забудьте перевести значения в соответствующие единицы измерения, прежде чем подставлять их в конечную формулу.
Реклама
-
1
Найдите массу растворенного вещества в граммах. Измерьте массу того вещества, которое вы собираетесь добавить в раствор. Не забудьте вычесть массу емкости, если вы используете ее при взвешивании, чтобы получить правильный результат.[4]
- Если растворяемое вещество находится в жидкой форме, можно вычислить его массу с помощью формулы D = m/V, где D — плотность жидкости, m — ее масса и V — объем. Найдите плотность жидкости в справочнике или интернете и решите уравнение относительно массы.
-
2
Определите общую массу раствора в граммах. Общая масса равна сумме масс растворенного вещества и растворителя. Измерьте эти массы с помощью лабораторных весов или переведите объем растворителя в массу с помощью формулы для плотности D = m/V. Сложите массы растворенного вещества и растворителя, чтобы найти общую массу.[5]
- Например, если вы хотите найти концентрацию 10 граммов порошка какао в 1,2 литра воды, определите массу воды по формуле для плотности. Плотность воды составляет 1000 г/л, поэтому получаем 1000 г/л = m/(1,2 л). Умножим обе стороны равенства на 1,2 литра и найдем массу в граммах: m = 1,2 л×1000 г/л = 1200 г. Прибавим массу порошка какао и получим 1210 г.
-
3
Поделите массу растворенного вещества на общую массу раствора. Определим концентрацию как C = масса растворенного вещества/общая масса раствора. Подставьте в это уравнение значения, чтобы найти концентрацию раствора.[6]
- В нашем примере C = (10 г)/(1210 г) = 0,00826.
-
4
Умножьте ответ на 100, если хотите найти концентрацию в процентах. Если требуется определить концентрацию в процентах, умножьте найденный ответ на 100. Запишите полученный результат со знаком процентов.[7]
- В нашем примере концентрация в процентах составляет 0,00826×100 = 0,826 %.
-
5
Умножьте концентрацию на 1000000, чтобы найти миллионные доли. Возьмите найденное значение концентрации и умножьте его на 1000000, или 106. В результате вы найдете, сколько миллионных долей растворенного вещества содержится в растворе. Укажите в ответе единицы измерения в ppm.[8]
- В нашем примере количество миллионных долей ppm = 0,00826×1000000 = 8260 ppm.
Совет: миллионные доли обычно используют для очень малых концентраций, когда легче записать и понять ответ в них, а не в процентах.
Реклама
-
1
Сложите атомные массы растворенного вещества, чтобы найти молярную массу. Посмотрите, из каких химических элементов состоит данное растворенное вещество. Выпишите атомную массу каждого элемента, поскольку атомная и молярная массы равны. Сложите все атомные массы элементов растворенного вещества, чтобы найти общую молярную массу. Укажите в полученном результате, что это г/моль (количество граммов на моль).[9]
- Например, если в качестве растворенного вещества дан гидроксид калия, найдите атомные массы калия, кислорода и водорода и сложите их. В результате получится молярная масса = 39 +16 + 1 = 56 г/моль.
- Молярность используется в химии в основном тогда, когда известен химический состав растворенного вещества.
-
2
Поделите массу растворенного вещества на его молярную массу, чтобы определить количество молей. При необходимости измерьте массу растворенного вещества с помощью лабораторных весов. Не забудьте вычесть массу емкости, чтобы получить правильный результат. Поделите найденную массу на молярную массу, в результате вы узнаете количество молей. Укажите возле ответа «моль».[10]
- К примеру, если вы хотите найти, сколько молей содержится в 25 граммах гидроксида калия (KOH), уравнение будет выглядеть следующим образом: число молей = (25 г)/(56 г/моль) = 0,45 моль.
- Переведите массу растворенного вещества в граммы, если она указана в других единицах измерения.
- Моли показывают количество молекул в растворе.
-
3
Переведите объем раствора в литры. Определите объем растворителя, прежде чем приготовить раствор. Если объем не дан в условии задачи, используйте мерную пробирку или мензурку. Если вы получите результат в миллилитрах, поделите его на 1000, чтобы перевести в литры.[11]
- В рассматриваемом примере если вы используете 400 миллилитров воды, поделите эту величину на 1000, и у вас получится 0,4 литра.
- Если объем растворителя уже указан в литрах, данный шаг можно пропустить.
Совет: обычно нет необходимости учитывать объем растворенного вещества, так как он, как правило, не сильно влияет на общий объем. Однако если объем заметно изменится после того, как вы добавите растворимое вещество, используйте общий объем раствора.
-
4
Поделите количество молей растворенного вещества на объем раствора в литрах. Запишите молярность следующим образом: M = mol/V, где mol — количество молей растворенного вещества и V — объем растворителя. Найдите ответ и поставьте возле него букву «M».[12]
- В нашем примере M = (0,45 моль)/(0,4 л) = 1,125 M.
Реклама
Советы
- Если вы находитесь в лаборатории и не знаете, сколько растворенного вещества было добавлено, можно титровать раствор другими реактивами. При этом необходимо знать, как записывать химические уравнения в стехиометрическом виде.
Реклама
Об этой статье
Эту страницу просматривали 228 073 раза.
Была ли эта статья полезной?
Формула концентрации раствора. Их множество. И каждая соответствует тому или иному способу выражения концентрации. А в химии их применяются достаточно: массовая доля растворенного вещества, молярная, нормальная, моляльная, титр и др.
Зачем так много? Ответ на этот вопрос очень прост. Каждый вид концентрации удобен в том или ином случае, когда применение другого вида концентрации неуместно.
Например, при исследовании содержания массы вещества в очень небольшом объеме раствора удобно пользоваться титром. А в каких-то технологиях вообще концентрация заменяется другими количественными характеристиками раствора. Так, в технологии посола рыбы для расчета необходимой концентрации тузлука (раствора поваренной соли) используют не его процентную концентрацию, а плотность.
Содержание:
1. Концентрация – что это такое
2. Формула концентрации раствора: основные виды
3. Массовая доля растворенного вещества и примеры ее вычисления
- разбавление раствора водой
- концентрирование раствора путем упаривания
- концентрирование раствора путем добавления растворенного вещества
- смешивание двух растворов
- применение кристаллогидратов для приготовления раствора (задачи на кристаллогидраты)
4. Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Концентрация – что это такое
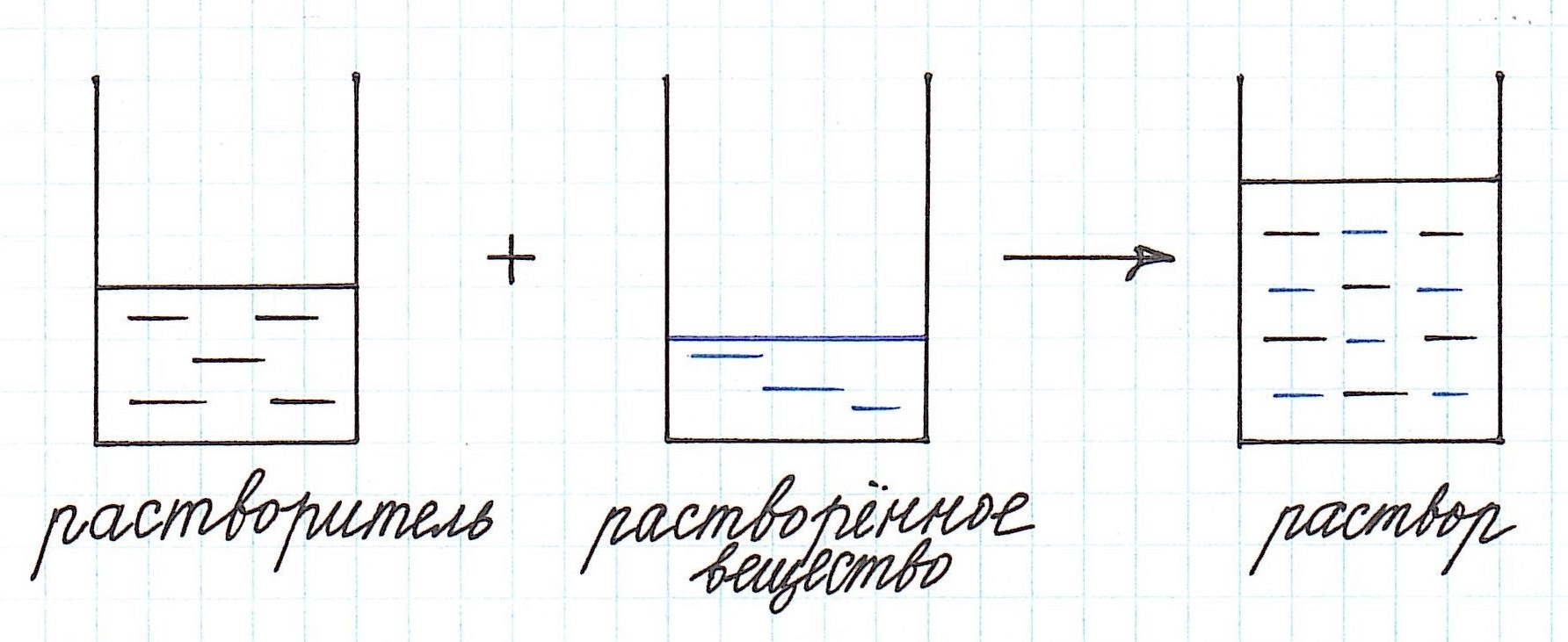
Любой раствор имеет различные характеристики: качественные и количественные. Одной из важнейших количественных характеристик является концентрация раствора.
Концентрация раствора – это количество растворенного вещества, содержащееся в определенном количестве раствора.
Как видно из приведенного определения, основными компонентами раствора являются:
— растворитель;
— растворенное вещество.
Растворенного вещества в растворе всегда меньше, а растворителя больше.
И вот именно с вычислением количественного содержания растворенного вещества чаще всего и связаны все расчеты, основанные на применении формулы концентрации раствора.
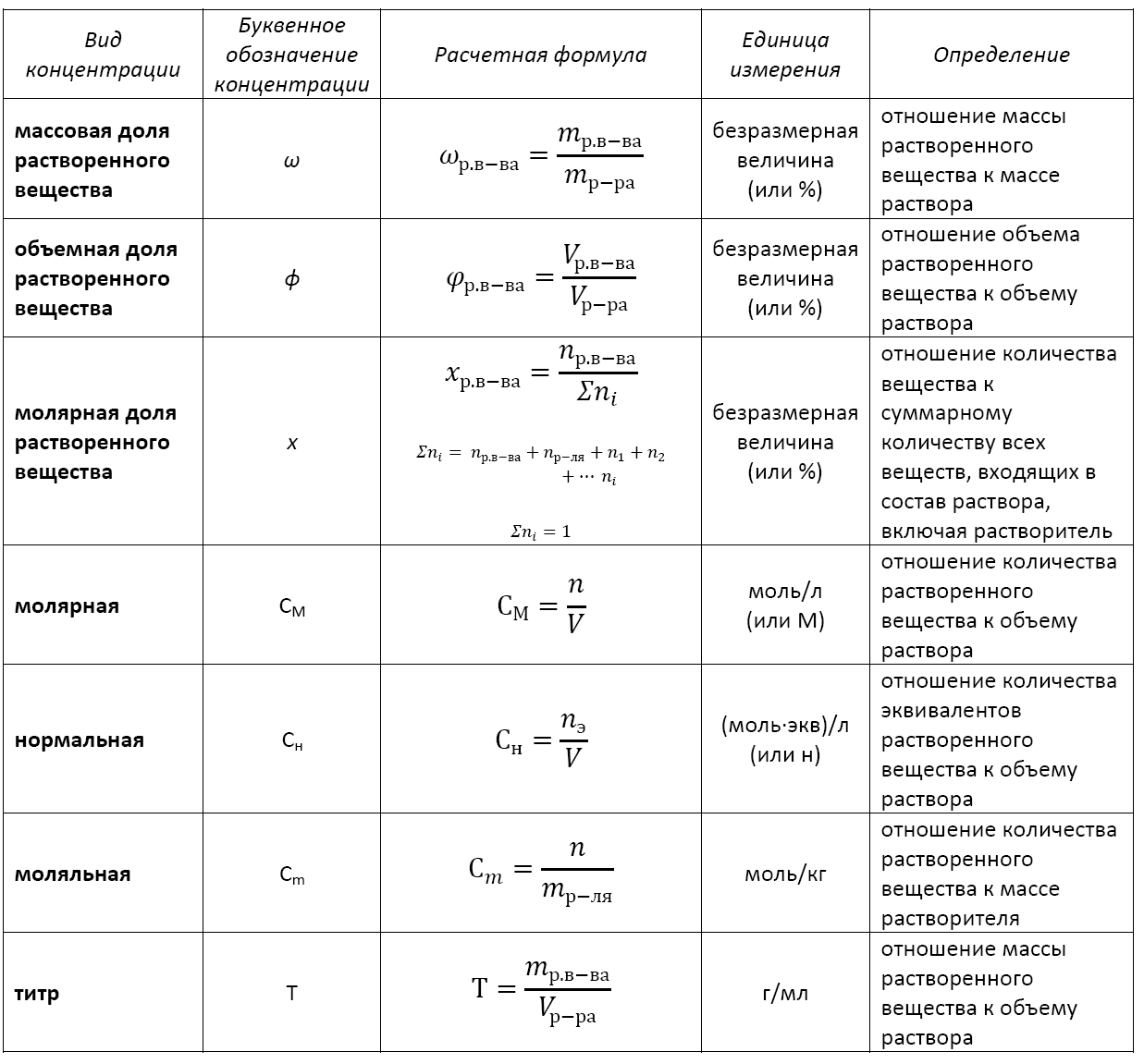
Существует несколько видов концентрации раствора:
— массовая доля растворенного вещества;
— объемная доля растворенного вещества;
— молярная доля растворенного вещества;
— молярная (или молярность);
— моляльная (или моляльность);
— нормальная (или эквивалентная);
— титр.
Формула концентрации раствора: основные виды
Применение того или иного вида концентрации уместно в каждом конкретном случае. Не существует какой-то универсальной концентрации или универсальной формулы концентрации раствора.
Кстати, с помощью математических преобразований можно перейти от одной концентрации к другой или найти взаимосвязь между разными их видами.
Основные расчетные формулы концентрации раствора приведены в таблице:
Массовая доля растворенного вещества и примеры ее вычисления
Массовая доля растворенного вещества – это отношение массы растворенного вещества к массе раствора.
Ее расчетная формула выглядит так:
где ωр.в-ва – массовая доля растворенного вещества, mр.в-ва – масса растворенного вещества, mр-ра – масса раствора.
ωр.в-ва представляет собой долю или от единицы или от 100%. Так, например, имеется двухпроцентный раствор NaCl. Его концентрация будет записана в первом случае ω(NaCl) = 0,02, а во втором – ω(NaCl) = 2%. Форма записи основной сути не меняет. Можно записывать и так, и так.
Что же означает выражение ω(NaCl) = 0,02 или ω(NaCl) = 2%? Буквально следующее: в 100 г водного раствора поваренной соли содержится 2 г этой соли и 98 г воды.
Необходимо помнить, что раствор состоит из растворителя и растворенного вещества. Поэтому масса раствора будет состоять из массы растворителя и массы растворенного вещества:
Тогда основную расчетную формулу для массовой доли растворенного вещества можно преобразовать:
Очень часто в расчетах с процентной концентрацией используются плотность и объем раствора:
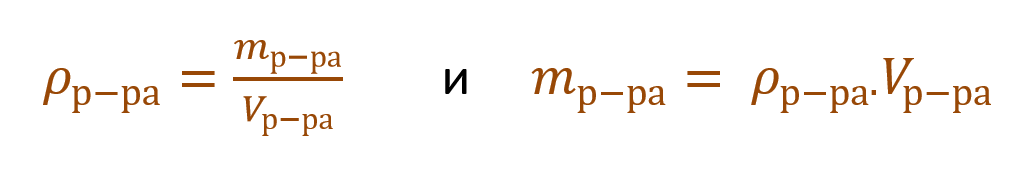
В других ситуациях могут использоваться объем и плотность не раствора, а растворителя. Тогда основная формула для расчета концентрации будет выглядеть так:
На практике бывает необходимо не только приготовить раствор с какой-либо определенной концентрацией, но и увеличить, либо уменьшить ее значение. Это достигается различными приемами:
— упариванием раствора;
— добавлением растворенного вещества;
— добавлением к раствору растворителя (например, воды).
Кроме того, приходится часто смешивать друг с другом растворы разных концентраций.
Разберем все возможные случаи.
Мы рекомендуем задачи, в которых речь идет о растворах, решать с использованием схематических рисунков. Это очень наглядно, особенно, когда речь идет о смешивании растворов.
Начнем с самого простого: вычислим концентрацию раствора.
Пример 1. В 200 г воды растворили 40 г глюкозы. Вычислите массовую долю глюкозы в полученном растворе.
Обратите внимание, что речи о каком-либо химическом взаимодействии не идет! Поэтому записывать уравнения реакций не требуется!
Запишем общую формулу для расчета массовой доли растворенного вещества:
В данной задаче глюкоза (C6H12O6) – растворенное вещество, а вода (H2O) – растворитель. Масса раствора будет складываться из массы глюкозы и массы воды:
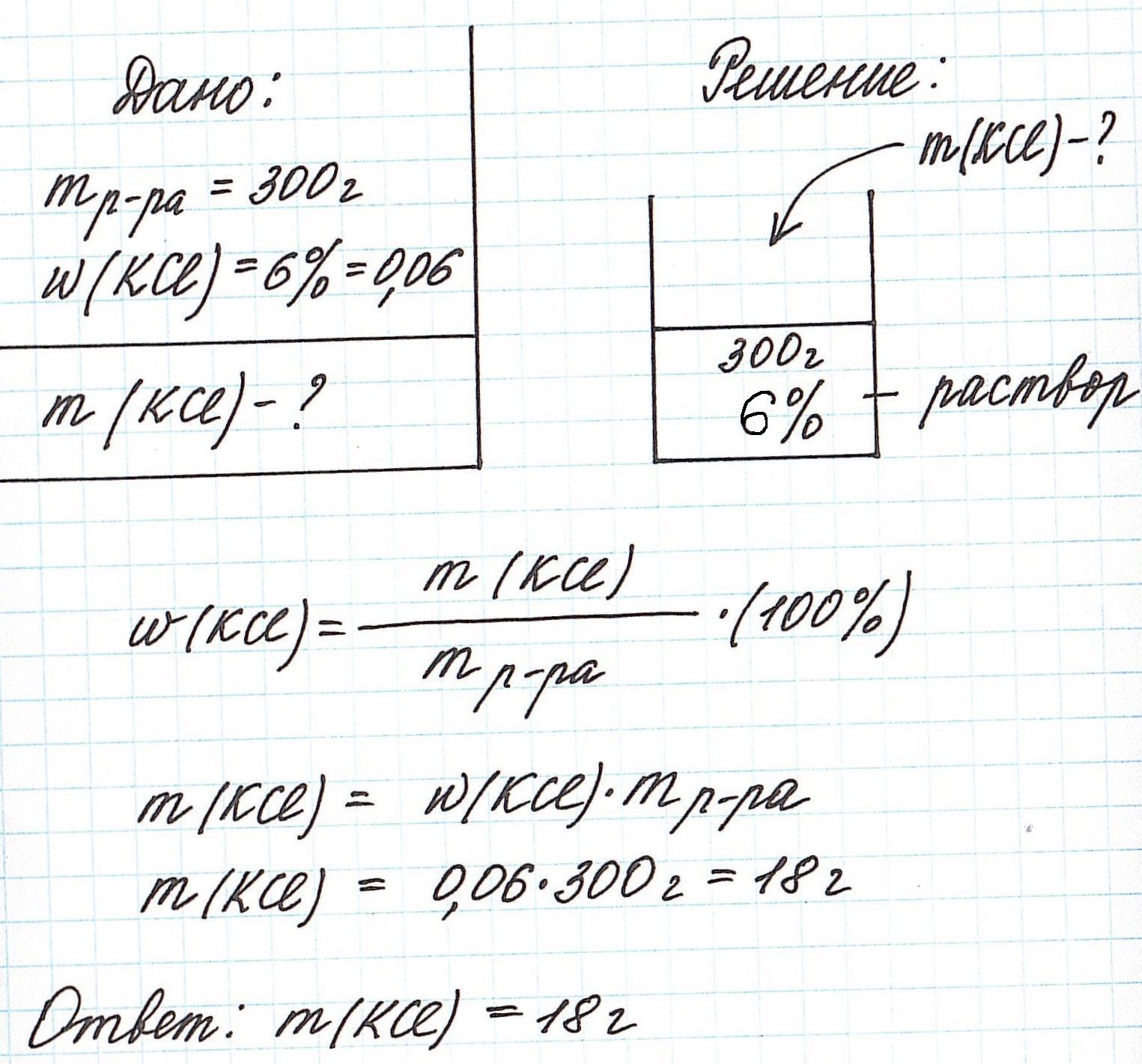
Пример 2. Рассчитайте, сколько потребуется хлорида калия, чтобы приготовить 300 г раствора с массовой долей соли 6%.
Обратите внимание, для того, чтобы расчеты были менее громоздкими, будем использовать выражение концентрации не в %, а в долях от единицы.
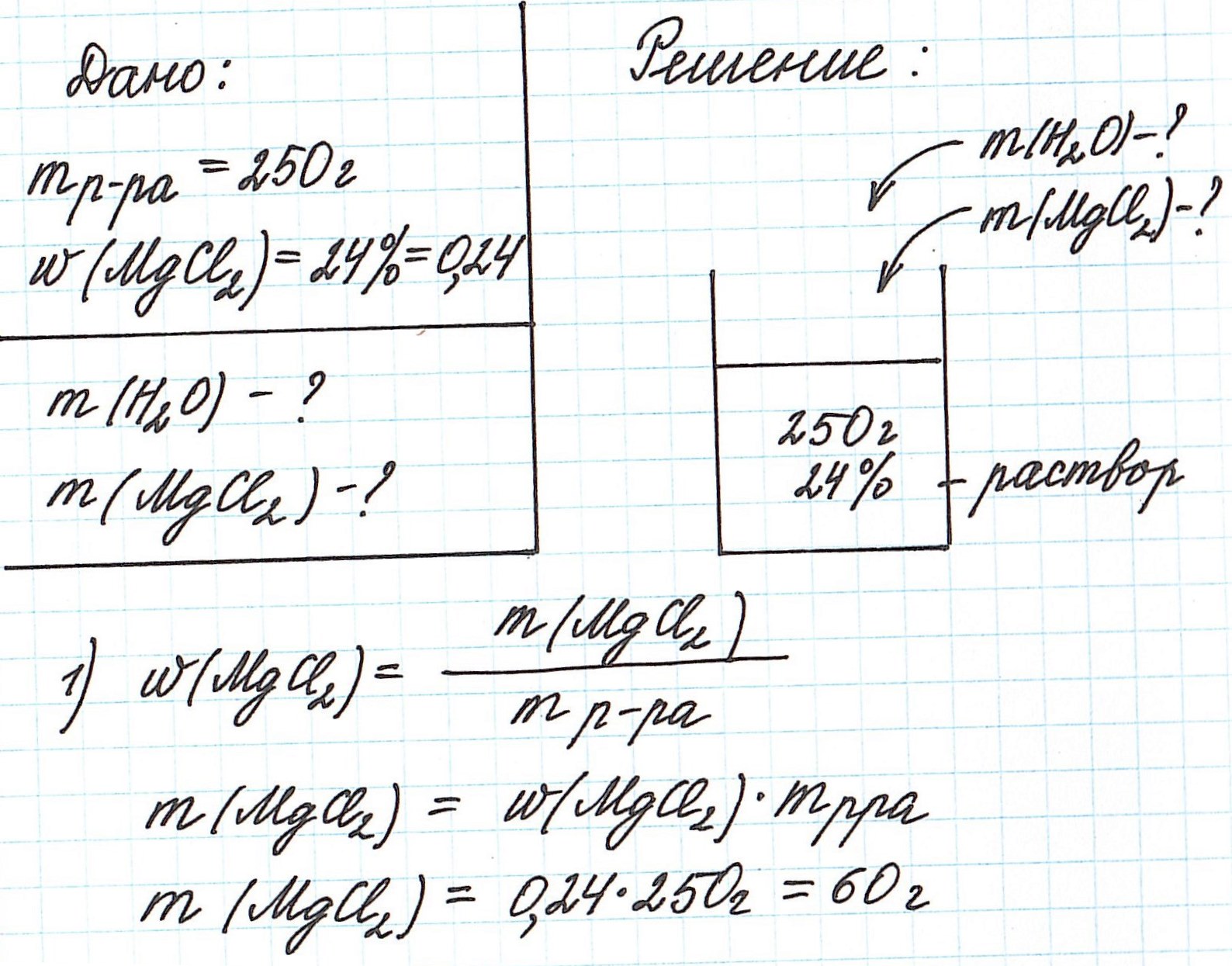
Пример 3. Необходимо приготовить 250 г раствора с массовой долей хлорида магния 24%. Рассчитайте массу требуемых воды и соли.
Так как раствор готовится из хлорида магния и воды, то и масса раствора равна сумме масс хлорида магния и воды:
Рассмотрим задачу, в которой в качестве растворителя выступает не вода, а другое вещество.
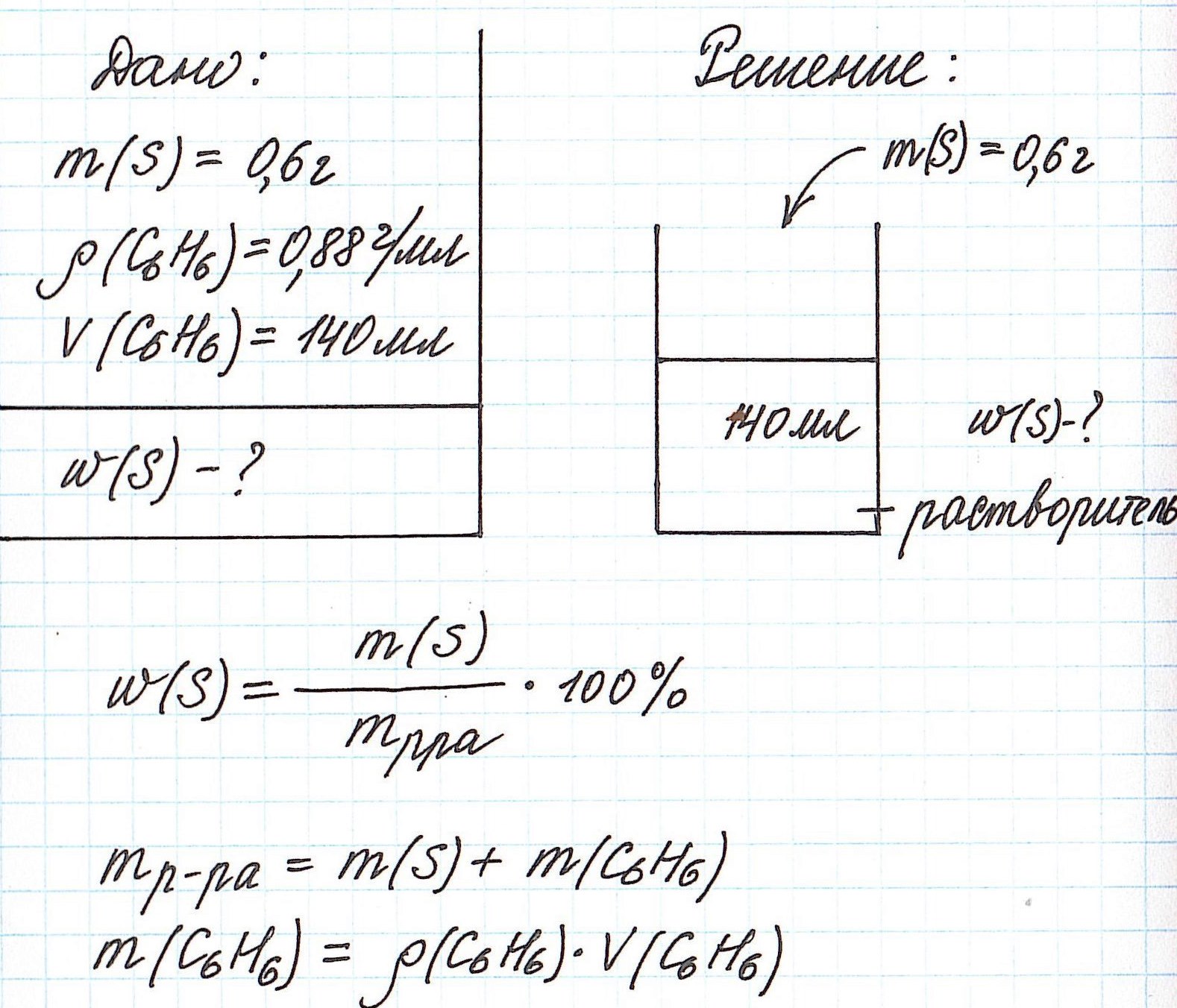
Пример 4. В органическом растворителе бензоле объемом 140 мл растворили серу массой 0,6 г. Вычислите массовую долю серы в полученном растворе, если плотность бензола составляет 0,88 г/мл.
Обратите внимание, что здесь:
— масса раствора не известна;
— масса растворителя (бензола) не известна;
— известны объем и плотность растворителя (бензола), что позволяет нам найти его массу;
— масса раствора состоит из массы растворителя (бензол) и массы растворенного вещества (сера).
Объединим все расчетные формулы в одну и подставим в нее имеющиеся численные значения:
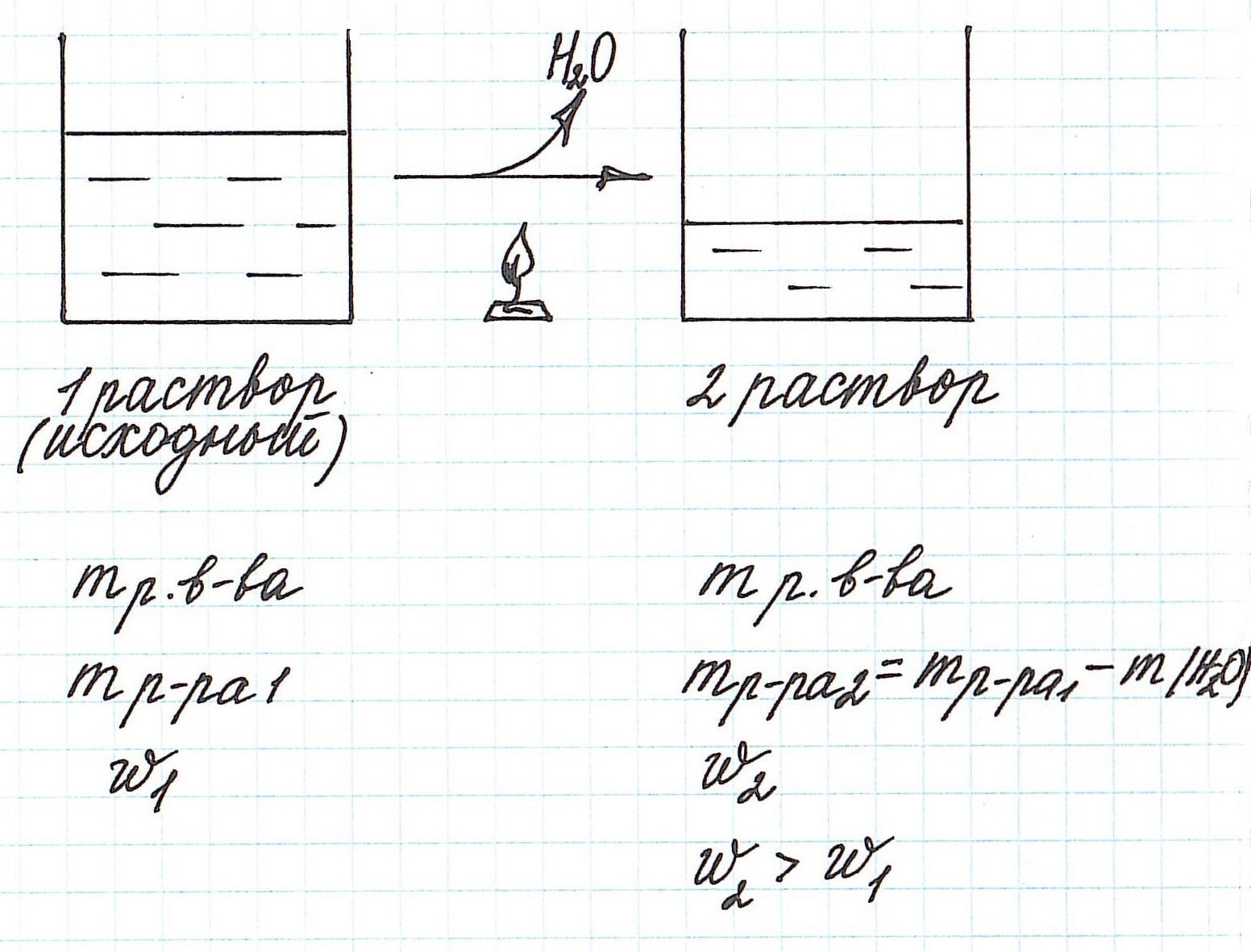
Вычисление массовой доли растворенного вещества при разбавлении раствора водой
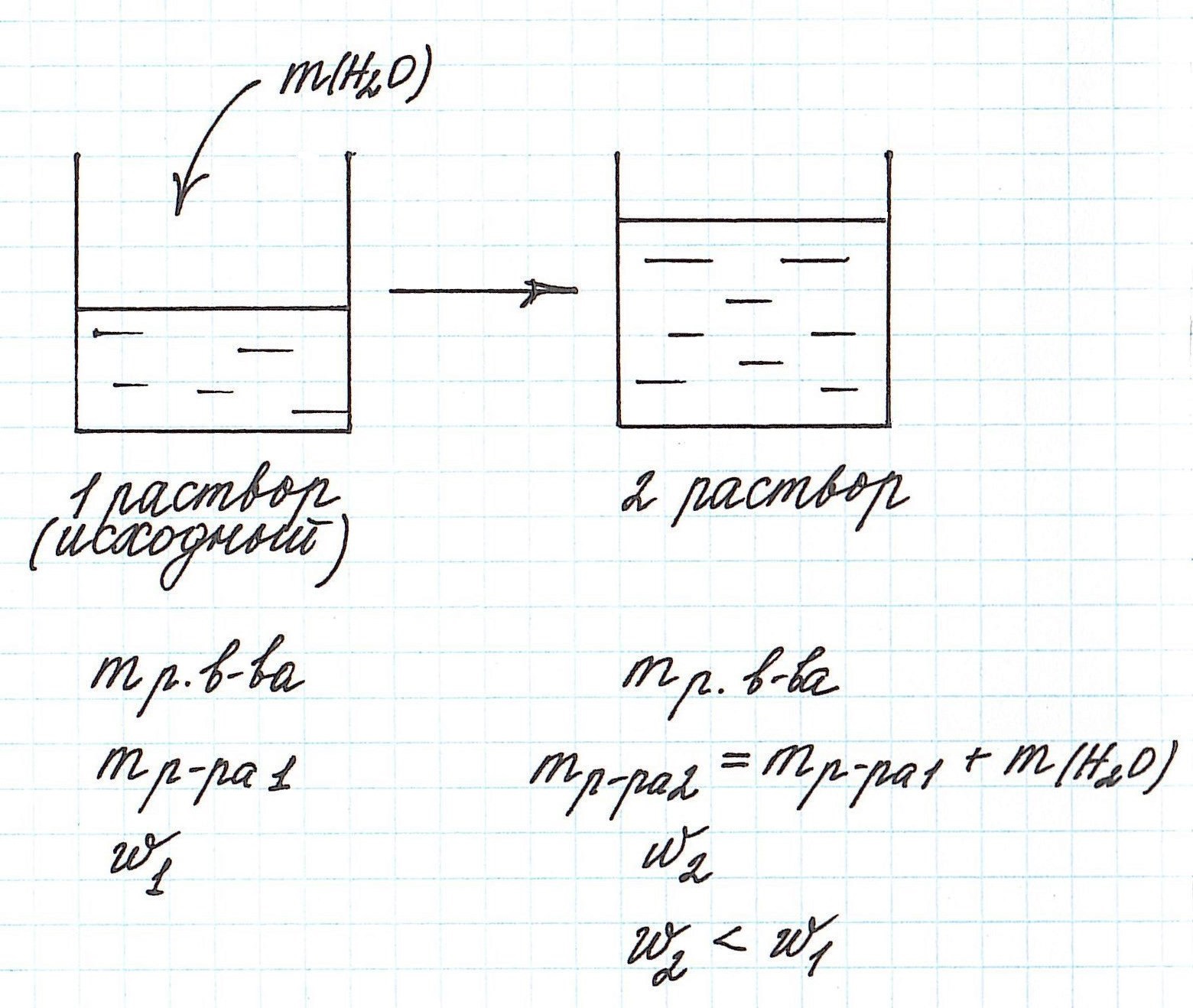
Разбавление раствора водой приводит к уменьшению его концентрации.
Запомним, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворителя;
— масса растворенного вещества остается постоянной.
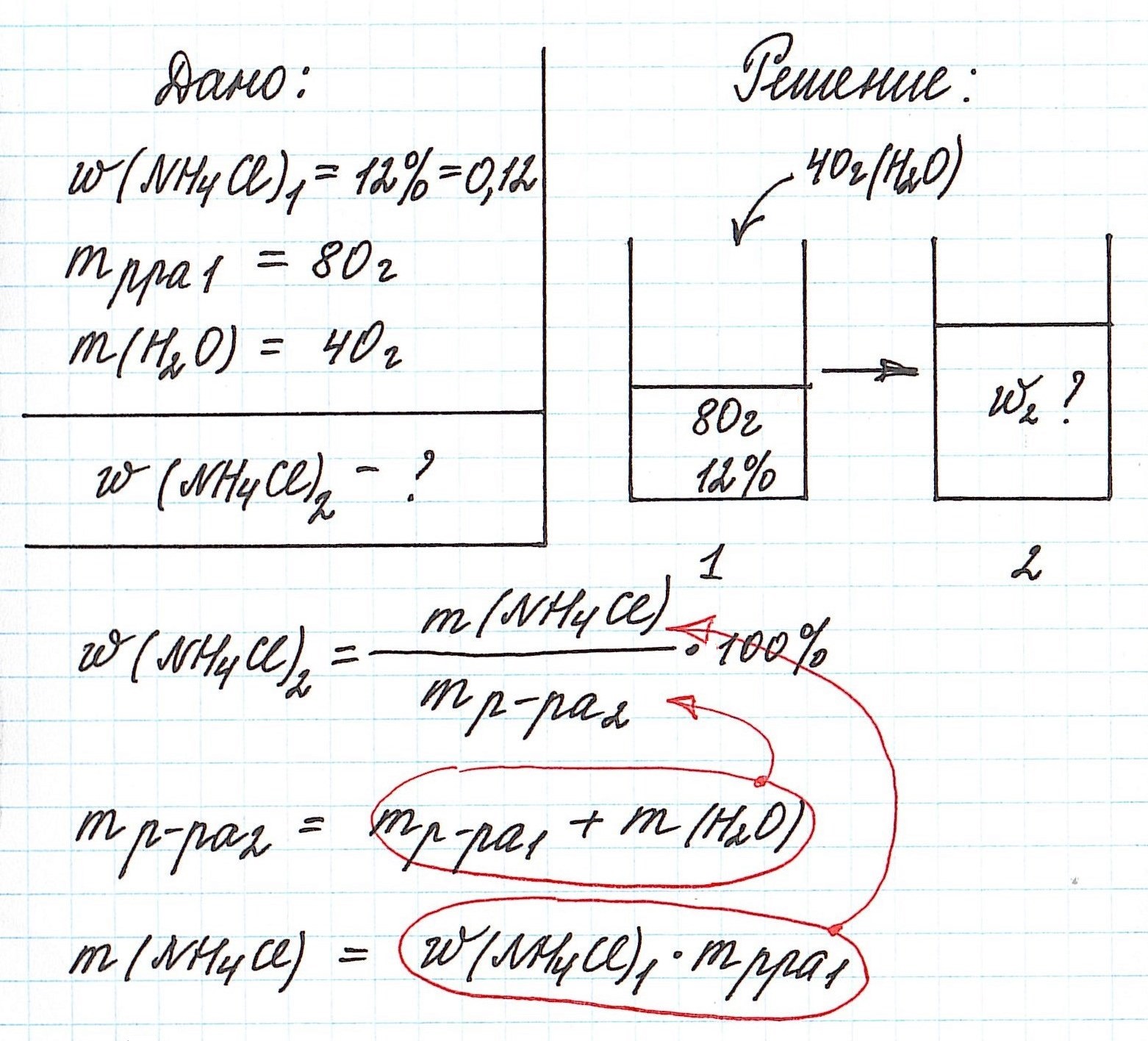
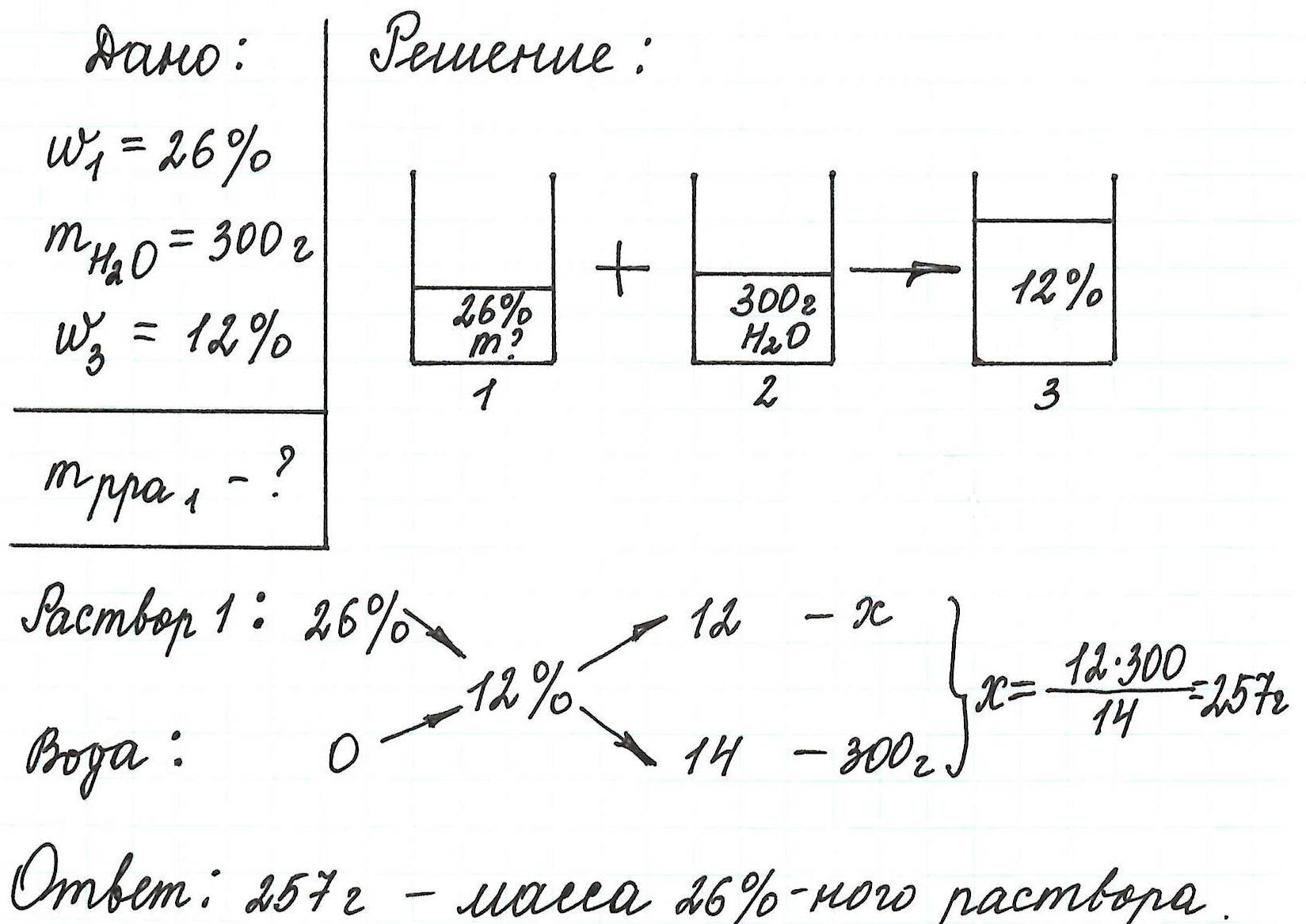
Пример 5. К 80 г раствора с массовой долей NH4Cl 12% добавили 40 г воды. Вычислите массовую долю хлорида аммония в полученном растворе.
Объединим все полученные формулы в одну и подставим имеющиеся данные:
Пример 6. Рассчитайте объем раствора фосфорной кислоты (массовая доля кислоты 12%, плотность 1,065 г/мл), который потребуется для приготовления раствора с массовой долей H3РO4 4% объемом 250 мл (плотность 1,02 г/мл).
В данной задаче речь напрямую о разбавлении раствора не идет. Но судя по тому, что исходный раствор имел концентрацию 12%, а конечный – 4%, становится ясно: последний раствор можно получить путем разбавления первого водой.
Вычисление массовой доли растворенного вещества при концентрировании раствора путем упаривания
Упаривание раствора, т.е. его нагревание, при котором происходит испарение воды, приводит к увеличению концентрации.
Учтите, что при этом:
— уменьшается масса раствора;
— уменьшается масса растворителя;
— масса растворенного вещества остается постоянной (при условии, что растворенное вещество не разлагается при данной температуре).
Пример 7. Из 200 г 27%-ного раствора глюкозы выпарили 20 г воды. Определите массовую долю глюкозы в полученном растворе.
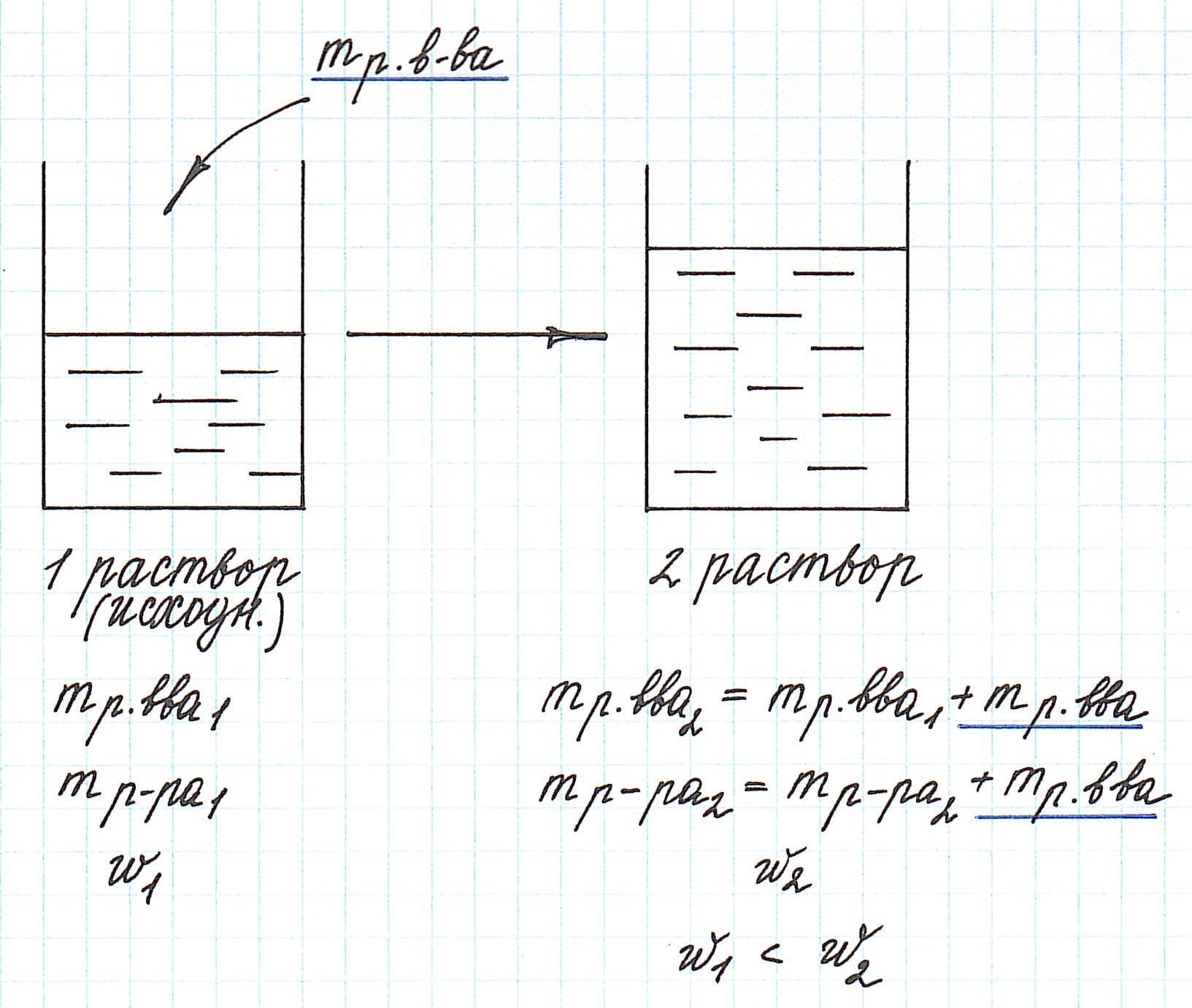
Вычисление массовой доли растворенного вещества при концентрировании раствора путем добавления растворенного вещества
Добавление к уже существующему раствору новой порции растворенного вещества приводит к увеличению концентрации раствора.
Помните, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества.
Пример 8. Определите массу хлорида калия, который надо добавить к 180 г 15%-ного раствора этой соли, чтобы получить 20%-ный раствор.
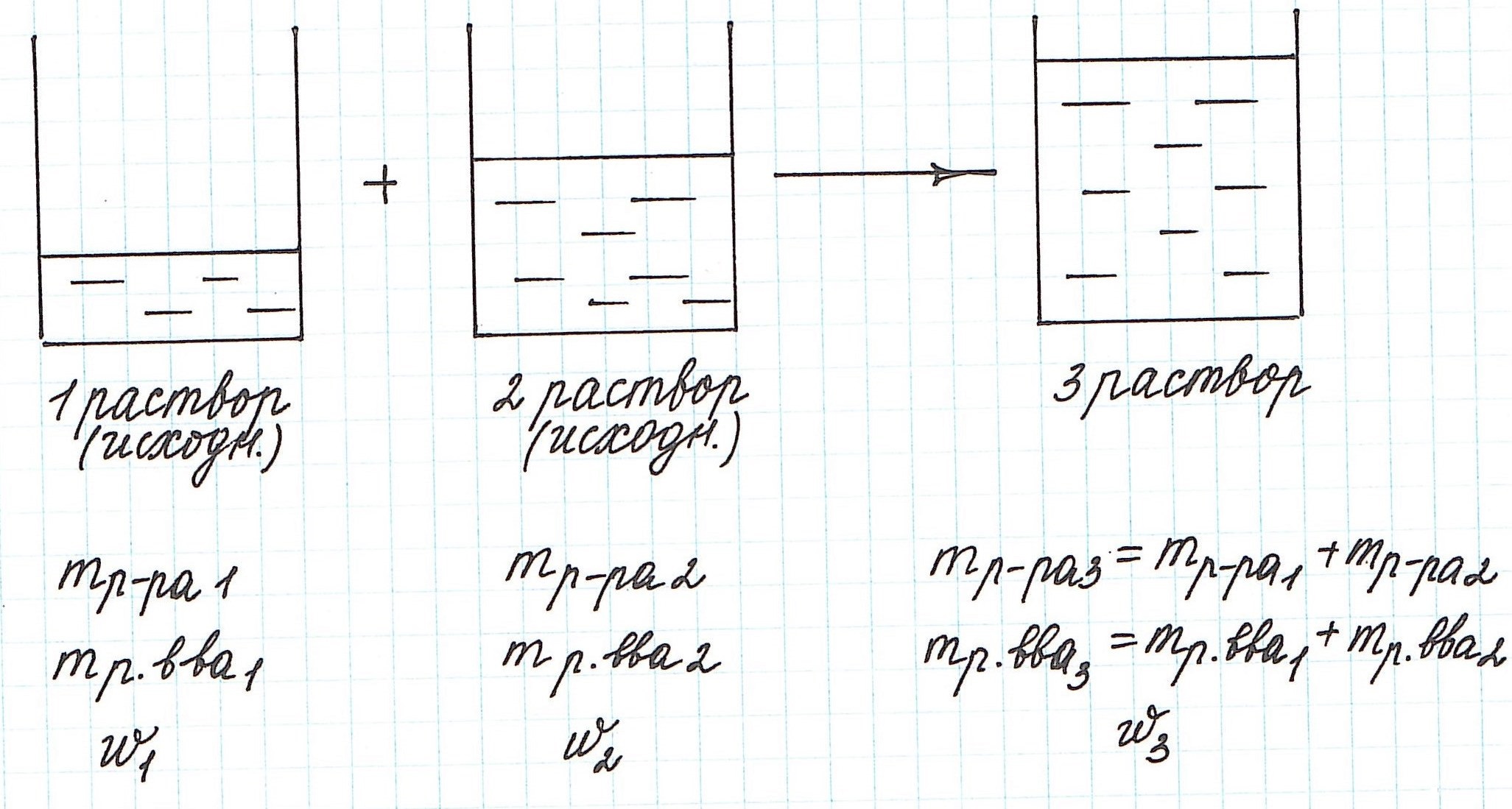
Вычисление массовой доли растворенного вещества при смешивании двух растворов
При смешивании двух растворов (речь о растворах одного и того же вещества конечно же) изменяются все количественные характеристики:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества;
— изменяется массовая доля растворенного вещества.
Пример 9. Смешали 80 г 32%-ного раствора и 30 г 10%-ного раствора нитрата меди (II). Какова концентрация соли в полученном растворе?
Вычисление массовой доли растворенного вещества с применением кристаллогидратов для приготовления раствора
Кристаллогидраты используются для приготовления растворов довольно часто. Кристаллогидраты представляют собой вещества, в состав которых помимо основного вещества входят молекулы воды. Например:
CuSO4·5H2O – кристаллогидрат сульфата меди (II) (или медный купорос);
Na2SO4·10H2O – кристаллогидрат сульфата натрия (или глауберова соль).
Больше примеров здесь.
Вода, входящая в состав кристаллогидрата, называется кристаллизационной.
Кристаллогидраты различаются прочностью связи между основным веществом и кристаллизационной водой. Одни из них теряют воду при комнатной температуре с течением времени и перестают быть кристаллогидратами (например, Na2СO3·10H2O). Другие – обезвоживаются только при сильном нагревании (например, CuSO4·5H2O).
При расчете концентрации с использованием кристаллогидратов для получения растворов часто приходится учитывать и кристаллизационную воду.
Но сначала поясним некоторые нюансы на конкретном примере:
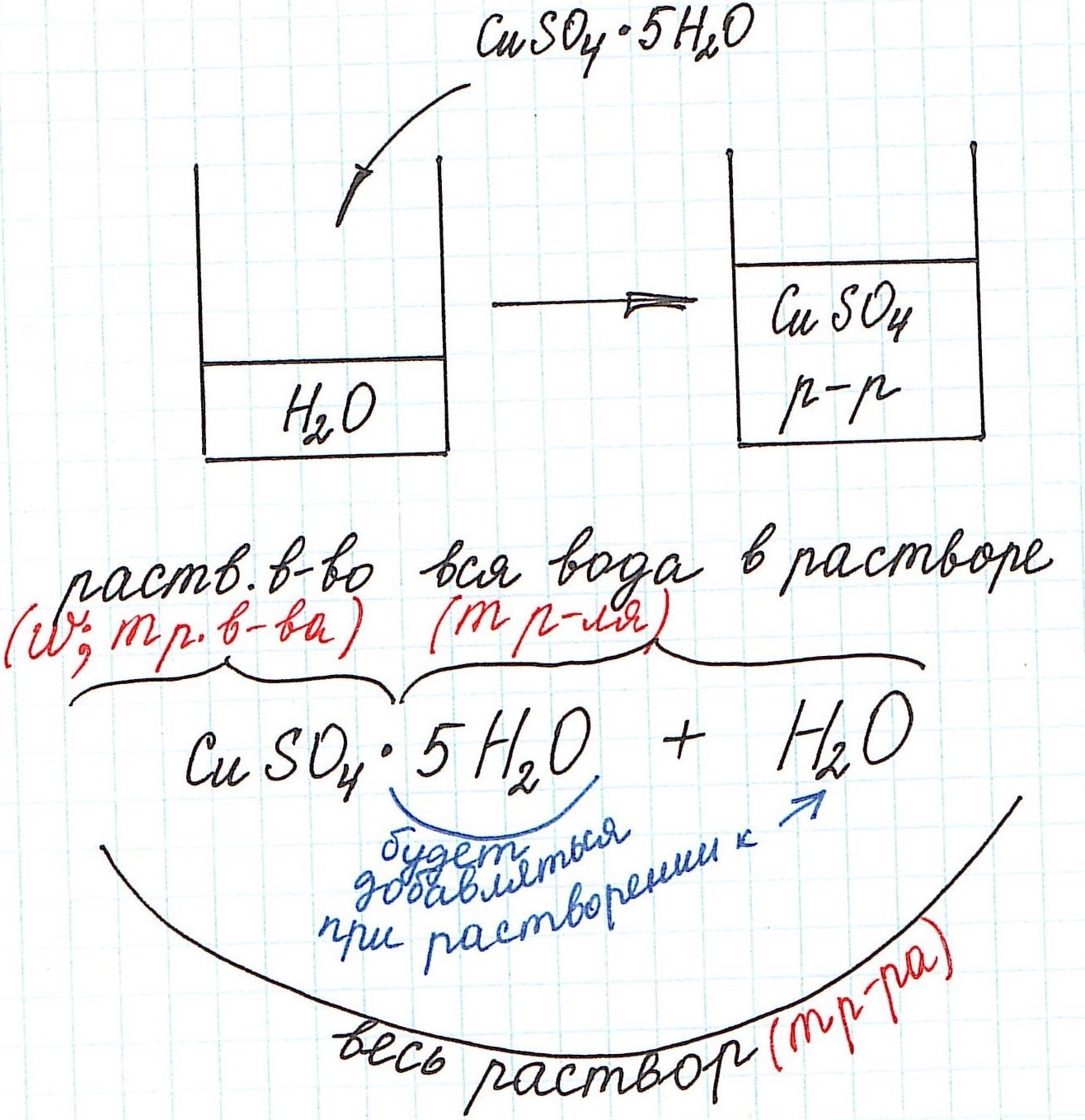
1) Формула CuSO4·5H2O означает, что 1 моль CuSO4·5H2O содержит 1 моль CuSO4 и 5 моль H2O. Это можно было бы записать так:
n(CuSO4) = n(CuSO4·5H2O); n(H2O) = 5n(CuSO4·5H2O)
2) Относительная молекулярная (и численно молярная) масса будет складываться из относительной молекулярной массы вещества и относительной молекулярной массы воды. Например:
Mr(CuSO4·5H2O) = Mr(CuSO4) + 5·Mr(H2O) = 160 + 5·18 = 250 и, соответственно,
M(CuSO4·5H2O) = M(CuSO4) + 5·M(H2O) = 160 + 5·18 = 250 г/моль.
3) Еще одну особенность поясним с помощью рисунка:
Итак, разберем несколько типичных задач.
Пример 10. В 60 г воды растворили глауберову соль Na2SO4·10H2O массой 5,6 г. Какова массовая доля сульфата натрия в полученном растворе?
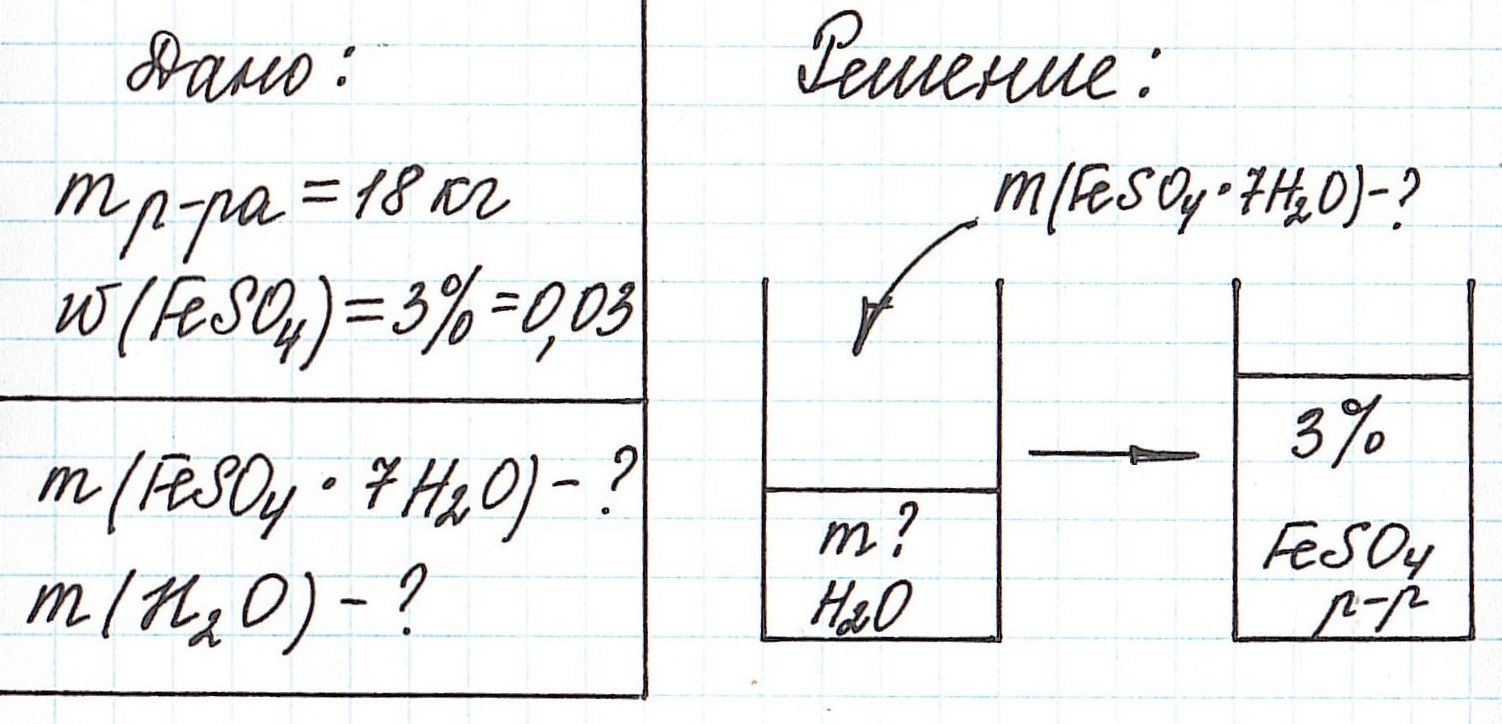
Пример 11. Какая масса железного купороса FeSO4·7H2O и воды потребуется для приготовления 18 кг раствора сульфата железа (II) с массовой долей FeSO4 3%?
Обратите внимание, что масса раствора дана не в граммах (г), а в килограммах (кг). Для того, чтобы привести в ходе расчетов все единицы измерения к единой системе, можно перевести килограммы в граммы и вычислять как обычно.
Но есть более простой способ. Можно считать количество вещества не в моль, а в киломоль (кмоль). Молярную массу вычислять не в г/моль, а в кг/кмоль. В этом случае ответ в задаче мы сразу получим в килограммах.
Пример 12. Вычислите массу кристаллогидрата сульфата никеля NiSO4·7H2O, который надо добавить к 180 г раствора с массовой долей сульфата никеля 1,5%, чтобы получить раствор с массовой долей соли 6%?
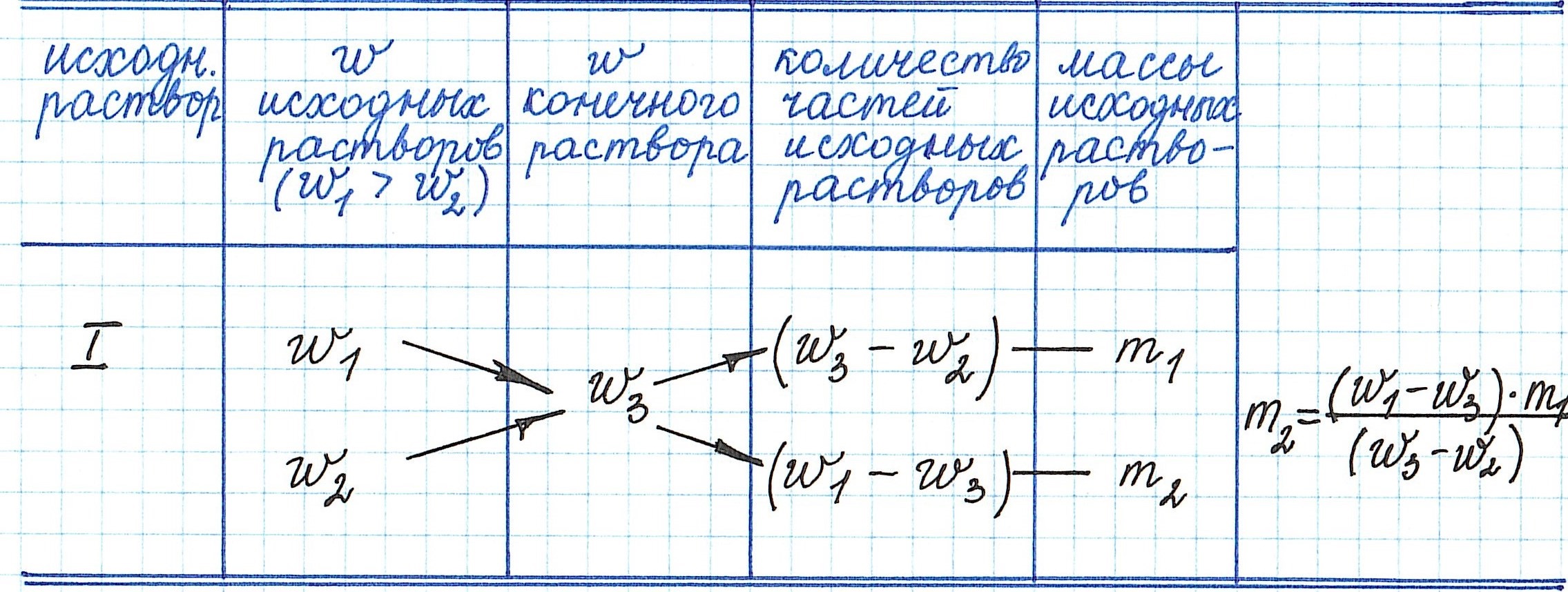
Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Правилом «креста» (или «квадратом Пирсона») очень удобно пользоваться в расчетах, связанных с разбавлением или смешиванием растворов.
Общая схема вычислений выглядит так:
Пример 13. Какую массу 5%-ного раствора глюкозы надо добавить к 70 г 21%-ного раствора этого же вещества, чтобы получить 12%-ный раствор?
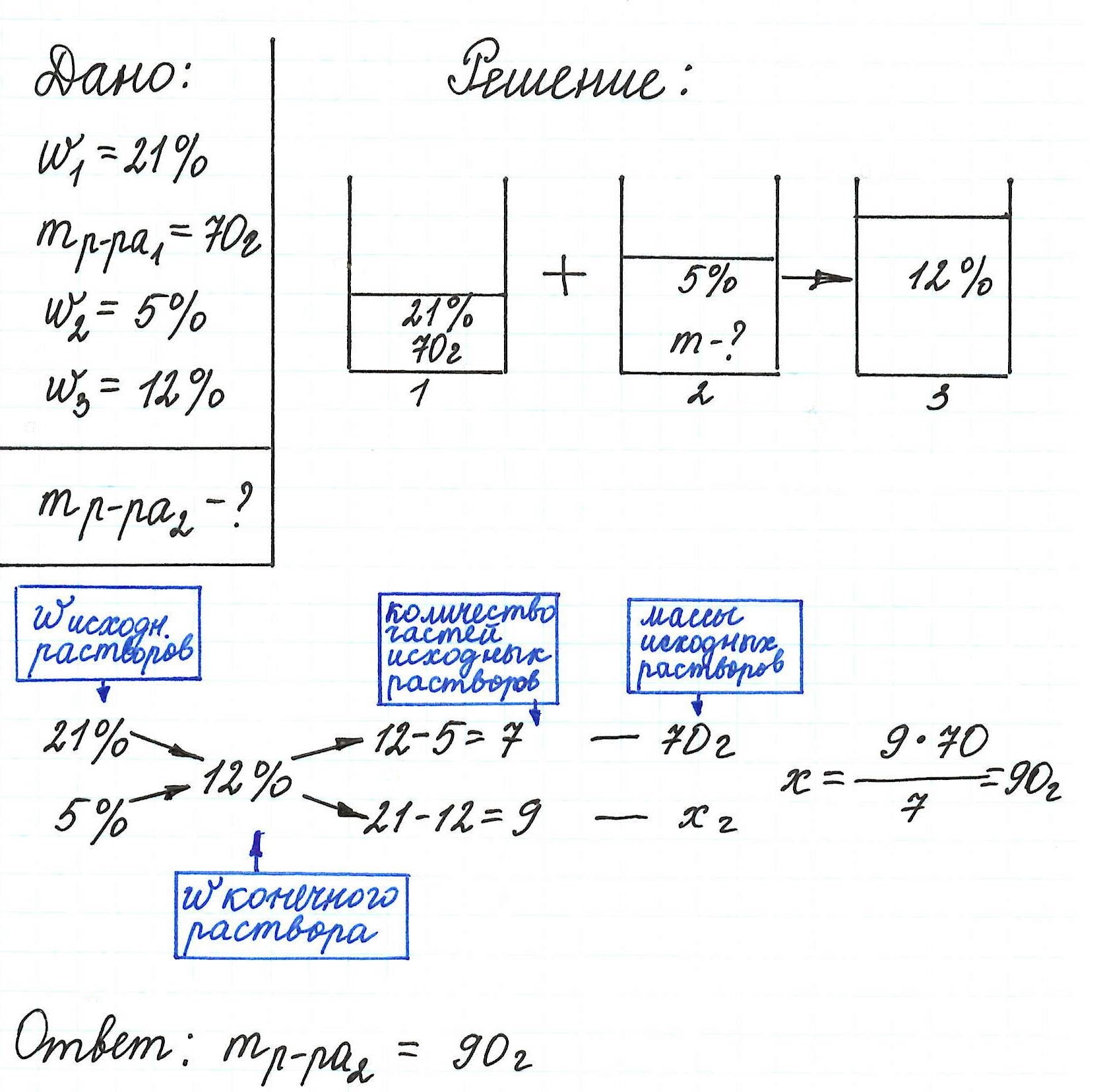
Еще примеры с применением правила «креста» можно посмотреть здесь.
Мы рассмотрели достаточно примеров расчетов, где используется формула такой концентрации раствора как массовая доля растворенного вещества. Как видим, ситуаций, в которых требуется ее применение, множество. Однако, есть достаточно случаев, когда более приемлемыми являются формулы других концентраций (молярной, нормальной, титра и т.д.). Об этом читайте в других статьях.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
или на Одноклассниках
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Ваше мнение для нас важно!
Download Article
Download Article
In chemistry, a solution’s concentration is how much of a dissolvable substance, known as a solute, is mixed with another substance, called the solvent. The standard formula is C = m/V, where C is the concentration, m is the mass of the solute dissolved, and V is the total volume of the solution. If you have a small concentration, find the answer in parts per million (ppm) to make it easier to follow. In a lab setting, you may be asked to find the molarity, or molar concentration, of the solution instead.
-
1
Find the mass of the solute mixed in with the solvent. The solute is the substance that you’re mixing in to form your solution. If you’re given the mass of the solute in your problem, write it down and be sure to label it with the correct units. If you need to find the mass of the solute, then weigh it on a lab scale and record the measurement.[1]
- If the solute you’re using is a liquid, then you can also calculate the mass using the density formula, where density D = m/V, where m is the mass of the liquid and V is the volume. To find the mass, multiply the density of the liquid by the volume.
Tip: If you need to use a scale, subtract the mass of the container you’re using to hold the solute or else your calculations will be off.
-
2
Record the total volume of the solution. The total volume of the solution is the amount of solvent plus the amount of solute added to it. If you’re finding the volume in a lab, mix the solution in a graduated cylinder or beaker and look at the measurement. Measure the volume from the curve at the top of the solution, or the meniscus, to get the most accurate reading. Record the volume of the solution.[2]
- If you aren’t measuring the volume yourself, you may need to convert the mass of the solute into volume using the density formula.
- For example, if you’re finding the concentration of 3.45 grams of salt in 2 liters of water, you would find the volume of salt using the density formula. Look up the density of salt either in a textbook or online and solve the formula for m. In this case, the density of salt is 2.16 g/mL. The formula would read 2.16 g/mL = (3.45 g)/V. Multiply each side by V to get V(2.16 g/mL) = 3.45 g. Then divide the each side by 2.16 to find the volume, or V = (3.45 g)/(2.16 g/mL) = 1.60 mL.
- Add the volume of the solute to the volume of your solvent, ma. So in this example, 2 L + 1.6 mL = 2,000 mL + 1.6 mL = 2,001.6 mL. You can either leave the measurement in milliliters or convert it back to liters to get 2.002 L.
Advertisement
-
3
Divide the mass of the solute by the total volume of the solution. Write out the equation C = m/V, where m is the mass of the solute and V is the total volume of the solution. Plug in the values you found for the mass and volume, and divide them to find the concentration of your solution. Don’t forget to label to label your answer with the correct units.[3]
- In our example for the concentration of 3.45 grams of salt in 2 liters of water, your equation would be C = (3.45 g)/(2.002 L) = 1.723 g/L.
- Certain problems may ask for your concentration in specific units. Be sure to convert the units before putting them in your final formula.
Advertisement
-
1
Find the mass of the solute in grams. Measure out the mass of the solute that you plan on mixing with your solution. Be sure to subtract the weight of the container you’re using to measure the solute or else your concentration will be inaccurate.[4]
- If your solute is a liquid, you may need to calculate the mass using the formula D = m/V, where D is the liquid’s density, m is the mass, and V is the volume. Look up the density of the liquid in a textbook or online and then solve the equation for the mass.
-
2
Determine the total mass of the solution in grams. The total mass of the solution is the mass of the solvent plus the mass of the solute. Weight the masses using a lab scale or convert the volume of the solvent to mass by using the density formula D = m/V. Add the mass of the solute to the mass of the solvent to find your final volume.[5]
- For example, if you want to find the concentration of 10 g of cocoa powder mixed with 1.2 L of water, you would find the mass of the water using the density formula. The density of water is 1,000 g/L, so your equation would read 1,000 g/L = m/(1.2 L). Multiply each side by 1.2 L to solve the mass in grams, so m = (1.2 L)(1,000 g/L) = 1,200 g. Add the mass of the cocoa powder to get 1,210 g.
-
3
Divide the mass of the solute by the total mass of the solution. Set up your equation so the concentration C = mass of the solute/total mass of the solution. Plug in your values and solve the equation to find the concentration of your solution.[6]
- In our example, C = (10 g)/(1,210 g) = 0.00826.
-
4
Multiply your answer by 100 if you want to find the percent concentration. If you’re asked to list the concentration in a percentage, take the answer you just found and multiply it by 100. Label your final answer with a percentage sign.[7]
- In this example, the percent concentration is (0.00826)(100) = 0.826%.
-
5
Multiply the concentration by 1,000,000 to find the parts per million. Use the number you found for your concentration and multiply it by 1,000,000 or 106. The number will be how many parts per million the solute is. Label your final answer in ppm.[8]
- In our example, the ppm = (0.00826)(1,000,000) = 8,260 ppm.
Tip: Parts per million is usually used for very small concentrations since it’s easier to write and understand than a percentage.
Advertisement
-
1
Add the atomic masses of the solute together to find the molar mass. Look at the elements in the chemical formula for the solute you’re using. List the atomic mass for each element in the solute since atomic and molar mass are the same. Add together the atomic masses from your solute to find the total molar mass. Label the final measurement in g/mol.[9]
- For example, if your solute is potassium hydroxide (KOH), find the atomic masses for potassium, oxygen, and hydrogen and add them together. In this case molar mass = 39 +16 + 1 = 56 g/mol.
- Molarity is used mainly in chemistry when you know the chemical makeup of the solute you’re using.
-
2
Divide the mass of the solute by the molar mass to find the number of moles. Find the mass of the solute you’re adding into your solution using a lab scale if you need to.[10]
Be sure to subtract the mass of the container so you have an accurate reading. Divide the mass you found by the molar mass so you can find how many moles of the solute you’re using. Label your answer with “mol.”[11]
- For example, if you want to find the number of moles in 25 g of potassium hydroxide (KOH), then the equation is mol = (25 g)/(56 g/mol) = 0.45 mol
- Convert the mass of your solute to grams if it isn’t already listed in grams.
- Moles are used to represent the number of atoms in the solution.
-
3
Convert the volume of the solution to liters. Find the volume of the solvent before you mix in the solute.[12]
Use a flask or a graduated cylinder to find the measurement if you aren’t given it. If your measurement is in milliliters, then divide it by 1,000 to convert it to liters.[13]
- In this example, if you’re using 400 mL of water, then divide it by 1,000 to convert it to liters, which is 0.4 L.
- If your solvent is already listed in liters, then you can skip this step.
Tip: You don’t need to include the volume of the solute since it doesn’t usually affect the volume that much. If there is a visible change in volume when you mix the solute with the solvent, then use the total volume instead.
-
4
Divide the moles of solute by the volume of the solution in liters. Set up your equation so the molarity M = mol/V, where mol is the number of moles of the solute and V is the volume of the solvent. Solve the equation and label the answer M.[14]
[15]
- In this example, M = (0.45 mol)/(0.4 L) = 1.125 M.
Advertisement
Calculator, Practice Problems, and Answers
Add New Question
-
Question
How do I convert milligrams to moles?
First, calculate the molar mass of your substance. (Add the atomic masses of the constituent elements.) Then, convert milligrams to grams by dividing by 1000. Finally, divide the grams of your substance by the Molar Mass.
-
Question
If I have a solution with unknown mass, how do I calculate concentration?
Calculate the number of moles using the equation c=n/v for the first given solution.Then using the no of moles calculate the mass using equation n=m/Mr.
-
Question
If I am given two solutions, what is one way of knowing which one is more/less concentrated?
You can perform titrations. Under the Le Chatelier’s principle, the more concentrated one will have faster reacting time due to the fact that the more concentrated one has more molecules of that substance, leading to the ultimate truth that the chances of molecules meeting each other is bigger. Note that this method will not work if you are dropping Transition Metals into room-temperature, concentrated HNO3 or H2SO4 since Iron (and other metals) has the property called passivation. It happens when the metal reacts w/ the acid so quickly that the metal forms a salt, preventing the further reaction to the acid.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
If you are in a lab and don’t know how much of a solute was added, you can perform a titration test using other reactive chemicals. You do need to learn how to balance chemical equations with stoichiometry.
Advertisement
About This Article
Article SummaryX
To calculate the concentration of a solution, start by converting the solute, or the substance being dissolved, into grams. If you’re converting from milliliters, you may need to look up the solute’s density and then multiply that by the volume to convert to grams. Next, convert the solvent to liters. Finally, divide the solvent by the solute to find the concentration of the solution. To learn how to calculate the concentration of a solution as a percentage or parts per million, scroll down!
Did this summary help you?
Thanks to all authors for creating a page that has been read 1,980,546 times.
Did this article help you?
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ КРЫМ
Государственное
автономное образовательное учреждение
среднего
профессионального образования Республики Крым
«Керченский
медицинский колледж имени Г.К. Петровой»
МЕТОДИЧЕСКАЯ
РАЗРАБОТКА
ПРАКТИЧЕСКОГО
ЗАНЯТИЯ № 1
по
дисциплине «Математика»
по
теме: Определение процента, объема и концентрации препаратов
Для
специальности: 31.02.02 Акушерское дело
Методическая разработка
практического занятия составлена в соответствии с ФГОС СПО по специальности 31.02.02
Акушерское дело
Организация-разработчик:
ГАОУ СПО РК «Керченский медколледж им. Г.К.Петровой»
Разработчик:
Дунаева
Д.В. – преподаватель дисциплины Математика ГАОУ СПО РК
«Керченский медколледж им. Г.К.Петровой»
Методическая разработка рассмотрена
на заседании предметной (цикловой) комиссии естественно-научных и
общеобразовательных дисциплин ГАОУ СПО РК «Керченский медколледж им. Г.К.
Петровой»,
протокол №____от______________ 20__ г.
Председатель
предметной (цикловой) комиссии _________________ Т.В. Мамонтова
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ КРЫМ
Государственное
автономное образовательное учреждение
среднего
профессионального образования Республики Крым
«Керченский
медицинский колледж имени Г.К. Петровой»
МЕТОДИЧЕСКАЯ
РАЗРАБОТКА
ПРАКТИЧЕСКОГО
ЗАНЯТИЯ № 1
по
дисциплине «Математика»
по
теме: Определение процента, объема и концентрации препаратов
Для специальности:
34.01.02 Сестринское дело
Методическая разработка теоретического
занятия (лекции) составлена в соответствии с ФГОС СПО по специальности
34.01.02 Сестринское дело
Организация-разработчик:
ГАОУ СПО РК «Керченский медколледж им. Г.К.Петровой»
Разработчик:
Дунавева
Д.В.
– преподаватель дисциплины Математика ГАОУ СПО РК «Керченский медколледж им.
Г.К.Петровой»
Методическая разработка рассмотрена
на заседании предметной (цикловой) комиссии естественно-научных и
общеобразовательных дисциплин ГАОУ СПО РК «Керченский медколледж им. Г.К.
Петровой»,
протокол №____от______________ 20__ г.
Председатель
предметной (цикловой) комиссии _________________ Т.В. Мамонтова
I.
Методический блок
Тема: Определение процента, объема и концентрации препаратов.
Количество
часов: 2
Вид занятия: практическое
занятие
1. Учебные цели:
Студент
должен знать:
—
определение процента;
—
определение пропорции;
—
правила работы с метрическими единицами;
—
основные способы расчета концентрации
(приготовления) рабочих растворов.
Студент
должен уметь:
—
применять математические знания в
практической работе
2. Развивающие цели: развитие
логических и вычислительных способностей студента; развитие и закрепление
знаний по метрической системе единиц; закрепление знаний по расчету
концентрации растворов;
3.
Воспитательные цели: воспитание
чувства любви к Родине, ответственного отношения к обучению.
Учебно-методическое оснащение:
конспект лекций, Гилярова М.Г. «Математика для медицинских колледжей»,
индивидуальные карточки
Ход занятия
|
№ пп |
Основные этапы лекции и |
Время этапа, мин |
Методы, приёмы и формы обучения |
Учебно-методическое обеспечение |
|
1 |
Организационный этап |
5 |
||
|
1.1. |
Проверка присутствующих Проверка готовности |
|||
|
1.2. |
Сообщение темы занятия, ее |
|||
|
2 |
Основной этап |
80 |
Групповое и самостоятельное |
Конспект лекции Индивидуаль-ные карточки |
|
2.1 |
Формирование умений и навыков: |
|||
|
2.2 |
Контроль и коррекция уровня: |
|||
|
3 |
Заключительный этап |
5 |
Уч. «Математика для |
|
|
3.1 |
Подведение итогов |
|||
|
3.2 |
Анализ и оценка |
|||
|
3.3 |
Домашнее задание Уч. «Математика для |
1. ЗАДАЧИ НА ВЫЧИСЛЕНИЕ ОБЪЕМА
ЛЕКАРСТВЕННОГО ВЕЩЕСТВА (ДОЗИРОВКА):
Давая пациенту таблетки и
капсулы, всегда нужно помнить, что дозировка препарата, имеющегося у вас, и дозировка,
назначенная врачом, должны быть в одинаковых единицах измерения. Так, если
врач назначил 1 г препарата, а у медсестры таблетки препарата по 250 мг, то она
должна знать, что 1 г = 1000 мг, и дать больному 4 таблетки.
Задачи:
1. Пациенту назначен препарат
в дозе 600 мг на прием. Препарат расфасован по 1 грамму. Сколько грамм нужно
дать пациенту?
Решение:
Составим пропорцию: 1 г – 1000 мг
Х г – 600 мг
Теперь решим эту пропорцию
Х=  = 0,6 г
= 0,6 г
Ответ: необходимо дать пациенту 0,6
г препарата.
2. Пациент должен принимать
лекарство в р-ре по одной чайной ложке 2 р. в день в течение 10 дней. Какое
количество лекарственного р-ра ему назначит врач? Объем одной чайной ложки = 5
мл.
Решение:
В день необходимо принять 2
чайные ложки, т.е. 5 мл* 2 = 10 мл
В течение 10 дней, т.е. 10
мл*10 = 100 мл
Ответ: необходимо выписать 100 мл
лекарственного раствора
3. Таблетка содержит 0,5 мг
активного вещества. Назначение врача 0,125 мг. Сколько таблеток необходимо
дать пациенту?
Ответ: 0,25 таблетки.
2.
ЗАДАЧИ
НА ВЫЧИСЛЕНИЕ КОНЦЕНТРАЦИИ РАСТВОРА
В
работе медицинской сестры вы часто будете сталкиваться с приготовлением
растворов для различных манипуляций, например для дезинфекции оборудования.
Каждый раствор
характеризуется концентрацией растворенного вещества, т.е. количеством
вещества, содержащегося в определенном количестве раствора.
Запомните!
Задачи:
1. Сколько грамм сухой
глюкозы содержится в 1л 5% раствора глюкозы?
Решение: Составляем пропорцию
100 ml — 5 г
1000 ml — Х г
Отсюда количество глюкозы в
1л 5% раствора составит = 50 г.
Ответ : 50 г
2. Приготовить 3л 3% раствора соды.
Решение:
|
Кол-во соды в л 3% р-ра: В 100 мл – 3 г соды В 1000 л (1 л) – 30 г соды В 3 л – 90 г соды |
Кол-во воды в л 3% р-ра: 3000 л (3 л) всего р-ра – 90 г соды |
Ответ: 90 г соды и 2910 мл воды
3. Приготовить 2 литра 1,5 %
раствора гипохлорида кальция Ca(ClO)2 из 5 % раствора.
Решение:
|
Имеем: 5% р-р Ca(ClO)2 Значит: В 100 мл – 5 г Ca(ClO)2 |
Необходимо: 2 л 1,5 % р-ра Ca(ClO)2 Значит: В 100 мл – 1,5 г Ca(ClO)2 В 1000 л (1 л) – 15 г Ca(ClO)2 В 2 л – 30 г Ca(ClO)2 |
Т. к. имеем в 100 мл 5% р-р Ca(ClO)2 – 5 г сухого вещества Ca(ClO)2, а необходимо
приготовить 2 л 1,5 % р-ра Ca(ClO)2 , в котором будет
содержаться 30 г Ca(ClO)2, то необходимо взять:
5 % р-ра:
[ 100 мл – 5 г Ca(ClO)2 ] *6
600 мл – 30 г Ca(ClO)2
Воды:
2000 мл 1,5% необходимого
р-ра – 600 мл 5% имеющегося р-ра = 1400 мл = 1,4 л воды
Ответ: Для приготовления 2 литров
1,5% раствора гипохлорита кальция необходимо взять 600 мл 5% раствора ( в нем
будет содержаться 30 г вещества) и добавить 1,4 литра воды.
3.
ЗАДАЧИ
НА РАЗВЕДЕНИЕ АНТИБИОТИКОВ
Внимание! Некоторые препараты
дозируются не в единицах метрической системы (например, граммах), а в ЕД или
МЕ.
В ЕД (единицах
действия) измеряются, например, антибиотики, инсулин, панкреатин, нистатин.
Причем, на флаконе
антибиотика могут быть указаны граммы или миллиграммы, или ЕД.
МЕ (международная единица) —
в фармакологии это единица измерения количества вещества,
основанная на биологической активности. Используется для витаминов, гормонов, вакцин, составляющих крови и
подобных биологически активных веществ
Задачи:
1. Во флаконе 1 000 000ЕД
пенициллина. Для разведения использовали 10 мл раствора новокаина.
Назначение врача: необходимо
сделать инъекцию 90 000 ЕД
Вычислить:
1.
Сколько
мл раствора вы набираете в шприц для инъекции?
2.
Сколько
остается во флаконе ЕД антибиотика?
3.
Сколько
остается во флаконе мл раствора антибиотика?
Решение:
1.
Сколько
мл р-ра набрать в шприц:
Имеем во флаконе пенициллин + новокаин
Значит в 10 мл содержится 1 000 000 ЕД
Необходимо 90 000 ЕД
|
Значит в 10 мл – 1 000 000 ЕД в 1 мл – 100 000 ЕД в 0,1 мл – 10 000 ЕД * 9 в 0,9 мл – 90 000 ЕД |
ИЛИ |
Составим пропорцию 10 мл – 1 000 000 ЕД Х мл – 90 000 ЕД Х = (10 * 90 000) / 1 |
2.
Сколько
останется во флаконе ЕД антибиотика:
1 000 000 ЕД – 90 000 ЕД = 910 000 ЕД
3.
Сколько
останется во флаконе мл раствора антибиотика:
10 мл – 0,9 мл = 9,1 мл
ОТВЕТ: 0,9мл ; 910 000 ЕД.; 9.1 мл
;
Вопросы для самоконтроля:
1.
Как приготовить
раствор из вещества в сухом виде (порошок, таблетки)
2.
Как приготовить
рабочий раствор из раствора более высокой концентрации
3.
Как
рассчитать концентрацию полученного рабочего раствора
4.
Какие
растворы используются для разведения антибиотиков? Какой концентрации?
5.
При
произвольном (практическом, рабочем) разведении использовать ___ мл раствора
антибиотика на одного пациента на 1 инъекцию
Литература
Основные
источники:
1. Математика:
алгебра и начала математического анализа, геометрия. Алгебра и начала
математического анализа. 11 класс: учебник / С.М. Никольский, М.К. Потапов,
Н.Н. Решетников, А.В. Шевкин. – М.: Просвещение, 2014. – 464 с.
2. Математика:
учебник для учащихся сред. проф. Образования / А.Г. Луканкин. – М.:
ГЭОТАР-Медиа, 2012. – 320 с.
3. Математика:
учебник для учреждений нач. и сред. проф. Образования / М.И. Башмаков. – 5-е
изд. испр. – М.: Издательский центр «Академия», 2012. – 256 с.
4. Математика
для медицинских колледжей.-Изд.4-е.-Ростов н/Д:Феникс,2015.-442 с.(Среднее
медицинское образование)
Дополнительные
источники:
1.
Математика
: компьютерные технологии в медицине : учебник / В.П. Омельченко, А.А.
Демидова. – Ростов н/Д : Феникс, 2012. – 588 с.
ИНСТРУКЦИЯ
ПРОВЕДЕНИЯ
ПРАКТИЧЕСКОГОЗАНЯТИЯ № 1
ТЕМА: Определение
процента, объема и концентрации препаратов
ОСНАЩЕНИЕ: Таблица «Проценты», уч.пособие
«Математика для мед.колледж.», индивидуальные карточки
ЦЕЛИ:
Знать: определение процента,
пропорции; правила работы с метрическими единицами; основные способы расчета
концентрации (приготовления) рабочих растворов.
Уметь: применять математические
знания в практической работе;
ХОД ПРОВЕДЕНИЯ:
1. ВЫЧИСЛЕНИЕ ОБЪЕМА
ЛЕКАРСТВЕННОГО ВЕЩЕСТВА (ДОЗИРОВКА):
|
Мера длины: 1 м = 10 дм 1 м = 100 см 1 м = 1 000 мм |
Мера веса: 1 г = 1 000 мг 1 г = 1 000 000 мкг |
Мера объема: 1 л = 1 000 мл 1 л = 1 000 000 мкл |
Задачи:
1. Пациенту назначен препарат
в дозе 600 мг на прием. Препарат расфасован по 1 грамму. Сколько грамм нужно
дать пациенту?
2. Пациент должен
принимать лекарство в растворе по одной чайной ложке 2 раза в день в течение 10
дней. Какое количество лекарственного раствора ему назначит врач? Объем чайной
ложки =5 мл.
3. Таблетка содержит 0,5 мг
активного вещества. Назначение врача 0,125 мг. Сколько таблеток
необходимо дать пациенту?
2.
ВЫЧИСЛЕНИЕ
КОНЦЕНТРАЦИИ РАСТВОРА
Запомните!
Задачи:
1. Сколько грамм сухой глюкозы
содержится в 1л 5% раствора глюкозы?
2. Приготовить 3л 3% раствора соды.
3. Приготовить 2 литра 1,5 % раствора
гипохлорида кальция из 5 % раствора.
3.
ЗАДАЧИ
НА РАЗВЕДЕНИЕ АНТИБИОТИКОВ
Внимание! Некоторые препараты
дозируются, например, не в граммах, а в ЕД или МЕ.
В ЕД (единицах действия) измеряются
антибиотики, инсулин, нистатин. Причем, на флаконе антибиотика могут быть
указаны граммы или миллиграммы, или ЕД.
МЕ (международная
единица) — это единица
измерения количества вещества, основанная на биологической активности.
Используется для витаминов, гормонов, вакцин, составляющих крови.
Задачи:
Во флаконе 1 000 000ЕД
пенициллина. Для разведения использовали 10 мл раствора новокаина. Назначение
врача: необходимо сделать инъекцию 90 000 ЕД
Вычислить: Сколько мл
раствора вы набираете в шприц для инъекции?
Сколько остается во флаконе
ЕД антибиотика?
Сколько остается во флаконе
мл раствора антибиотика?
4.
РЕШЕНИЕ ИНДИВИДУАЛЬНЫХ КАРТОЧЕК