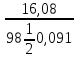Растворы Примеры решения задач
Задача
1. Определите молярность, нормальность
и мольную долю 16,08% раствора H2SO4
(
=1,1 г/см3).
РЕШЕНИЕ.
Молярная концентрация (молярность)
определяется по формуле
гдеm=16,08г
— масса H2SO4,
содержащаяся в 100г раствора
(из определения
массовой доли).
Объем
100г р-ра V
=


0,091л.
Следовательно,
Cм
=
=1,8 моль/л
Нормальность
рассчитывается по формуле Сн
=

= 2
(кислота
двухосновная), таким образом. Сн
=
= 3,6 моль/л.
Зная
молярную концентрацию и фактор
эквивалентности fэкв=
нормальную концентрацию можно рассчитать
и по формуле
Сн
=
=
166
Мольная
доля определяется по формуле



=
100 – 16,08 = 83,92 г.

моль.
Таким
образом,

Задача
2. Сколько миллилитров 60% раствора
СН3СООН
(
=1,07 г/см3)
потребуется для приготовления 200 мл
0,1М раствора.
РЕШЕНИЕ.
Масса уксусной кислоты в 200 мл (0,2л) 0,1М
раствора СН3СООН
рассчитывается по формуле m
= CMMV
=
0,1моль/л∙60г/моль∙0,2л =1,2г
(М =
60 г/моль). Масса 60% раствора, в котором
содержится
1,2г
СН3СООН,
определяется из формулы, ω,% =

=
2г. Таким образом, необходимый объем 60%
раствора кислоты V=
=

Задача
3. В каком соотношении надо смешать
растворы 12% и 3% азотной кислоты для
получения 10% раствора?
РЕШЕНИЕ.
Для решения задачи воспользуемся
правилом креста.
12
10 — 3 = 7
10
3
12 — 10 = 2
Значит,
для получения 10% раствора азотной
кислоты необходимо смешать 7
частей (масс) 12% раствора и 2 части (массы)
3%.
Задача
4.
Рассчитать концентрацию ионов
водорода в растворе HCN
(См
= 10-3 М
), если
= 4,2∙10-3.
РЕШЕНИЕ.
Диссоциация
цианистоводородной кислоты протекает
по уравнению HCN
↔ H+
+ CN—;
концентрации ионов [H+]
и [CN—]
в растворе равны между собой (
так как Н+
: СN—
= 1:1,
где
— стехиометрические
коэффициенты) т.е. [H+]
= [CN—]
=
Cм,
моль/л; Тогда [H+]
= [CN—]
= 4,2∙10-3∙
10-3 =
4,210-7
моль/л.
Задача
5. Рассчитать
концентрацию ионов водорода и
гидроксид-ионов в рстворе NH4OH,
концентрацией См=
0,01М, если Кд
= 1,810-5.
РЕШЕНИЕ.:
Гидроксид
аммония диссоциирует следующим образом:
NH4OH
↔ NH4+
+ OH—,
константа диссоциации имеет вид
167
Кд
=
концентрации
ионов аммония [NН4+]
и гидроксида [OH—]
совпадают
(
(NH4+)
:
(OH—)
= 1:1), обозначим их за х:
[NH4+]
= [OH—]
= х моль/л
, тогда
выражение для Кд
примет вид
1,810-5
= х2/
0,01-х.
Считая, что х
<< См,
решаем уравнение
1,810-5=x2/
0,01, относительно х:
х
=

[OH—]=
4,2∙10-4
моль/л.
Концентрации
ионов водорода и гидроксида связаны
через ионное произведение воды Кw=
[H+][OH—]
=10-14,
выразим концентрацию ионов водорода
[H+]
= Kw/[OH—]
и рассчитаем её значение:
[H+]=110-14/4,210-4
=
2,310-11моль/л.
Задача 6. Определить
рН раствора НСl
(
=1), если См
=2∙10-3
М.
РЕШЕНИЕ.
Диссоциация
соляной кислоты протекает по уравнению
HCl
H+
+ Cl—,
концентрация ионов водорода [H+]
=
Cм
=1∙2∙10-3
= =2∙10-3
моль/л. Водородный показатель рН = —
lg[H+]
= — lg2∙10-3
= 2,7.
Задача
7.
Определить молярную концентрацию
гидроксида аммония, если рН=11, а
Кд=1,8∙10-5.
РЕШЕНИЕ.
Концентрация ионов водорода
[H+]=10—pH=10-11моль/л.
Из ионного произведения воды определяем
концентрацию [OH—]
[OH—]
= Kw
/
[H+]=10-14/10-11
=10-3моль/л.
Гидроксид
аммония — слабое основание и характеризуется
уравнением реакции диссоциации NH4OH
↔ NH4+
+ OH—.
Выражение для константы диссоциации
Кд
=
из
закона Оствальда следует, что [NH4+
] = [OH—]
= ∙Cм,
а Кд
= 2См.
Объединяя уравнения, получим См=[OH—]2/Kд
= 10-6/
1.8∙10-5
= 0,056 моль/л.
Задача
8. Концентрация насыщенного раствора
(См)
Mg(OH)2
равна 1,1•10-4
моль/л. Записать выражение для ПР
и
вычислить его величину.
РЕШЕНИЕ.
В насыщенном
растворе Mg(OH)2
устанавливается равновесие между
осадком и раствором Mg(OH)2
↔ Mg2++2OH—,
для которого выражение ПР имеет вид
ПР =
[Mg2+][OH—]2.
158
Зная
концентрации ионов, можно найти его
численное значение. Учитывая полную
диссоциацию Mg(OH)2,
концентрация
его насыщенного
раствора
См
= [Mg2+]=
1,110-4
моль/л, а [OH—]
= 2[Mg2+]
= 2,210-4
моль/л.
Следовательно, ПР= [Mg2+][OH—]2
=1,1. 10-4
(2,2 10-4)2
= 5,3. 10-12.
168
Задача
9. Вычислить
концентрацию насыщенного раствора и
ПР хромата серебра, если в 0,5 л воды
растворяется 0,011 г соли.
РЕШЕНИЕ.
Для определения
молярной концентрации насыщенного
раствора Ag2CrO4
воспользуемся
формулой

где m—
масса растворенного вещества (г), М-
молярная масса ( г/моль), V
— объем раствора (л). М(Ag2CrO4)
=332 г/моль.
См
=

моль/л. Растворение хромата серебра (I)
сопровождается полной (=1)
диссоциацией соли:
Ag2CrO4
↔
2Ag++
CrO42-
ПР=[Ag+]2[CrO42-],
где
[CrO42-]
= См
= 9,48.10-5
моль/л, а [Ag+]
= 2 См
=1,896
10-4
моль/л .
Таким образом, ПР = (1,896
10-4)2
(9,48 10-5)
= 3,4 10-12.
Задача
10.
Можно ли приготовить растворы соли
СаСО3
с концентрациями СаСО3
С1
=10-2
М и С2 =
10-6
М , если ПР СаСО3
= 3,8
10-9.
РЕШЕНИЕ.
Зная
величину ПР, можно рассчитать
концентрацию насыщенного раствора
соли и, сравнив ее с предлагаемыми
концентрациями, сделать вывод о
возможности или невозможности
приготовления растворов. Растворение
карбоната кальция протекает по схеме
CaCO3
↔ Ca2+
+CO32-
В данном
уравнении n
= m
= 1, тогда

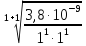
6,2•10-5моль/л
,
С1>
См
– раствор приготовить нельзя, так как
будет выпадать осадок;
С2<
См
– раствор
приготовить можно.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Растворы – это однородные гомогенные системы, состоящие из частиц растворенного вещества, растворителя и продуктов их взаимодействия. Растворенное вещество равномерно распределено в растворителе. Раствор может состоять из двух и более компонентов.
Растворы бывают жидкие, твердые и газообразные.
Растворитель – это то вещество, которое не изменяет агрегатное состояние при растворении. В случае смешения веществ с одинаковым агрегатным состоянием (жидкость-жидкость, газ-газ, твердое-твердое) растворителем считается тот компонент, содержание которого больше.
Образование раствора зависит от характера взаимодействия частиц растворителя и растворенного вещества, и их природы.
В школьном курсе рассматриваются преимущественно растворы электролитов. В курсе ВУЗов рассматриваются также истинные и коллоидные растворы, золи и другие системы.
По способности растворяться вещества условно делят на:
- малорастворимые (от 0,001 до 1 грамма растворенного вещества на 100 грамм растворителя);
- растворимые (больше 1 г растворенного вещества на 100 г растворителя);
- нерастворимые (менее 0,001 г растворенного вещества на 100 г растворителя).
Обратите внимание!
При попадании в воду вещество может:
- раствориться в воде, то есть перемешаться с ней на атомно-молекулярном уровне;
- химически прореагировать с водой;
- не раствориться в воде и химически не прореагировать.
Коэффициент растворимости – отношение массы растворенного вещества к массе растворителя (например, 10 г соли на 100 г воды).
По концентрации растворенного вещества растворы делят на:
Ненасыщенные растворы – это растворы, в которых концентрация растворенного вещества меньше, чем в соответствующем насыщенном растворе, и в котором при данных условиях можно растворить еще некоторое количества растворенного вещества.
Насыщенные растворы – это растворы, в которых достигнута максимальная концентрация растворенного вещества при данных условиях. Насыщенный раствор можно приготовить даже в бытовых условиях – например, раствор поваренной соли в воде. Если в стакан воды постепенно добавлять соль, рано или поздно соль перестанет растворяться. Это и будет насыщенный раствор.
Пересыщенный раствор – это раствор, в котором концентрация растворенного вещества больше, чем в насыщенном. Избыток растворенного вещества легко выпадает в осадок. Приготовить пересыщенный раствор можно, например, с помощью охлаждения насыщенного раствора поваренной соли. При понижении температуры растворимость поваренной соли уменьшается, и раствор становится пересыщенным.
По концентрации растворенного вещества растворы также разделяют на концентрированные и разбавленные:
Концентрированные растворы – это растворы с относительно высоким содержанием растворенного вещества.
Разбавленные растворы – это растворы с относительно низким содержанием растворенного вещества.
Это деление очень условно, и не связано с делением раствора по насыщенности. Разбавленный раствор может быть насыщенным, а концентрированный раствор не всегда может оказаться насыщенным.
Физические величины, характеризующие состав раствора – это массовая доля, массовый процент, молярность (молярная концентрация), мольная доля, мольный процент, мольное соотношение, растворимость (для насыщенных растворов), объемная доля, объемный процент и некоторые другие величины, которые проходятся в курсе ВУЗов (нормальность или нормальная концентрация, моляльность, титр).
Остановимся подробнее на каждой из них:
1. Массовая доля, масс. доли — это отношение массы растворенного вещества mр.в. к массе раствора mр-ра, выраженное в долях от единицы. Долю можно также выразить в процентах, умножив на 100, тогда мы получим массовый процент, масс. %.
ω = mр.в. / mр-ра
Задачи на материальный баланс с использованием массовой доли — обязательный компонент экзаменов по химии (и не только!) разных уровней. Научиться решать задачи на массовую долю и материальный баланс (смешение, разбавление, концентрирование и приготовление растворов) можно здесь!
2. Молярная концентрация (молярность), моль/л, М – это отношение количества растворенного вещества ν, моль к объему всего раствора Vр-ра, л. Концентрация 1 моль растворенного вещества на 1 литр раствора также обозначается так: 1 М. Такой раствор называют «одномолярный». Двухмолярный раствор — 2 М соответствует концентрации 2 моль растворенного вещества на 1 литр раствора и т.д.
Cm = νр.в. / Vр-ра
Задачи на молярную концентрацию, как правило, встречаются в курсе ВУЗов, в химических олимпиадах и вступительных экзаменах в ВУЗы. Научиться решать задачи на молярную концентрацию можно здесь.
3. Мольная доля, мольн. дол. – это отношение количества растворенного вещества νр.в., моль к общему количеству вещества всех компонентов в растворе νр-ра, моль:
φ = νр.в. / νр-ра
Мольная доля также может быть выражена в мольных процентах (% мольн.), если умножить долю на 100%. Задачи на мольную долю встречаются в курсе ВУЗов, олимпиадах и вступительных экзаменах. Научиться решать задачи на мольную долю можно здесь.
4. Объемная доля, объемн. дол. – это отношение объема растворенного вещества Vр.в., л к общему объему раствора или смеси Vр-ра, л:
φ = Vр.в./ Vр-ра
Объемная доля также может быть выражена в объемных процентах (% объемн.), если умножить долю на 100%. Задачи на объемную долю, как правило, сводятся к решению задач на мольную долю, т.к. для газовых смесей объемные и мольные доли компонентов в смеси равны.
5. Мольное соотношение – это отношение количества растворенного вещества к количеству вещества растворителя. Также может использоваться массовое соотношение и объемное соотношение.
6. Растворимость – это отношение массы растворенного вещества к массе растворителя (применяется, как правило, для насыщенных растворов).
7. Титр, г/мл – это отношение массы растворенного вещества mр.в., г к объему раствора, выраженному в миллилитрах Vр-ра, мл:
T = mр.в. / Vр-ра
8. Моляльность.
9. Нормальная концентрация (нормальность)
По механизму растворения растворы делят на физические и химические.
Физическое растворение — это растворение, при котором происходит разрыв и образование только межмолекулярных связей (включая водородные). Физически растворяются только некоторые вещества с молекулярной кристаллической решеткой. Например, растворение нафталина в спирте и воде — опыт.
Химическое растворение — это растворение, при котором разрушаются химические связи в веществе. Химическое растворение, как правило, сопровождается электролитической диссоциацией растворяемого вещества. Подробнее про электролитическую диссоциацию и химическое растворение здесь.
Важно! Подобное хорошо растворяется в подобном. Неполярные растворители хорошо растворяют неполярные вещества. Полярные растворители хорошо растворяют полярные вещества. Понимание механизмов растворения, природы растворяемого вещества и растворителя позволяет легко определить растворимость одного вещества в другом.
…
Существует множество способов измерить концентрацию раствора. Это так называемые способы выражения концентрации раствора.
Концентрация раствора — это количество вещества, находящегося в единице объема или массы раствора.
Что такое раствор
Среди окружающих нас веществ, лишь немногие представляют собой чистые вещества. Большинство являются смесями, состоящими из нескольких компонентов, которые могут находиться в одном или различных фазовых состояниях.
Смеси, имеющие однородный состав являются гомогенными, неоднородный состав – гетерогенными.
Иначе, гомогенные смеси, называют растворами, в которых одно вещество полностью растворяется в другом (растворителе). Растворитель – это тот компонент раствора, который при образовании раствора сохраняет свое фазовое состояние. Он обычно находится в наибольшем количестве.
Существуют растворы газовые, жидкие и твердые. Но более всего распространены жидкие растворы, поэтому, в данном разделе, именно на них мы сосредоточим свое внимание.
Концентрацию раствора можно охарактеризовать как:
- качественную
- количественную.
Качественная концентрация характеризуется такими понятиями, как разбавленный и концентрированный раствор.
С этой точки зрения растворы можно классифицировать на:
- Насыщенные – растворы с максимально возможным количеством растворенного вещества. Количество растворяемого вещества, необходимое для получения насыщенного раствора определяет растворимость этого вещества.
- Ненасыщенные – любые растворы, которые все еще могут растворять введенное вещество.
- Пересыщенные – растворы, в которых растворено больше вещества, чем максимально возможное. Такие растворы очень нестабильны и в определенных условиях растворенное вещество будет выкристаллизовываться из него, до тех пор, пока не образуется насыщенный раствор.
Количественная концентрация выражается через молярную, нормальную (молярную концентрацию эквивалента), процентную, моляльную концентрации, титр и мольную долю.
Способы выражения концентрации растворов
Молярная концентрация растворов (молярность)
Наиболее распространенный способ выражения концентрации растворов – молярная концентрация или молярность. Она определяется как количество молей n растворенного вещества в одном литре раствора V. Единица измерения молярной концентрации моль/л или моль ·л-1:
См = n/V
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным — растворено 0,01 моля вещества, миллимолярным — растворено 0,001 моля вещества.
Термин «молярная концентрация» распространяется на любой вид частиц.
Вместо обозначения единицы измерения — моль/л, возможно такое ее обозначение – М, например, 0,2 М HCl.
Молярная концентрация эквивалента или нормальная концентрация растворов (нормальность).
Понятие эквивалентности мы уже вводили. Напомним, что эквивалент – это условная частица, которая равноценна по химическому действию одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Например, эквивалент KMnO4 в окислительно – восстановительной реакции в кислой среде равен 1/5 (KMnO4).
Еще одно необходимое понятие — фактор эквивалентности – это число, обозначающее, какая доля условной частицы реагирует с 1 ионом водорода в данной кислотоно-основной реакции или с одним электроном в данной окислительно – восстановительной реакции.
Он может быть равен 1 или быть меньше 1. Фактор эквивалентности, например, для KMnO4 в окислительно – восстановительной реакции в кислой среде составляет fэкв(KMnO4) = 1/5.
Следующее понятие – молярная масса эквивалента вещества х. Это масса 1 моля эквивалента этого вещества, равная произведению фактора эквивалентности на молярную массу вещества х:
Мэ = fэкв· М(х)
Молярная концентрация эквивалента (нормальность) определяется числом молярных масс эквивалентов на 1 литр раствора.
Эквивалент определяется в соответствии с типом рассматриваемой реакции. Единица измерения нормальной концентрации такая же как и у молярной концентрации — моль/л или моль·л-1
Сн = nэ/V
Для обозначения нормальной концентрации допускается сокращение «н» вместо «моль/л».
Процентная концентрация раствора или массовая доля
Массовая концентрация показывает сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора.
Это отношение массы m(х) вещества x к общей массе m раствора или смеси веществ:
ω(х) = m(х)/m
Массовую долю выражают в долях от единицы или процентах.
Моляльная концентрация раствора
Моляльная концентрация раствора b(x) показывает количество молей n растворенного вещества х в 1 кг. растворителя m. Единица измерения моляльной концентрации — моль/кг :
b(x) = n(x)/m
Титр раствора
Титр раствора показывает массу растворенного вещества х, содержащуюся в 1 мл. раствора. Единица измерения титра — г/мл:
Т(х) = m(х)/V,
Мольная или молярная доля
Мольная или молярная доля α(х) вещества х в растворе равна отношению количества данного вещества n(х) к общему количеству всех веществ, содержащихся в растворе Σn:
α(х) = n(х)/Σn
Между приведенными способами выражения концентраций существует взаимосвязь, которая позволяет, зная одну единицу измерения концентрации найти (пересчитать) ее в другие единицы. Существуют формулы, позволяющие провести такой пересчет, которые, в случае необходимости, вы сможете найти в сети. В разделе задач показано, как произвести такой пересчет, не зная формул.
Пример перевода процентной концентрации в молярную, нормальную концентрацию, моляльность, титр
Дан раствор объемом 2 л с массовой долей FeSO4 2% и плотностью 1029 кг/м3. Определить молярность, нормальность, моляльность и титр этого раствора раствора.
Решение.
1. Рассчитать молярную массу FeSO4:
M (FeSO4) =
56+32+16·4 = 152 г/моль
2. Рассчитать молярную массу эквивалента:
Мэ = fэкв·
М(FeSO4) = 1/2·152
= 76 г/моль
3. Найдем m раствора объемом 2 л
m = V·ρ = 2·10-3 ·1029
= 2,06 кг
4. Найдем массу 2 % раствора по формуле:
m(FeSO4) = ω(FeSO4) · mр-ра
m(FeSO4) =
0,02·2,06 = 0,0412 кг = 41,2 г
5. Найдем молярность, которая определяется как количество молей растворенного вещества в одном литре раствора:
n = m/М
n = 41,2/152 = 0,27 моль
См = n/V
См = 0,27/2 = 0,135 моль/л
6. Найдем нормальность:
nэ = m/Мэ
nэ = 41,2/76 = 0,54 моль
Сн = nэ/V
Сн = 0,54/2 = 0,27 моль/л
7. Найдем моляльность раствора. Моляльная концентрация равна:
b (x) = n(x)/m
Масса растворителя, т.е.
воды в растворе равна:
mH2O = 2,06-0,0412
= 2,02 кг
b
(FeSO4) = n(FeSO4)/m = 0,27/2,02 = 0,13 моль/кг
8. Найдем титр раствора, который показывает какая масса вещества содержится в 1 мл раствора:
Т(х) = m (х)/V
Т(FeSO4) = m (FeSO4)/V = 41,2/2000 = 0,0021 г/мл
Еще больше задач приведены в разделе Задачи: Концентрация растворов, Правило креста