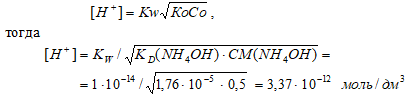pH раствора 4,4. Определить концентрацию ионов водорода в этом растворе.
Решение задачи
Перед решением данной задачи хочу напомнить, водородный показатель (pH) раствора численно равен десятичному логарифму концентрации ионов водорода в этом растворе.
Пусть искомая концентрация . Тогда, учитывая, что pH раствора 4,4, найдем концентрацию ионов водорода в этом растворе:
Таким образом,концентрация ионов водорода в растворе равна 4 ∙ 10-5 моль/л.
Ответ: концентрация ионов водорода = 4 ∙ 10-5 моль/л.
Концентрацию водородных и гидроксильных
ионов часто выражают через
отрицательные логарифмы и обозначают
соответственно рН и рОН. Величину рН
называют водородным показателем, рОН
—гидроксильным:
pH= -lg[H+],pOH= -lg[OH⁻].
Зная концентрацию водородных ионов,
можно определить рН и наоборот. В
нейтральной среде [H+]= 10-7Логарифмируем это уравнение:
lg[H+]
=lg10-7= -7lg10 = -7.
Меняем знаки на обратные:
-lg[H+]
=7;pH= -lg[H+]
=7.
Следовательно, в нейтральной среде
рН=7.
В кислом растворе [H+]>10-7(например 10-2),а рН < 7(в данном примере
рН = 2).В щелочной среде,
[H+] <
10-7(например10-8),
а рН > 7(в данном примере
рН=8).
Логарифмируем уравнение (4),
§ 1:
lg[H+]+lg[OH⁻]
=lg10-14= -14.
Меняем знаки на обратные:
-lg[H+]
-lg[OH⁻]
=14.
Taк кaк -lg[H+]
= pH,—lg[OH⁻]
=pOH, вместо уравнения
(1)можем. записать:
рН + рОН=14 (2)
По известному значению рН или рОН
вычисляют концентрацию ионов водорода.
Пример 1.Вычислить
концентрацию ионов водорода в растворе,
если рН = 6,7.
Решение:
рН = -lg[H+] = 6,7;lg[H+]
= — 6,7 = 7,3;
[H+]
= 210-10
Пример 2. Вычислить концентрацию
водородных и гидроксильных ионов
в растворе, если рОН =
4,34.
Решение:
pH = 14 — 4,34=9,66;lg[H+]
= -9,66= 10,34;
[H+]=
2,2 10-10
Вычислить [OH⁻]
можно двояко:
a) [OH⁻]
=KH2O/[H+]
= 10-14/2,210-10= 4,510-5
мoжно воспользоваться
значением величины рОН:
б) pOH= 4,34;lg[OH⁻]=
-4,34 =5,66;
[OH⁻]
= 4,5•10-5
Так как в нейтральной среде [H+]
= 10-7,в кислой [H+]
> 10-7,а в щелочной [H+]<
10-7,то:
в нейтральной среде рН = 7;
в кислой среде рН< 7;
в щелочной среде рН>7.
Это можно представить в виде схемы:
-
увеличение
кислотностирН
увеличение щелочности
0 1 2 3 4 5 6
7
8 9 10 11 12 13 14
кислая среда
нейтральная среда
щелочная среда
3. Концентрация ионов водорода в водных растворах кислот и щелочей
Концентрация ионов водорода в растворе
одноосновной сильной кислоты.К
сильным кислотам относятся галогеноводородные
(HCl,HBr,HI),,
серная, азотная, хлорная (НСlО4),
хлорноватая (НСlО3)
и другие. Схема диссоциации одноосновной
сильной кислоты:
НА⇄H+
+ А⁻.
Так как сильная кислота в растворе
диссоциирована практически полностью,
активность ионов водорода равна:
аН+
= скисл.
fН
(1)
гдескисл —молярная
концентрация кислоты,fH
— коэффициент активности
иона водорода.
ПриFH
= 1(сильно разбавленный
электролит)
aH+
= [H+] =cкисл.
(2)
Следовательно, в разбавленных растворах
сильных одноосновных кислот концентрация
ионов водорода, выраженная вг-ион/л,равна конценцентрации кислоты вмоль/лили вг-экв/л(для одноосновной
кислоты одно и то же).
Пример. Определить концентрацию ионов
водорода и рН в 0,05н.
растворе HCI.
Решение.
Так как [H+]
=скисл,
аскисл
= 0,05моль/л(по условию), то [H+]
= =0,05=5•10-2;
pH= -lg[H+]
= -lg5 •10-2 =
— (lg5 — 2 1g10) = — lg5+2.
Так какlg 5 ==
0,7,то рН =
2—0,7 =
1,3.
Концентрация ионов водорода в растворе
слабой одноосновной кислоты. Принимаем
следующие обозначения: кислота
—НА, ее концентрация —cкисл,
концентрация ионов водорода и ионов
аниона—соответственно
[H+] и [А⁻],
концентрация недиссоциированных молекул
—[НА], константа диссоциации
—Ккисл.
Уравнение диссоциации кислоты:
НА⇄H++А⁻.
Константа диссоциации:
Ккисл =
[H+][A⁻]/[HA]
Обозначим концентрацию диссоциированных
молекул кислоты черезх. Для
одноосновной кислоты [H+]
= [A⁻]
= х,[HA]
=cкисл—х.В растворе очень слабой кислоты
концентрация диссоциированных молекул
незначительна по сравнению с общей ее
концентрацией; поэтому разность
скисл—х
можно принять равнойскисл.
Тогда, пользуясь уравнением
(3),получим:
Ккисл = х2/скисл
Откуда
(4)
Логарифмируем уравнение (4):
lg[H+]
=½lgKкисл+½скисл
рН = рКкисл
+ рскисл/2
гдe pKкиcл
=—lgKисл;
рскисл= —lgскисл.
Показатель рКкисл— отрицательный
логарифм константы диссоциации слабой
кислоты — называется силовым показателем
кислоты.
Концентрация ионов водорода в растворе
одноосновной кислоты в присутствии её
соли. Уравнение диссоциации слабой
кислоты (НА) и ее соли (МА):
НА⇄ H++ А⁻—
МА⇄M++A⁻
Константа диссоциации кислоты:
Ккисл
= [H+] [А⁻]/[HА]
Концентрация анионов [А⁻]слагается из концентраций анионов
кислоты и анионов соли. Так как концентрация
анионов, образующихся при диссоциации
слабой кислоты, очень мала, то можно ею
пренебречь и концентрацию анионов [А⁻]
принять равной концентрации соли, т. е.
[А⁻]
= ccoли.
Концентрацию недиссоциированных молекул
слабой кислоты можно с достаточной
степенью точности принять равной общей
концентрации кислоты. Следовательно,
[НА] =скисл
Подставив эти значения в уравнение
константы диссоциации кислоты, получим:
Ккисл=[H+]ссоли/скисл
откуда
[H+] =Ккислскисл/ссоли
рН = рКкисл —lgскисл/ссоли
рН = рКкисл+рскисл—рссоли
(7)
Пример.Вычислить концентрацию
ионов водорода и рН раствора. содержащего
в 1л 0,03моляСН3СООН(К= 1,80 ·10-5)и 0,01моля СН3СООNа.
Решение.
Концентрацию ионов водорода определяем
из уравнения:
Ккисл= [H+]ссоли/скисл
Подставляя значение константы диссоциации
уксусной кислоты, ее
концентрации и концентрации ацетата
натрия, получаем:
[H+] = 1,8·10-5
0,03/0,01 =1,8·10-5·3
= 5,4·10-5,
рН = 5- lg5,4 = 5-0,74==4,26,
или
pH=pKкисл‑lg1,8·10-5‑lg(0,03/0,01)
=5-0,26-lg3=5-0,26-0,48-4,26.
Концентрация ионов водорода в растворе
слабой многоосновной кислоты. Двух-
и многоосновные кислоты диссоциируют
в несколько ступеней:
а) Н2А⇄Н++НА⁻(первая ступень),
б) НА ⇄Н+
+А⁻
(вторая ступень).
В растворах двух- и многоосновных кислот
устанавливается, несколько равновесий,
отвечающих различным ступеням диссоциации,
каждая из которых характеризуется своей
константой. Константы диссоциации по
первой и второй ступеням соответственно
равны:
K1иК2называют первой и второй константами
диссоциации кислоты. Например, константы
диссоциации угольной кислоты равны:
Фосфорная кислота имеет три константы
диссоциации:
Как видим, первая константа диссоциации
значительно больше второй, а вторая
больше третьей. При определении
концентрации ионов водорода в растворе
многоосновной кислоты в большинстве
случаев принимают во внимание лишь
первую ступень Диссоциации, если
константа ее не меньшее чем в
1000раз больше константы диссоциации
последующей ступени. Имея в виду первую
ступень диссоциации, все сказанное
относительно одноосновной кислоты
можно применить и для .многоосновных
кислот.
Пример. Имеется 0,025М
раствор H2S.Вычислить концентрацию ионов
водорода [H+],
гидросульфид-ионов [НS—]и
сульфид-ионов [S2⁻]
(KH2S=5,7•10-8;KHS
= 1,2 •10-15)
Решение
Все ионы водорода и гидросульфид-ионы
получены в результате диссоциации
сероводорода только по первой ступени:
H2S
⇆
H+
+HS⁻,
[H2S]
= 0,025; [H+]=
[HS⁻]
= x;
Oтcюдa
KH2S
= x2
/0,025
Ответ: [H+]= [HS⁻]
=3,77•10-7г-ион/л.
Иoны S2⁻
врастворе
сероводорода получаются в результате
диссоциации кислоты по второй ступени:
HS⁻
⇄H+ +
S2⁻.
Так как
[H+]= [HS—]
[S2⁻]
=1,2•10-15
Таким образом, в растворе слабой
двухосновной кислоты концентрация
двузарядного аниона (полученного от
диссоциации по второй ступени) равна
второй, константе диссоциации.
Концентрация, ионов гидроксила и рН
в растворах щелочи.Все сказанное о
вычислении концентрации ионов водорода
в растворах кислот может быть применено
и к вычислению концентрации гидроксильных
ионов в растворах щелочей и слабых
оснований.
Примем следующие обозначения:
основание—МеОН, константа диссоциации
основания —Косн,его концентрация —сосн,
—lgКосн
=рКосн, ‑lgсocн,
рсocн.
В водных растворах щелочи активность
ионов ОН⁻равна:
аОН-=сМеОН•fОН.
При f= 1[OH⁻]
=cосн
Для водных растворов слабого однокислотного
основания концентрация гидроксильных
ионов равна:
откуда:
Для водного раствора слабого основания
в присутствии его соли:
Примеры вычисления концентрации ионов
и рН в водных раствора: щелочей.
1.Вычислить [OH⁻]
и рН в 0,05н. раствореNaOH.
Решение: [ОН⁻]
-cNaOH
= 0,05 = 5•10⁻2
pOH= 2 ‑lg5
= 2 ‑0,70 =l,30,
pH= 14 ‑ 1,3 =
12,7.
2.Вычислить [ОН⁻]
и рН в 0,3н. раствореNH3.
Решение:
pOH= 3 -lg2,3 =
2,64;
рН = 14 — 2,64 =
11,36.
3.Вычислить рОН⁻и рН раствора аммиака, в 1 лкоторого
содержится0,5моляNH3 и 0,1моляNH4Cl.
Решение:
[OH⁻]=KNH3•cNH3
/cNH4Cl= 1,8•10-5•0,5 /0,1 = 9,0• 10-5
рОН = 5—lg9= 5 — 0,95 = 4,05,
рН = 14 — 4,05 = 9,95.
Соседние файлы в папке Razdatochnyy_material
- #
- #
- #
- #
- #
- #
- #
- #
Как правильно рассчитать концентрацию ионов водорода и рН в растворе серной кислоты
Задача 101.
Вычислите [Н+] и рН 0,01 М и 0,05 Н растворов Н2SO4.
Решение:
CM(Н2SO4) = 0,01 М;
CH(Н2SO4) = 0,05 М;
a) Вычисление [Н+] и рН 0,01 М раствора Н2SO4
Так как Н2SO4 двухосновная кислота и является сильным электролитом, то концентрация ионов водорода будет равна удвоенному значению ее молярности.
[Н+] = 2СМ(Н2SO4) = (2 · 0,01) = 2 · 10-2 моль/дм3;
рН = -lg[Н+] = -lg2 · 10-2 = 2 — lg2 = 2 — 0,30 = 1,70.
б) Вычисление [Н+] и рН 0,05 Н раствора Н2SO4
Так как Н2SO4 двухосновная кислота и является сильным электролитом, то концентрация ионов водорода будет равна ее нормальности.
[Н+] = СН(Н2SO4) = (1 · 0,05) = 5 · 10-2 моль/дм3;
рН = -lg[Н+] = -lg5 · 10-2 = 2 — lg5 = 2 — 0,70 = 1,30.
Ответ: а) [Н+] = 2 · 10–2 моль/дм3; рН = 1,70; б) [Н+] = 5 · 10–2 моль/дм3; рН = 1,30.
Задача 102.
Вычислите [Н+] и рН раствора Н2SO4 с массовой долей кислоты 0,5% (р = 1,00 г/см3).
Решение:
М(Н2SO4) = 98 г/моль;
w% = 0,5% или 0,005;
р = 1,00 г/см3.
1. Рассчитаем молярность раствора кислоты
CM(Н2SO4) = (w% · p · 1000)/М(Н2SO4) = (0,005 · 1,00 г/см3 · 1000 cм3)/98 г/моль = 0,05 M.
Так как Н2SO4 двухосновная кислота и является сильным электролитом, то концентрация ионов водорода будет равна удвоенному значению ее молярности.
[Н+] = 2СМ(Н2SO4) = (2 · 0,05) = 1 · 10-1 моль/дм3;
рН = -lg[Н+] = -lg1 · 10-1 = 1 — lg2 = 1 — 0,00 = 1,00.
Ответ: [Н+] = 0,1 моль/дм3;рН = 1,00.
Задача 103.
Вычислите [Н+] и рН 0,5 М раствора гидроксида аммония.
Решение:
КD(NH4OH) = 1,76 · 10–5;
CM(NH4OH) = 0,5 М.
Схема диссоциации NH4OH:
NH4OH ⇔ NН4+ + OH–
Поскольку КD(NH4OH) << CM(NH4OH) так как (1,76 · 10–5) << 0,5, то можно считать, что равновесная концентрация недиссоциированного основания равна его общей концентрации: СМ(NH4OH) = 0,5 моль/дм3.
Для слабых оснований [H+] вычисляют по формуле:
рН = -lg[Н+] = -lg3,37 · 10-12 = 12 — lg3,37 = 12 — 0,53 = 11,47.
Ответ: [Н+] = 3,37 · 10–12 моль/дм3;рН = 11,47.
Hydrogen ion concentration tells us how acidic or basic any given solution is. More hydrogen ions? More acidic. Fewer hydrogen ions? More basic. Pretty simple, right? Let’s take a look at how to define and calculate hydrogen ion concentration. First, you’ll see how you get hydrogen ions and hydroxide ions in water.
Self-Ionization of Water
Water self-ionizes to a small extent:
This is a simplification, as free hydrogen ions don’t actually exist in solution. This is what it actually looks like:
Through hydrogen bonding, the hydrogen ion associates with a water molecule to create H3O+, or hydronium. Thus when you calculate the hydrogen ion concentration, you are also calculating the hydronium ion concentration.
For water, the water ion product or Kw tells us the concentration of H+ or H3O+ and the concentration of OH— or hydroxide ions.
At 25 degrees Celsius, the experimentally determined value of KW is 1.0 x 10-14 M2.
Let’s take a look at how you can use your knowledge of dissociation and KW to calculate the hydrogen ion concentration for either strong acids or bases.
Calculating the Hydrogen Ion Concentration From Molarity of a Strong Acid
A strong acid increases the hydrogen ion concentration over hydroxide ions present.
An example is HCl:
Since HCl is a strong acid, it dissociates completely in water. So, let’s say that you have a 1.5M HCl solution. What is the hydrogen ion concentration?
Well, this is pretty simple and doesn’t even require any math! Since the acid dissociates completely the hydrogen ion concentration is the same as the molarity of the solution. In this case that means the concentration of hydrogen ions, or [H+], is 1.5M.
A strong base, on the other hand, has more hydroxide ions than hydrogen ions. Let’s say that you have a 0.1M solution of NaOH. What is the concentration of H+ in this case? Now, you’re going to need to use your knowledge of KW.
You know that since this strong base dissociates completely, the hydroxide, or OH-, concentration is equal to the molarity of the solution. [OH-] = 0.1 M.
So,
Solving for [H+] you get:
This makes sense! Since it is a basic solution there are way more hydroxide ions than there are hydrogen ions.
Calculating the Hydrogen Ion Concentration From pH
Now, dealing with scientific notation all the time to discuss hydrogen ion concentration is a little cumbersome. Instead, scientists use the pH scale.
Here is the definition of pH:
pH is the negative log of the hydrogen concentration. The letter p literally means negative log.
So, given a pH value of 5.5 you can find the hydrogen ion concentration:
Diving by negative one and taking the inverse log gives you:
Solving, you get:
The hydrogen ion concentration of a solution with pH = 5.5 is 3.2*10-6M. See, this is why talking about a pH is much easier than the whole long number you got for an answer! A pH of 5.5 tells you about acidity, and you can calculate the molarity if you need it.
What Do pKa Values Mean?
While calculating the concentration of hydrogen ions of strong acids is easy enough since they dissociate completely in solution, calculating the concentration of hydrogen ions in weak acids is just a little trickier. These acids do not completely ionize in water. Each acid has a tendency to lose a hydrogen ion in an aqueous solution. A stronger acid is more likely to lose its hydrogen ion than a weak acid.
Equilibrium constants for ionization reactions are calls acid dissociation constants (Ka). Stronger acids have a higher Ka while weaker acids have a lower Ka. Now, just as with hydrogen ion concentration, where you made the switch to pH instead of just H, scientists use pKa to indicate how strong or weak an acid is. With a higher tendency to lose a proton, the acid is stronger, and so the pKa is smaller.
Tips
-
The higher a pKa value, the weaker the acid; the lower the pKa value the stronger the acid.


 увеличение
увеличение