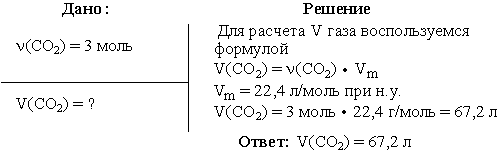4.3.3. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ.
На данный момент задачи по этой теме кодификатора идут в КИМе ЕГЭ под номером 29.
Для их решения можно воспользоваться следующим алгоритмом:
1) записать уравнение реакции, о которой идет речь в задаче, и убедиться в правильности расставленных коэффициентов;
2) рассчитать количество молей вещества, масса или объем которого указаны в условии.
Если указана масса некого вещества A, то расчет количества вещества для него следует вести по формуле:
где mA – масса вещества А, а MA – молярная масса вещества А.
Если указан объем газообразного вещества А:
где VA – объем газообразного вещества А, а Vm – молярный объем, одинаковый для всех газов и при н.у. равный 22,4 л/моль.
Иногда вместо массы или объема вещества дается его количество вещества (моль). В таком случае действия по его нахождению не требуются.
3) далее от молей вещества А нужно перейти к молям вещества, массу или объем которого спрашивают в условии.
Допустим спрашивают объем или массу вещества B. Тогда для перехода от количества моль вещества А к количеству моль вещества B следует пользоваться тем правилом, что для любого вещества его количество, деленное на его коэффициент, в уравнении реакции одно и то же. Т.е. количества веществ А и В связаны друг с другом через коэффициенты в уравнении следующим образом:
где n(A) и n(B) – количества вещества А и В соответственно, а k(A) и k(B) – коэффициенты в уравнении перед этими веществами.
Из этого выражения следует, что количество вещества В равно:
4) далее, зная количество вещества B, мы можем найти его массу по формуле:
Если же вещество B является газом и спрашивают его объем, то рассчитать его можно следующим образом:
В общем, последовательность решения таких задач можно изобразить следующей схемой:
1) Зная массу или объем вещества A, рассчитываем его количество вещества.
2) Зная количество вещества A, рассчитываем количество вещества B по формуле:
где n(A) и n(B) – количества веществ А и В соответственно, а k(A) и k(B) – коэффициенты в уравнении перед этими веществами.
3) В зависимости от того, требуется найти массу вещества В или объем газа В, умножаем его количество либо на молярную массу, либо на молярный объем газа:
Пример
Какая масса сульфида алюминия потребуется для того, чтобы в результате его взаимодействия с избытком соляной кислоты образовался газ объемом 33,6 л (н.у.).
Решение:
1) Запишем уравнение реакции:
2) Рассчитываем количество вещества, для которого известна его масса или объем (в случае газа). Нам известен объем сероводорода, рассчитаем его количество вещества:
3) Отношение количества вещества любого фигуранта реакции к его коэффициенту в уравнении этой реакции всегда одно и то же. Т.е. для сульфида алюминия и сероводорода мы можем записать, что:
где k(Al2S3) и k(H2S) – коэффициенты перед Al2S3 и H2S соответственно.
Из этого выражения выразим n(Al2S3):
Подставим известные значения n(H2S) и коэффициентов перед H2S и Al2S3:
Тогда масса сульфида алюминия будет равна:
Задачи с реальных экзаменов ЕГЭ на тему «Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ» можно порешать здесь.
Молярный объём
Vm
— это отношение объёма данной порции вещества к его количеству.
Численно молярный объём равен объёму (1) моль вещества.
Обрати внимание!
Молярный объём любого газа при нормальных условиях (давлении (101,3) кПа и температуре (0) °С) равен (22,4) дм³/моль.
Вычисление объёма газа по его количеству
Преобразуем формулу молярного объёма — выразим из неё
V
:
— объём газа равен произведению его количества на молярный объём.
Пример:
вычисли объём (н. у.) метана количеством (1,5) моль.
дм³.
Вычисление количества газа по его объёму
Выразим из формулы молярного объёма
n
:
— количество газа можно вычислить, если его объём разделить на молярный объём.
Пример:
вычисли количество водорода, соответствующее при н. у. его объёму (11,2) дм³.
моль.
Сдан ЕГЭ по химии 2020 и как показывают отклики учащихся, родителей, учителей и репетиторов, большинство не справилось с заданиями. Возможно, полагали, что задачи будут похожи на тренировочные и демонстрационные версии с сайта ФИПИ, либо сыграли роль излишняя самонадеянность и отсутствие должной подготовки. В любом случае мы постараемся с вами разобрать все задачи программы, а также в каждой статье помимо стандартных тренировочных попробуем решать одно-два олимпиадных задания. Такой подход поможет лучше подготовиться к экзамену и абсолютно спокойно набрать высокий балл. Поехали!
В прошлой статье мы рассматривали с вами 27 задание, задачи с использованием понятий массовой доли вещества в растворе, растворимостью. Сегодня обратимся к 29 заданию егэ по химии и прорешаем как самые примитивные задачи так повышенной сложности.
В соответствии с формулировкой Спецификации ФИПИ 29 задание — это «Расчёты массы вещества или объема газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ.»
Давайте вспомним что такое моль, масса, объем.
Одна из основных формул химии связывает массу любого вещества (m) с количеством вещества (ν) и его молярной массой (M). Математическое выражение этой зависимости позволяет определять любую из перечисленных величин при известных двух других:
m= ν*M ν=m/M, M=m/ ν
Поскольку 1 моль любого вещества, независимо от его агрегатного состояния (твёрдое, жидкое, газообразное), содержит 6,02*1023 молекул, количество вещества может быть также определено по формуле ν= N/NA
Где N –общее число молекул вещества, NA – число Авогадро
Таким образом, при составлении формул может быть получена зависимость:
m/M=N/NA , m= M* N/NA , M= m( NA/ N), N= (m/M)* NA
Давайте попробуем применить эти формулы на практике:
Задача № 1
Какое число молей составляет 102 кг оксида алюминия, 51 г оксида алюминия, 53 кг кальцинированной соды и 42 кг питьевой?
Решение:
Кальцинированная сода – это карбонат натрия. А питьевая сода – гидрокарбонат натрия. Запишем молярные массы всех исходных веществ:
М (Al2O3) =27*2+16*3=102 г/моль
M(Na2CO3) = 23*2+12+16*3= 106 г/моль
M(NaHCO3) = 23+1+12+16*3 =84 г/моль
ν (Al2O3) =102*103 г/102 г/моль= 1000 моль
ν (Al2O3) = 51 г/102 г/моль =0,5 моль
ν (Na2CO3) = 53103 г/106 г/моль=500 моль
ν (NaHCO3) =42*103 г/84 г/моль=500 моль
Задача № 2
Кристаллическая сода содержит 63% воды. Сколько молей воды приходится на 1 моль безводной соды?
Решение:
Массовая доля карбоната натрия в кристаллической соде: ω ((Na2CO3)=100-63=37%.
M (Na2CO3) = 23*2+12+16*3= 106 г/моль, M (H2O) =18 г/моль.
В общем виде можно записать формулу кристаллической соды x Na2CO3*y H2O.
х*106 от общей массы кристаллической соды составляет 37%
у*18 – 63%
106х/18у=37/63
Откуда
у/х= 63*106/37*18=10:1
ν (H2O): ν (Na2CO3)=10:1 (молекулярная формула кристаллической соды Na2CO3*10H2O
Рассмотрим теперь газообразные состояния веществ при нормальных условиях и условиях, отличающихся от нормальных.
Нормальными условиями считаются:
Давление (р0)= 1 атм=760 мм.рт.ст=101,3 кПа
Температура t0 – 00 С (Т0=273,15 К)
При нормальных условиях (н.у) 1 моль любого газа занимает объем, равный 22, 4 л (следствие из закона Авогадро):
Vm=22,4 л/моль.
Объем газа количеством один моль при нормальных условиях называют молярным объемом. Молярный объем определяется как отношение объема газа в литрах к его количеству в молях
Для газообразного состояния ν=V/ Vm
Молярная масса и молярный объем данного газа связаны соотношением
M=Vm*ρ, M –молярная масса, Vm – молярный объем, ρ – плотность газа.
Выведем еще одно следствие из закона Авогадро. Пусть при одинаковых условиях1 моль газа Х и один моль газа У. Плотности этих газов соответствуют ρ (X)=m(X)/V(X), ρ (Y)=m(Y)/V(Y), а отношение плотностей газов ρ(X)/ ρ(Y)=m(X)*V(X)/m(Y)*V(Y)
Так как количество каждого из газов составляет 1 моль, их массы численно равны молярным массам, а последние, в свою очередь, численно равны молекулярным массам. Поэтому отношение m(X)/m(Y) можно заменить отношением Мr(X)/Мr(Y). А так как газы находятся при одинаковых условиях, то, согласно закону Авогадро, V(X) =V(Y). Отсюда вытекает, что ρ(X)/ ρ(Y)= Мr(X)/Мr(Y). То есть плотности газов при одинаковых условиях находятся в таком же соотношении, как их молекулярные массы. Иными словами, зная молекулярные массы двух газов, мы можем вычислить плотность одного газа по отношению к другому. Отношение массы определенного объема одного газа к массе такого же объема другого газа при тех же условиях называется относительной плотностью первого газа по второму. Для краткости слово «относительная» обычно опускают и говорят просто: плотность по…»( указывая газ, по отношению к которому вычисляется относительная плотность)
Помните, что закон Авогадро и следствие из него применимы только к газам при невысоких давлениях. При этих условиях расстояния между молекулами газа гораздо больше, чем размеры самих молекул, и объем занимаемый самими молекулами газа составляет лишь небольшую долю от общего объема газа. При повышенных давлениях наблюдаются отклонения от закона Авогадро, тем большие, чем выше давление. Отклонения при высоких давлениях связаны с тем, что расстояния между молекулами делаются сравнимыми по величине с размерами самих молекул.
Для условий, отличающихся от нормальных мы используем уравнение газового состояния Клайперона:
PV/T=const
pV/T=p0V0/T0
p, V,T – давление, объем, температура ( в кельвинах) при заданных условиях;
p0, V0, T0 – то же при нормальных условиях.
Если p0V0/T0 =R , то
pV=RT (уравнение Менделеева – Клайперона)
R- универсальная газовая постоянная.
Уравнение pV=RT актуально для одного моля газообразного вещества. В случае если у нас представлено произвольное число молей, тогда уравнение Менделеева – Клайперона будет иметь вид:
pV= νRT, pV= (m/M)RT
Если p0 = 1 атм, V0 = 22,4 л/моль, T0 = 273 К, то R = 1 атм*22,4 л/моль/273 К = 0,082 л*атм/моль*К
В СИ p0 = 101,3 кПа, V0 = 22,4*10-3м3/моль, T0 = 273 К
R = 101,3 кПа*22,4*10-3м3/моль/273 К =8,31 Па*м3/моль*К=8,31 Дж/моль*К
Задача № 3
Шар, объемом 8 литров при давлении равном 105 Па и температуре 20 градусов по Цельсию поднят в верхние слои атмосферы, где давление составляет 103 Па и температура равна минус 20 градусов по Цельсию. Учитывая, что шар легкорастяжимую оболочку, вычислите его объем при этих условиях.
Решение:
T1=20+273=293 К, Т2= -20+273= 253 К
Пользуясь уравнением Менделеева-Клайперона получаем:
(P1*V1/T1) = (p2V2/T2) отсюда определяем V2= (P1*V1/T1)*(T2/p2)= 105 Па* 8 л* 253 К/293 К*103 Па=690 л
Задача № 4
Относительная плотность паров брома по воздуху равна 5, 37. Какова истинная формула брома?
Решение:
Молекула брома состоит из х атомов брома M(Brx)=D(Brx /M(возд)=5,37*29=156 г/моль; M(Brx)=А(Br)*х. А(Br)=80 г/моль х=156/80=2
Истинная формула брома Br2
Кстати, с понятием относительной плотности мы с вами столкнемся при решении 35 задания егэ по химии, когда будем определять неизвестное органическое вещество опираясь на известные немногочисленные данные из условия задачи. Но об этом мы поговорим уже в следующих статьях.
Итак, количество вещества в химии обозначается греческой буквой «ню».
Помню, как в 9-м классе мой учитель физики Игорь Юрьевич учил меня правильно писать букву «ню». До этого она у меня получалась немного коряво.
Но поскольку на БВ не проходят греческие буквы, я буду обозначать количество вещества латинской буквой v. Латинская v очень похожа на греческую «ню».
Рассмотрим следующие случаи.
1) Если нам известно количество частиц вещества, то количество вещества можно найти по формуле:
v = n/NA
где
v — количество вещества;
n — количество частиц вещества. Это безразмерная величина, то есть это просто число. Правда, это число бывает очень большим, например, 5*(10^24).
NA — постоянная Авогадро. Постоянная Авогадро представляет собой универсальную константу. NA = 6,022*(10^23) моль^(–1).
2) Если нам известна масса вещества, то количество вещества находится по следующей формуле:
v = m/M
где
v — количество вещества;
m — масса вещества;
M — молярная масса вещества находится по химической формуле вещества, при помощи периодической системы Д. И. Менделеева, путём суммирования атомных масс всех входящих в молекулу атомов с учётом имеющихся индексов.
3) Если нам известен объём газообразного вещества, то мы можем найти количество вещества газа по такой формуле:
v = V/Vm
где
v — количество вещества;
V — объём газа;
Vm — молярный объём газов. Молярный объём газов — это универсальная константа. Vm = 22,414 л/моль = 22414 м3/моль.
Повторюсь, что формула v = V/Vm верна только для газов!
Наконец, рассмотрим Ваш случай.
Вам по условию даны объём и объёмная доля.
Я рискну предположить, что у Вас задача примерно такого рода:
«Объём газовой смеси составляет 240 л. Объёмная доля кислорода в смеси равна 45%. Вычислите количество вещества кислорода в смеси».
Такая задача решается в два действия.
1) Находим объём кислорода:
V (O2) = V0 * ф / 100 = 240 л * 45 / 100 = 108 л.
(Ф — это объёмная доля, она обозначается греческой буквой «фи». Вместо неё приходится писать русскую ф).
2) Находим количество вещества кислорода. Кислород — это газ, значит, мы имеем право воспользоваться формулой v = V/Vm.
v (O2) = V/Vm = 108 л : 22,414 л/моль = 4,818 моль. Округление произведено до тысячных.
Вычисление массы и объема газов
Если в условиях задачи указаны вещества в газообразном состоянии, то при вычислениях необходимо использовать газовые законы, связывающие количества и массы веществ с их объемами.
Задача 1. Вычислить объем диоксида углерода при н.у., взятого количеством
вещества 3 моль.
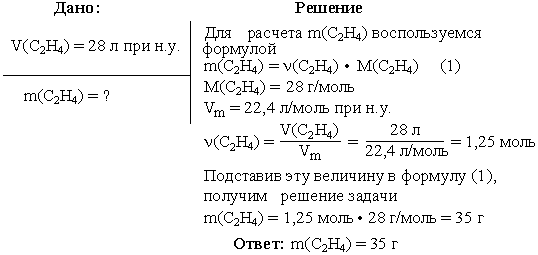
Задача 2. Вычислить массу этилена (C2H4), занимающего при н.у. объем 28 л.
Задача 3. Вычислить объемную долю метана в смеси, состоящей из 30 л
метана, 5 л этана и 2 л водорода. Объемы газов измерены при одинаковых
условиях.
Часто допускается ошибка, когда при проведении расчётов отождествляются величины массовых и объёмных долей вещества.
Чтобы показать ошибочность таких представлений, рассмотрим решение задачи, в которой расчёт объемов газов связан с вычислениями их масс.
Задача 4. Имеется газовая смесь, массовые доли газа в которой равны (%): метана – 65, водорода – 35. Определите объемные доли газов в этой смеси.
Таким образом, числовые значения массовых и объемных долей не совпадают.