Какой объем занимают молекулы газа при нормальных условиях занимают 27 ⋅ 1021 молекул газа?
Решение задачи
Напомню, что молекула – наименьшая частица вещества, обладающая его химическими свойствами.
Учитывая, что 6,02 ∙ 1023 занимают молекулы газа объем 22,4 л (при нормальных условиях), найдем объем, который занимают молекулы газа занимают 27 ⋅ 1021 молекул газа:
6,02 ∙ 1023 занимают молекулы газа объем 22,4 л
27 ⋅ 1021 занимают молекулы газа объем х л
Откуда:
Число 6,02 ∙ 1023 называется постоянной Авогадро и обозначается NA.
Ответ:
объем 1 литр.
Молярный объем газа

4.3
Средняя оценка: 4.3
Всего получено оценок: 503.
4.3
Средняя оценка: 4.3
Всего получено оценок: 503.
Для того, чтобы узнать состав любых газообразных веществ необходимо уметь оперировать такими понятиями, как молярный объем, молярная масса и плотность вещества. В данной статье рассмотрим, что такое молярный объем, и как его вычислить?
Количество вещества
Количественные расчеты проводят с целью, чтобы в реальности осуществить тот или иной процесс или узнать состав и строение определенного вещества. Эти расчеты неудобно производить с абсолютными значениями массы атомов или молекул из-за того, что они очень малы. Относительные атомные массы также в большинстве случаев невозможно использовать, так как они не связаны с общепринятыми мерами массы или объема вещества. Поэтому введено понятие количество вещества, которое обозначается греческой буквой v (ню) или n. Количество вещества пропорционально числу содержащихся в веществе структурных единиц (молекул, атомных частиц).
Единицей количества вещества является моль.
моль – это такое количество вещества, которое содержит столько же структурных единиц, сколько атомов содержится в 12 г изотопа углерода.
Масса 1 атома равна 12 а. е. м., поэтому число атомов в 12 г изотопа углерода равно:
Na= 12г/12*1,66057*10в степени-24г=6,0221*10 в степени 23
Физическая величина Na называется постоянной Авогадро. Один моль любого вещества содержит 6,02*10 в степени 23 частиц.
Молярный объем газа
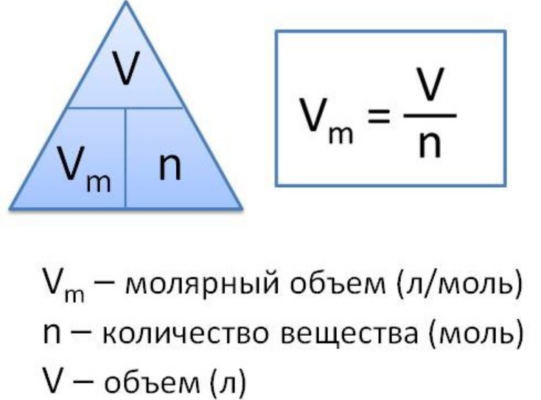
Молярный объем газа – это отношение объема вещества к количеству этого вещества. Эту величину вычисляют при делении молярной массы вещества на его плотность по следующей формуле:
Vm=M/p,
где Vm – молярный объем, М – молярная масса, а p – плотность вещества.
В международной системе Си измерение молярного объема газообразных веществ осуществляется в кубических метрах на моль (м3 /моль)
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа. Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм3 /м.
Таблица «молярный объем газов»
В следующей таблице представлен объем некоторых газов:
| Газ | Молярный объем, л |
| H2 | 22,432 |
| O2 | 22,391 |
| Cl2 | 22,022 |
| CO2 | 22,263 |
| NH3 | 22,065 |
| SO2 | 21,888 |
| Идеальный | 22,41383 |
Что мы узнали?
Молярный объем газа, изучаемый по химии (8 класс) наряду с молярной массой и плотностью являются необходимыми величинами для определения состава того или иного химического вещества. Особенностью молярного газа является то, что в одном моле газа всегда содержится одинаковый объем. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Аэлита Коробка
5/5
-
Александр Котков
5/5
-
Настя Бабич
5/5
-
Александр Котков
5/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 503.
А какая ваша оценка?
Задача №1
Образец: Какой объем занимает 0,2 моль N2 при н.у.?
Дано: н.у.
Vm = 22, 4 л/моль
ν (N2) = 0,2 моль
Найти:
V -?
Решение:
ν (N2) = V (N2)/Vm, следовательно
V (N2) = ν(N2) ·Vm =
= 0,2 моль · 22,4 л/моль = 4,48 л
Ответ: V (N2) = 4,48 л
Решите задачи по приведённому образцу:
1. Какой объем занимают 5 моль О2 при н.у.?
2. Какой объем занимают 2,5 моль Н2 при н.у.?
Задача №2
Образец: Какое количество вещества содержит водород объемом 33,6 л при н.у.?
Дано: н.у.
Vm = 22, 4 л/моль
V (H2) = 33,6 л
Найти:
ν -?
Решение:
ν (Н2) = V(Н2)/Vm = 33,6 л/ 22,4 л/моль = 1,5 моль
Ответ: ν (Н2) = 1,5 моль
Решите задачи по приведённому образцу:
1. Какое количество вещества содержит кислород объемом 0,224 л при н.у.?
2. Какое количество вещества содержит углекислый газ объемом 4,48 л при н.у.?
Задача №3
Образец: Какой объем займут 56 г. газа СО при н.у.?
Дано: н.у.
Vm = 22, 4 л/моль
m (CO) = 56 г
Найти:
V -?
Решение:
ν (CO) = V(CO) / Vm, следовательно
V (CO) = ν (CO) · Vm
Неизвестное количество вещества найдём по формуле:
ν = m/M
M(CO) = Ar(C) + Ar(O) = 12 + 16 = 28 г/моль
ν (СО) = m/M = 56 г / 28 г/моль = 2 моль
V (CO) = ν (CO) · Vm = 2 моль · 22,4 л/моль = 44,8 л
Ответ: V (CO) = 44,8 л
Решите задачи по приведённому образцу:
1. Какой объем займут 8 г. газа О2 при н.у.?
2. Какой объем займут 64 г. газа SО2 при н.у.?
Задача №4
Образец: В каком объёме содержится 3·1023 молекул водорода Н2 при н.у.?
Дано: н.у.
Vm = 22, 4 л/моль
N = 3·1023 молекул
Na = 6,02 ·1023 моль-1
Найти:
V -?
Решение:
ν (Н2) = V(Н2) / Vm, следовательно
V (Н2) = ν (Н2) · Vm
Неизвестное количество вещества найдём по формуле:
ν = N / Na = 3·1023 / 6,02 ·1023 моль-1 = 0,48 моль
V (Н2) = ν (Н2) · Vm = 0,48 моль · 22,4 л/моль = 10,752 л
Ответ: V (Н2) = 10,752 л
Решите задачи по приведённому образцу:
1. В каком объеме содержится 12,04 ·1023 молекул углекислого газа — СО2 при н.у.?
2. В каком объеме содержится 3,01·1023 молекул кислорода — О2 при н.у.?
Дополнительно решите задачи для закрепления:
1. Найдите массу (н.у.): а) 6 л. О3; б) 14 л. газа Н2S?
2. Какой объём водорода при н.у. образуется при взаимодействии 0,23 г натрия с водой?
3. Какова молярная масса газа, если 1 л. его имеет массу 3,17 г.? (Подсказка! m = ρ·V)
Урок посвящен изучению закона Авогадро, который применятся только для газообразных веществ и позволяет сравнивать число молекул в порциях газообразных веществ. Вы узнаете, как на основании данного закона можно сделать вывод о составе молекул газа, познакомитесь с моделями молекул некоторых веществ.
I. Особенности строения веществ в различных агрегатных состояниях
В твердых телах, по сравнению с жидкостями и тем более газами, частицы вещества находятся в тесной взаимосвязи, на небольших расстояниях. В газообразных же веществах расстояния между молекулами настолько велики, что практически исключает взаимодействие между ними.
При отсутствии взаимодействия между молекулами их индивидуальность не проявляется. Значит, можно считать, что между молекулами в любых газах расстояния одинаковые. Но при условии, что эти газы находятся в одинаковых условиях – при одинаковых давлении и температуре.
II. Предположение Авогадро
Раз расстояния между молекулами газов равны, значит, равные объемы газов содержат равное число молекул. Такое предположение высказал в 1811 г. итальянский ученыйАмедео Авогадро.Впоследствии его предположение было доказано и названо законом Авогадро.
III. Модели молекул некоторых газообразных веществ
Свою гипотезу Авогадро использовал для объяснения результатов опытов с газообразными веществами. В процессе рассуждений он смог сделать важные выводы о составе молекул некоторых веществ.
Рассмотрим результаты экспериментов, на основании которых Авогадро смог смоделировать молекулы некоторых веществ.
Вы уже знаете, что при пропускании через воду электрического тока, вода разлагается на два газообразных вещества — водород и кислород.
Опыт по разложению воды проведем в электролизере. При пропускании электрического тока через воду на электродах начнут выделяться газы, которые вытеснят воду из пробирок. Газы получатся чистыми, потому что воздуха в пробирках, заполненных водой, нет. Причем объем выделившегося водорода будет в 2 раза больше, чем объем выделившегося кислорода.
Какой вывод сделал из этого Авогадро? Если объем водорода в два раза больше объема кислорода, значит, молекул водорода образовалось тоже в 2 раза больше. Следовательно, в молекуле воды на два атома водорода приходится один атом кислорода.
Рассмотрим результаты других опытов, которые позволяют сделать предположение о строении молекул веществ. Известно, что при разложении 2 л аммиака образуется 1 л азота и 3 л водорода (Рис. 2).
Отсюда можно сделать вывод, что в молекуле аммиака на один атом азота приходится три атома водорода. Но почему тогда для реакции потребовалось не 1л аммиака, а 2л?
Если воспользоваться моделями молекул водорода и аммиака, которые предложил Д. Дальтон, то получил результат, противоречащий эксперименту, т.к. из 1 атома азота и трех атомов водорода получится только 1 молекула аммиака. Таким образом, по закону Авогадро объем разложившегося аммиака в этом случае будет равен 1 л.
Если же предположить, что каждая молекула водорода и азота состоит из двух атомов, то у модели не будет противоречия с экспериментальным результатом. В этом случае одна молекула азота и три молекулы водорода образуются из двух молекул аммиака.
Рассмотрим результаты еще одного опыта. Известно, что при взаимодействии 1 л кислорода с 2 л водорода образовалось 2 л паров воды (т.к. реакцию проводят при температуре больше 100 С). Какой вывод можно сделать о составе молекул кислорода, водорода и воды?Такое соотношение можно объяснить, если предположить, что молекулы водорода и кислорода состоят из двух атомов:
Из двух молекул водорода и 1 молекулы кислорода образуется 2 молекулы воды.
IV. Закон Авогадро и его следствия
В равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Cледствия из закона Авогадро:
1 следствие:
Одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объём.
Так, 6,02 ∙ 1023 молекул (1 моль) любого газа и любой смеси газов при (н.у.) занимает объём равный 22,4 л.
Такой объём называется молярным объёмом и обозначается Vm
Молярный объём – это постоянная величина для веществ – газов при нормальных условиях (н.у.):
Vm = 22,4 л/моль
н.у. – это
p = 1амт (101325 Па)
t = 0 ˚C (273 К)
Взаимосвязь молярной массы, молярного объёма, числа Авогадро и количества вещества:
υ = V / Vm = N / Na = m / M
M = ρVm
V. Решение задач
Задача №1 (образец)
Какой объем занимает 0,2 моль N2 при н.у.?
|
Дано: н.у. Vm = 22, 4 л/моль ν (N2) = 0,2 моль |
Решение: ν (N2) = V(N2 ) / Vm , следовательно V (N2 ) = ν (N2) · Vm = 0,2 моль · 22,4 л / моль = 4,48 л Ответ: V (N2 ) = 4,48 л |
|
Найти: V — ? |
Задачи для самостоятельного решения
Решите задачи по приведённому образцу:
1. Какой объем занимают 5 моль О2 при н.у.?
2. Какой объем занимают 2,5 моль Н2 при н.у.?
Задача №2 (образец)
Какое количество вещества содержит водород объемом 33,6 л при н.у.?
|
Дано: н.у. Vm = 22, 4 л/моль V (H2) = 33,6 л |
Решение: ν (Н2) = V(N2 ) / Vm = 33,6 л / 22,4 л/моль = 1,5 моль Ответ: ν (Н2) = 1,5 моль |
|
Найти: ν — ? |
Задачи для самостоятельного решения
Решите задачи по приведённому образцу:
1. Какое количество вещества содержит кислород объемом 0,224 л при н.у.?
2. Какое количество вещества содержит углекислый газ объемом 4,48 л при н.у.?
Задача №3 (образец)
Какой объем займут 56 г. газа СО при н.у.?
|
Дано: н.у. Vm = 22, 4 л/моль m (CO) = 56 г |
Решение: ν (CO) = V(CO) / Vm , следовательно V (CO ) = ν (CO) · Vm Неизвестное количество вещества найдём по формуле: ν = m/M M(CO) = Ar(C) + Ar(O) = 12 + 16 = 28 г/моль ν (СО) = m/M = 56 г / 28 г/моль = 2 моль V (CO ) = ν (CO) · Vm = 2 моль · 22,4 л/моль = 44,8 л Ответ: V (CO ) = 44,8 л |
|
Найти: V — ? |
Задачи для самостоятельного решения
Решите задачи по приведённому образцу:
1. Какой объем займут 8 г. газа О2 при н.у.?
2. Какой объем займут 64 г. газа SО2 при н.у.?
Задача №4 (образец)
В каком объеме содержится 3·1023 молекул водорода Н2 при н.у.?
|
Дано: н.у. Vm = 22, 4 л/моль N = 3·1023 молекул Na = 6,02 ·1023 моль-1 |
Решение: ν (Н2) = V(Н2) / Vm , следовательно V (Н2 ) = ν (Н2) · Vm Неизвестное количество вещества найдём по формуле: ν = N / Na = 3·1023 / 6,02 ·1023 моль-1 = 0,48 моль V (Н2 ) = ν (Н2) · Vm = 0,48 моль · 22,4 л/моль = 10,752 л Ответ: V (Н2 ) = 10,752 л |
|
Найти: V — ? |
Задачи для самостоятельного решения
Решите задачи по приведённому образцу:
1. В каком объеме содержится 12,04 ·1023 молекул углекислого газа — СО2 при н.у.?
2. В каком объеме содержится 3,01·1023 молекул кислорода — О2 при н.у.?
Решите задачи для закрепления:
1. Найдите массу (н.у.):
а) 6 л. О3;
б) 14 л. газа Н2S?
2. Какой объём водорода при н.у. образуется при взаимодействии 0,23 г натрия с водой?
3. Какова молярная масса газа, если 1 л. его имеет массу 3,17 г.? (Подсказка! m = ρ·V)
Число Авогадро – число частиц в моле любого вещества:
NA = 6,02∙1023 моль–1.
Следовательно, 27∙1021 молекул газа соответствуют:
27∙1021/6,02∙1023 = 4,485*10-2 моль газа.
Объем моля любого газа при нормальных условиях равен 22,4 л/моль.
Отсюда: 4,485*10-2 моль*22,4 л/моль ≈ 1 л
Ответ: 27*1021 молекул газа при нормальных условиях занимают объем, равный 1 л.
Не знаете как решить или выполнить курсовую или дипломную?
Заказать решение