Эта тема входит в бесплатную часть моего курса по биохимии.
Белки — это полимерные молекулы, которые состоят из молекул поменьше — мономеров. Этими мономерами будут аминокислоты. Если упростить, то белок — это большой кирпичный дом. Где кирпичики — это аминокислоты. В этой статье мы посмотрим на эти кирпичики: какие они бывают, сколько их и какие у них свойства. Потом соединим аминокислоты вместе — синтезируем пептид. Подробно поговорим о пептидной связи, удерживающей аминокислоты вместе. А в конце небольшой подарок — торсионные углы.
Строение аминокислот
По названию понятно, что в аминокислоте должны быть две вещи: аминогруппа и карбоксильная группа. Аминокислот довольно много, но в белках встречаются только такие:
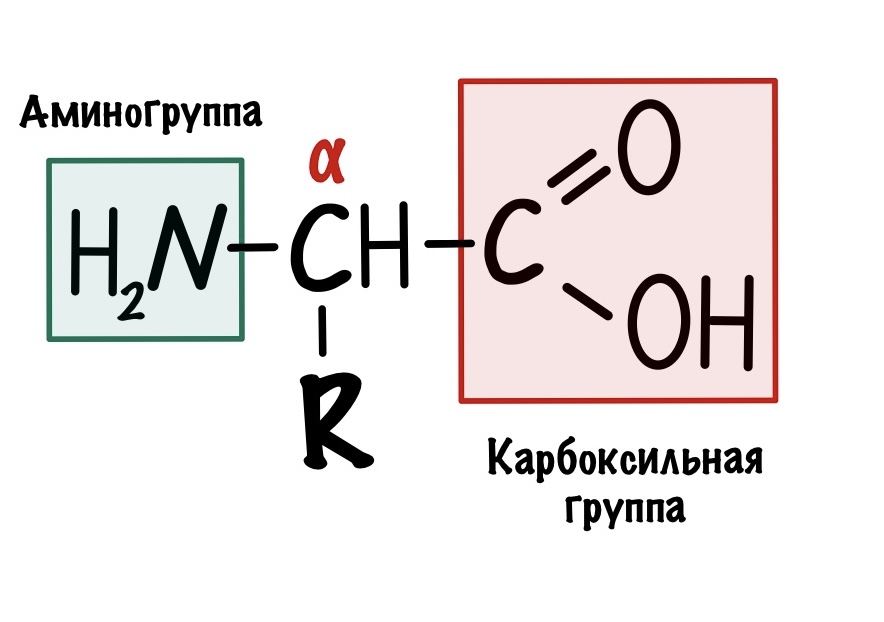
Это альфа-аминокислоты. В них есть центральный атом углерода, который связан с четырьмя заместителями: водородом, аминогруппой, карбоксильной группой и радикалом. Над этим атомом стоит греческая буква — альфа, почему? Это способ нумерации атомов углерода, входящих в органическое соединение. Для нумерации используют буквы греческого алфавита: альфа, бета, гамма, дельта и так далее. Нумерацию начинают с атома углерода, который следует после карбоксильной группы.
Альфа-углерод связан с четырьмя разными заместителями. Ещё разок повторим, что это — водород, аминогруппа, карбоксильная группа и радикал. Такие атомы называются хиральными центрами. Если в молекуле есть хиральный центр, то она хиральна. Что это значит? Это значит, что у молекулы есть изомер — он является её зеркальным отражением. Две этих молекулы будут несопоставимы в пространстве — они разные! Самый простой пример хиральности — левая и правая рука. Руки являются зеркальным отражением друг друга, но у нас не получится идеально сопоставить их в пространстве. Для этого пришлось бы превратить правую руку в левую. Или левую в правую.
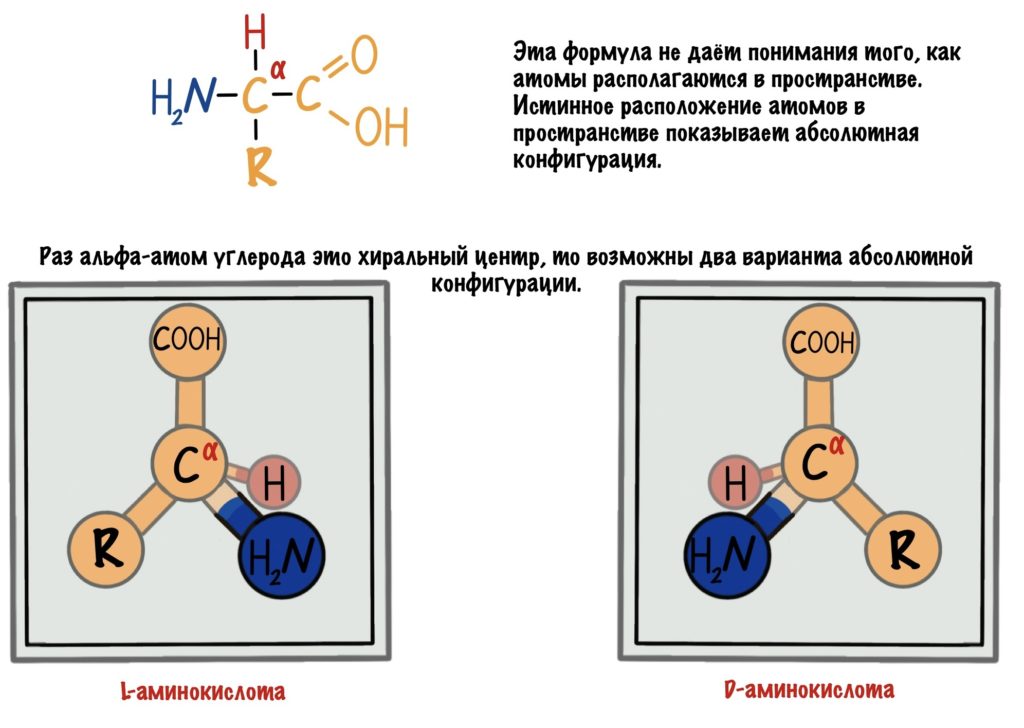
Живые организмы используют и синтезируют только L-аминокислоты.
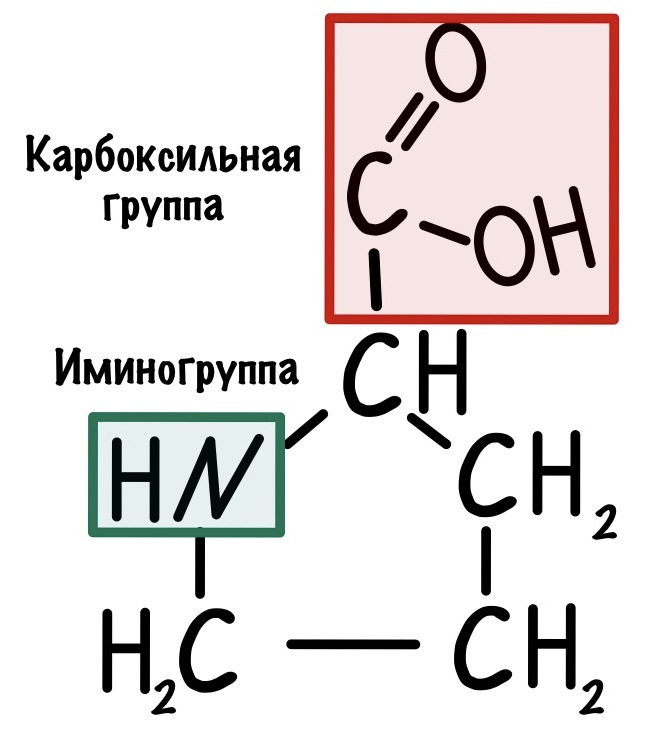
Альфа-аминокислоты будут различаться по своим радикалам. Всего нам нужно запомнить 20 аминокислот. Одна из них будет иметь особое строение — правильнее было бы назвать её иминокислотой. Вот наша легенда — пролин.
Вернемся к различиям между аминокислотами. Есть несколько классификаций радикалов, но мы возьмем самую полезную для нас — по полярности. А если говорить простыми словами, то по растворимости радикала в воде. Радикалы делятся на неполярные и полярные. Первые не растворимы в воде, а вторые растворимы. Когда будем говорить о строении белка, то поймем почему нас интересует именно эта классификация.
Неполярные радикалы аминокислот
У этих ребят нет групп, которые могут образовать водородные связи с водой, поэтому они нерастворимы. Вместо этого у них есть алифатические и ароматические группы. Радикалы выделены фиолетовым цветом.
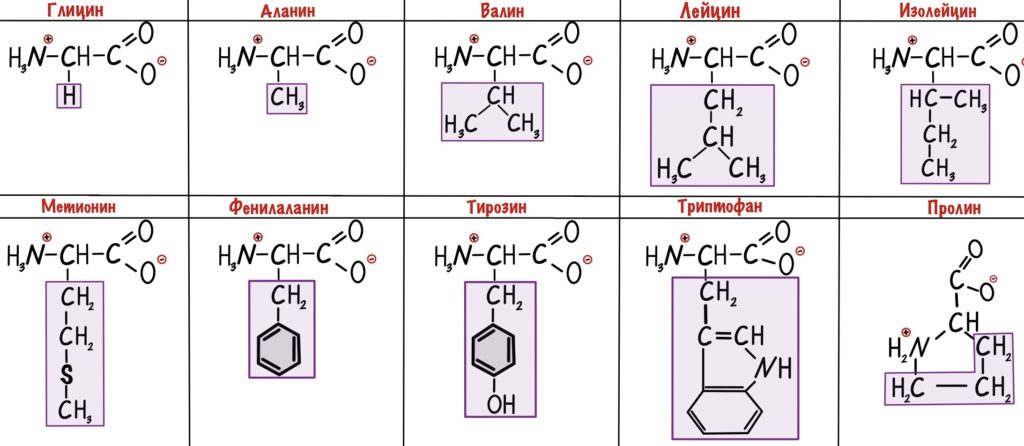
У глицина радикал — атом водорода. Выходит, что у его альфа-атома углерода два одинаковых заместителя — он не является хиральным атомом.
Полярные радикалы аминокислот
Перед этим остановимся на одной вещичке. Я писал формулы аминокислот так, как будто они не находятся в растворе. Но если мы заглянем в клетку, pH в цитоплазме которой 7 и 0, то увидим такую картину.
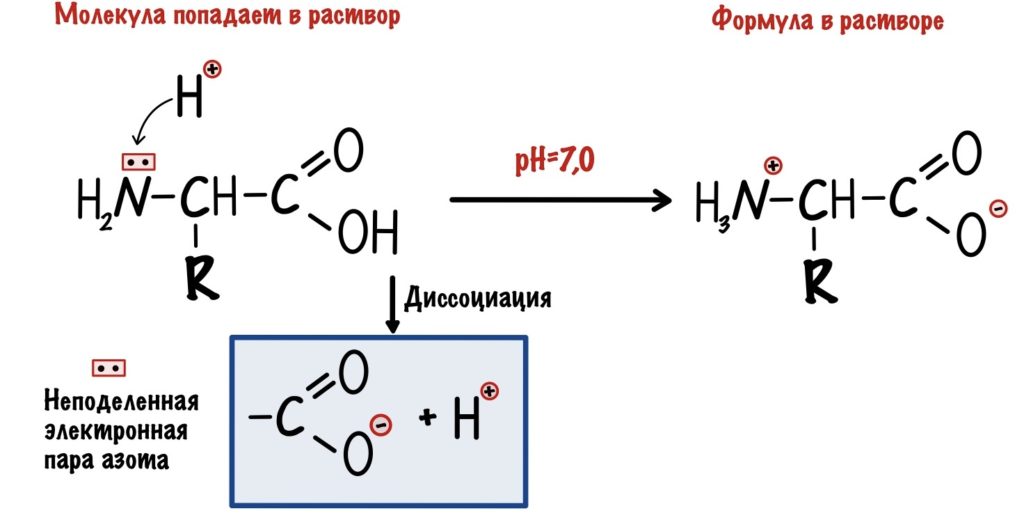
Еще разок, в цитоплазме клетки pH 7,0, то есть в в ней равное количество H+ и OH—. Так как у азота есть неподеленная электронная пара, то он может присоединить протон водорода по донорно-акцепторному механизму. А остаток кислоты диссоциирует с образованием протона. Понятное дело, что радикалы подчиняются таким же правилам.
Полярные радикалы можно разделить на две группы: полярные незаряженные и полярные заряженные.
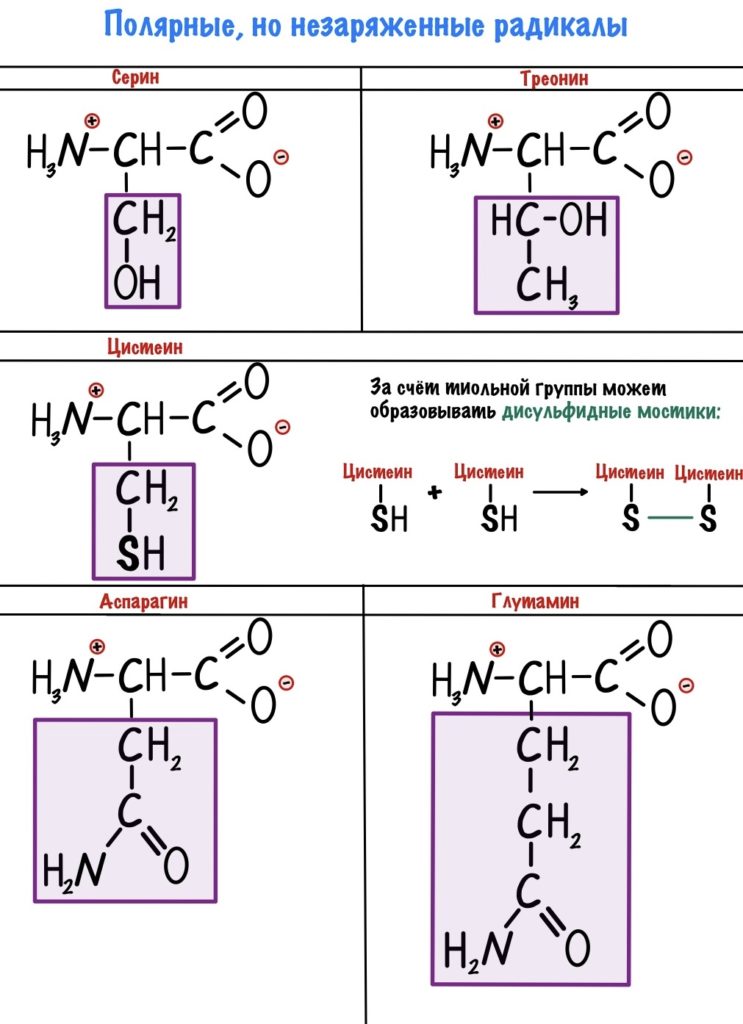
В этих аминокислотах есть сильно электроотрицательные атомы — азот, кислород и сера. С их помощью молекулы образуют водородные связи и растворяются в воде. Но заряда у них нет.
Заряд у радикала может быть положительным или отрицательным, поэтому здесь небольшое деление.
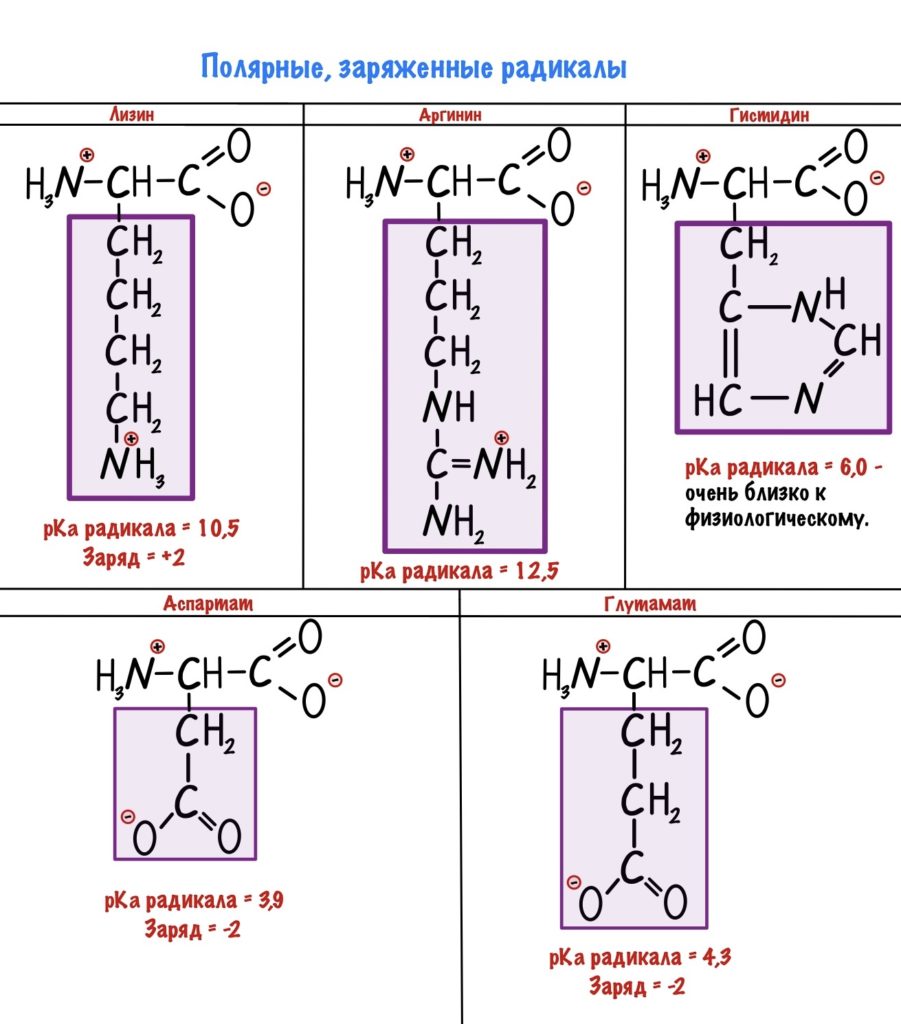
Кстати, лучше растворимы в воде заряженные радикалы. Но разница между полярными заряженными и незаряженными не слишком большая. И еще одно — аспартат и глутамат это название аспарагиновой и глутаминовой кислот в растворе.
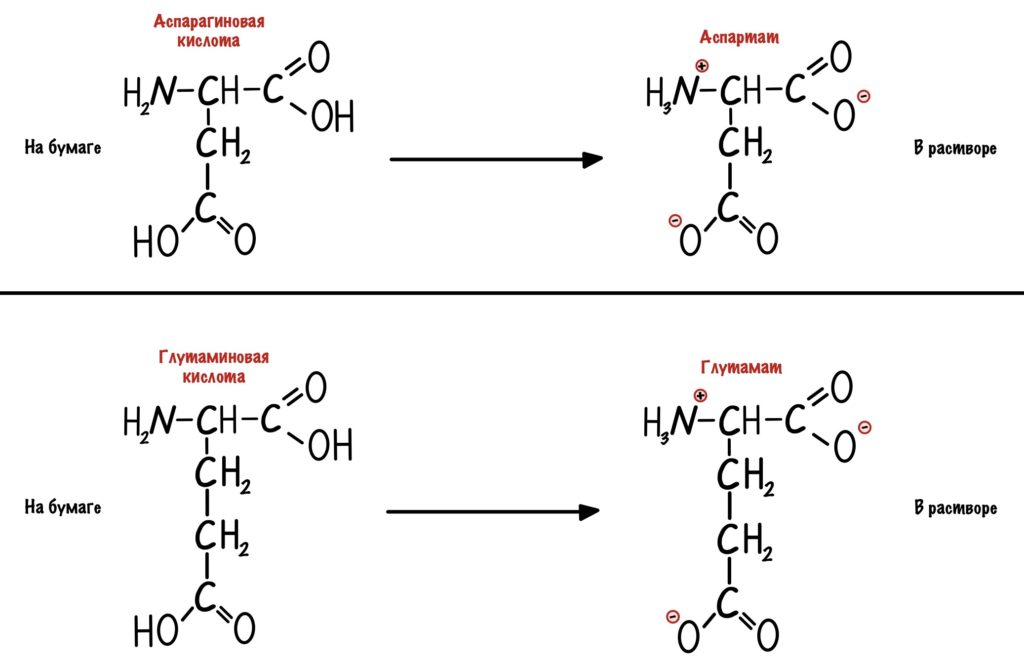
Аминокислоты делятся на полярные и неполярные. Полярные аминокислоты могут быть заряженными или незаряженными.
Аминокислоты называли по месту их выделения или физическим свойствам, поэтому у них такие странные названия. Гликос с греческого — сладкий, вот и глицин сладковат. Так что придется зазубрить это.
Изоэлектрическая точка
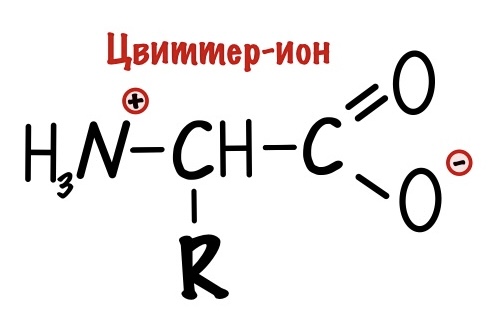
Вы уже заметили, что у аминокислот есть положительная и отрицательная части. Не так много молекул имеют такую особенность. Так что аминокислоты — это такой гибрид, поэтому их так и назвали — гибридные ионы. Правда на немецком…. А звучит это так: «Цвиттер-ион». Но как всегда есть один нюанс — у гибридного иона общий заряд молекулы равен нулю.
И вы уже смекнули, что не у всех аминокислот будет общий заряд равен нулю. Для неполярных и полярных незаряженных аминокислот это верно, но че делать с заряженными? До этого мы разбирали заряд аминокислот в клетке, то есть при нейтральном pH. Но что будет с ними, если поместить их в другие значения среды, например, в сильнощелочную или кислотную? Аминокислоты будут менять свой заряд и сейчас посмотрим как.
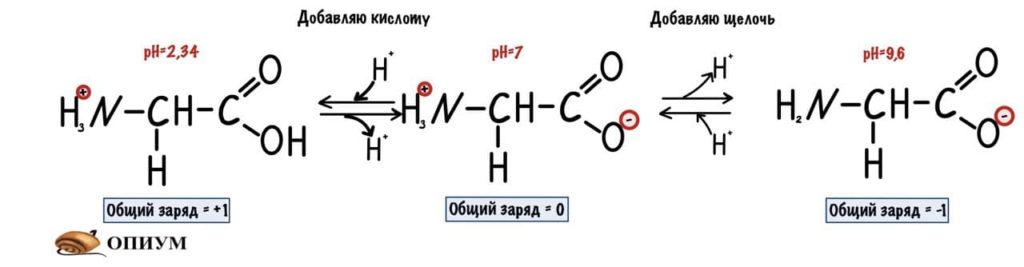
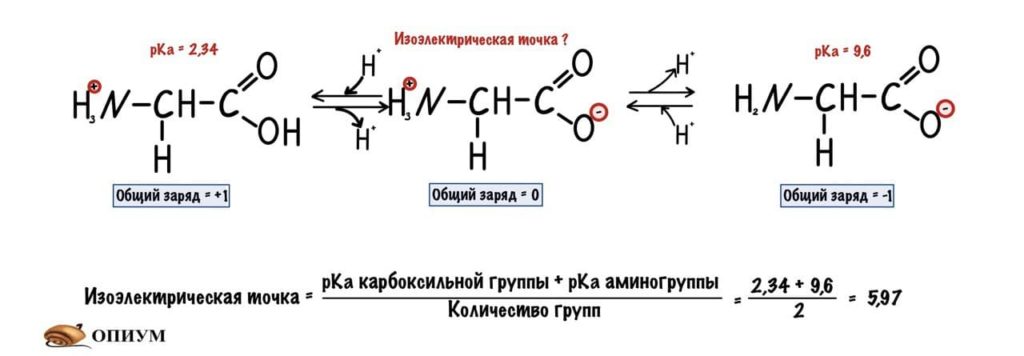
Для начала возьмем что-нибудь простенькое — пусть это будет глицин. Нужно понять, что мы берём раствор — у него будет определённая кислотность среды (pH) равная 7,0. В этом растворе будет множество молекул глицина. Добавляем в этот раствор кислоту. Прямо по капле. Сначала ничего не меняется, но при значении pH=2,34 половина карбоксильных групп глицина присоединит к себе протон водорода. Продолжим уменьшать pH (добавлять кислоту) — всё большее количество глицина присоединяет протон. Что же получается? При снижении pH менее 2,34 большая часть карбоксильных групп глицина присоединит к себе протон. Заряд молекул глицина изменится — теперь он равен +1. Начнем добавлять к этому же раствору щелочь по капле. Дойдем до pH равного 9,6 и от половины аминогрупп глицинов отлетит водород. Заряд молекулы будет -1. Чуть дальше будет хорошая картинка, на которой можно будет проследить за всеми изменениями.
Как же назвать pH при котором происходит переход из одной формы в другую? Очень просто, показатель константы диссоциации или pKa. Константа диссоциации показывает при каком pH среды половина функциональных групп связана с протоном, а другая половина не связана. Получается, что в молекуле глицина pKa карбоксильной группы = 2,34, а pKa аминогруппы = 9,6. Я написал про молекулу глицина, потому что в остальных аминокислотах значения немного отличаются.
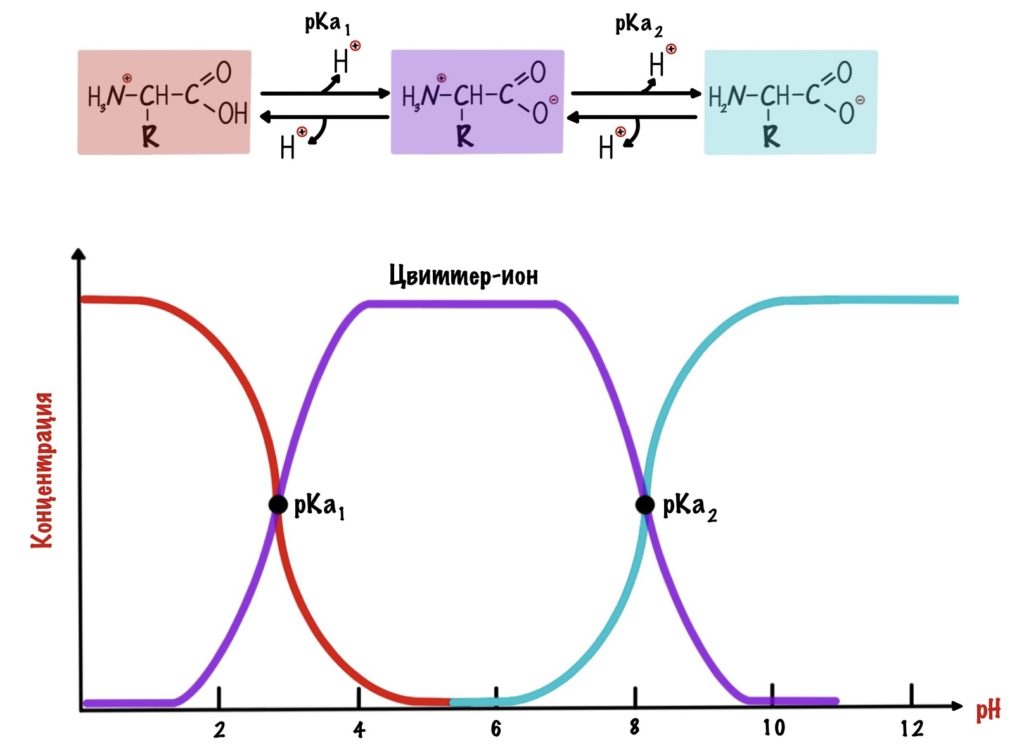
А теперь о том, ради чего все это затевалось — изоэлектрическая точка.
Изоэлектрическая точка — это pH среды, при которой заряд молекулы равен нулю. Да, вот так вот просто. Ее, кстати, можно посчитать — для этого нужно сложить pKa двух ближних функциональных групп и поделить на их количество. А их количество — две.
Сделаем тоже самое с молекулами посложнее, начнем с гистидина.
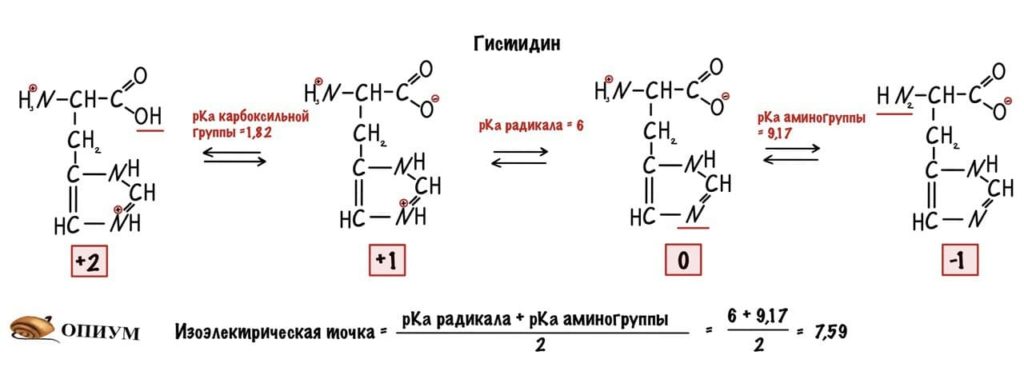
У гистидина есть заряженная группа, поэтому у него побольше вариантов заряда, чем у глицина. Мы видим, что у гистидина карбоксильная группа присоединяет водород при pH =1,82, а аминогруппа отдает протон водорода при pH=9,17. Вот про эти отличия я и говорил до этого, но так-то они не слишком большие. Радикал же отдает протон водорода при pH=6.
Сделаем тоже самое с глутаматом.
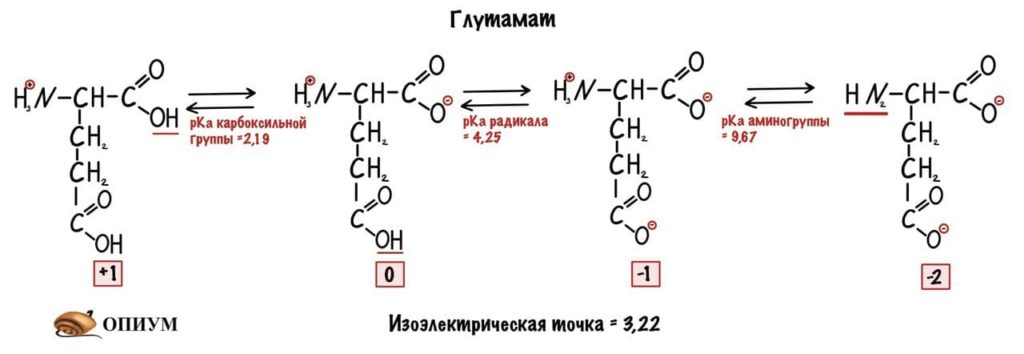
Думаю, что смысл понятен. У каждой аминокислоты своя собственная изоэлектрическая точка. Точки уже давно подсчитаны — достаточно найти их в интернете.
Сделаем красивый вывод:
Любая аминокислота цвиттер-ион, но только в изоэлектрической точке
Зачем это нужно? Ну давайте посмотрим. Мы знаем, что каждая аминокислота несет определенный заряд, но этот заряд меняется от pH среды. Если мы поместим аминокислоты в нейтральную среду и закинем туда катод и анод, то положительно заряженные аминокислоты направятся к аноду, а отрицательные к катоду. Остальные аминокислоты можно будет разделить с помощью изменения pH среды, ведь в изоэлектрической точке у аминокислоты не будет заряда. Нет заряда — нет движения к катоду или аноду, аминокислота стоит на месте. Вот мы и разделили аминокислоты в растворе, можно их изучить.
Образование пептидов
Теперь давайте соединим между собой парочку аминокислот, пусть это будет глицин и аланин. Соединяем их с помощью реакции дегидратации — отщепляем молекулу воды и получаем пептид.
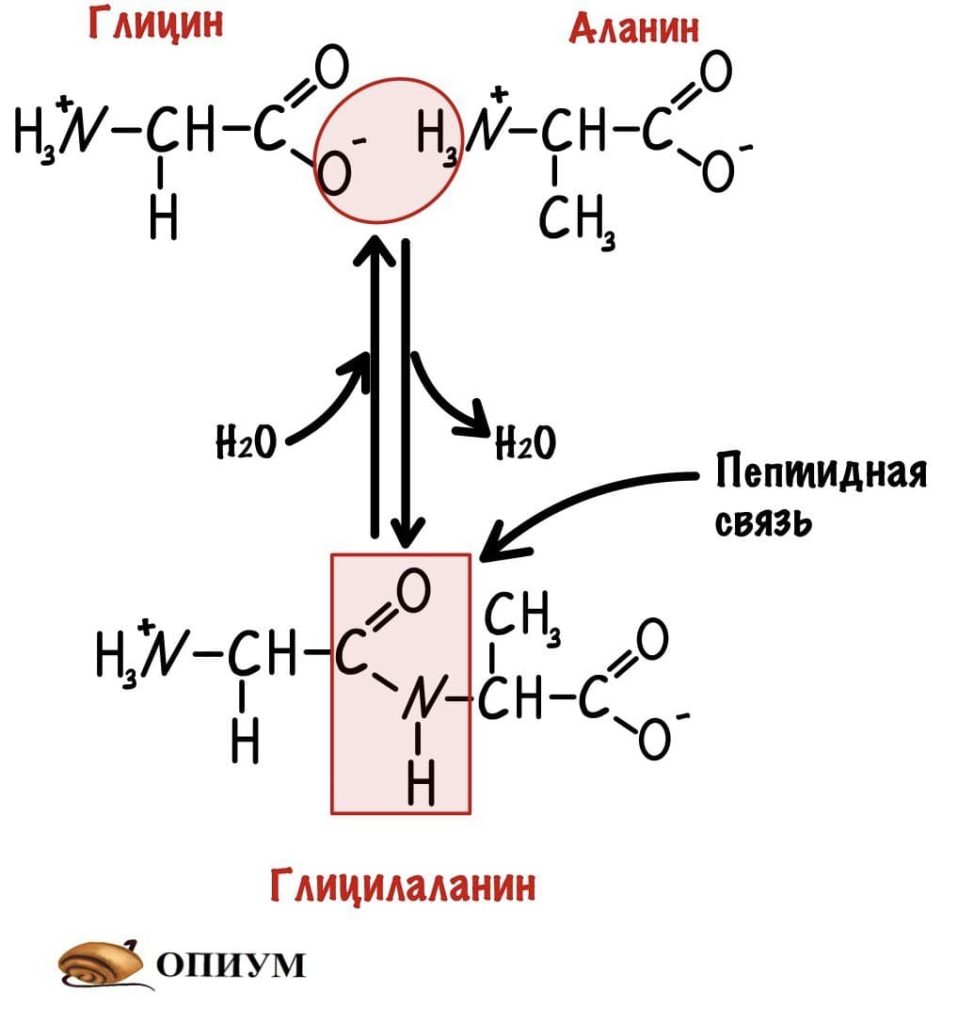
Какие группы вступали в реакцию? Да, аминогруппа и карбоксильная группа. Получается, что пептидная связь — это связь между аминогруппой одной аминокислоты с карбоксильной группой другой аминокислоты. Так как соединены две аминокислоты, то название молекулы — дипептид. Ничего не мешает мне присоединить еще одну.
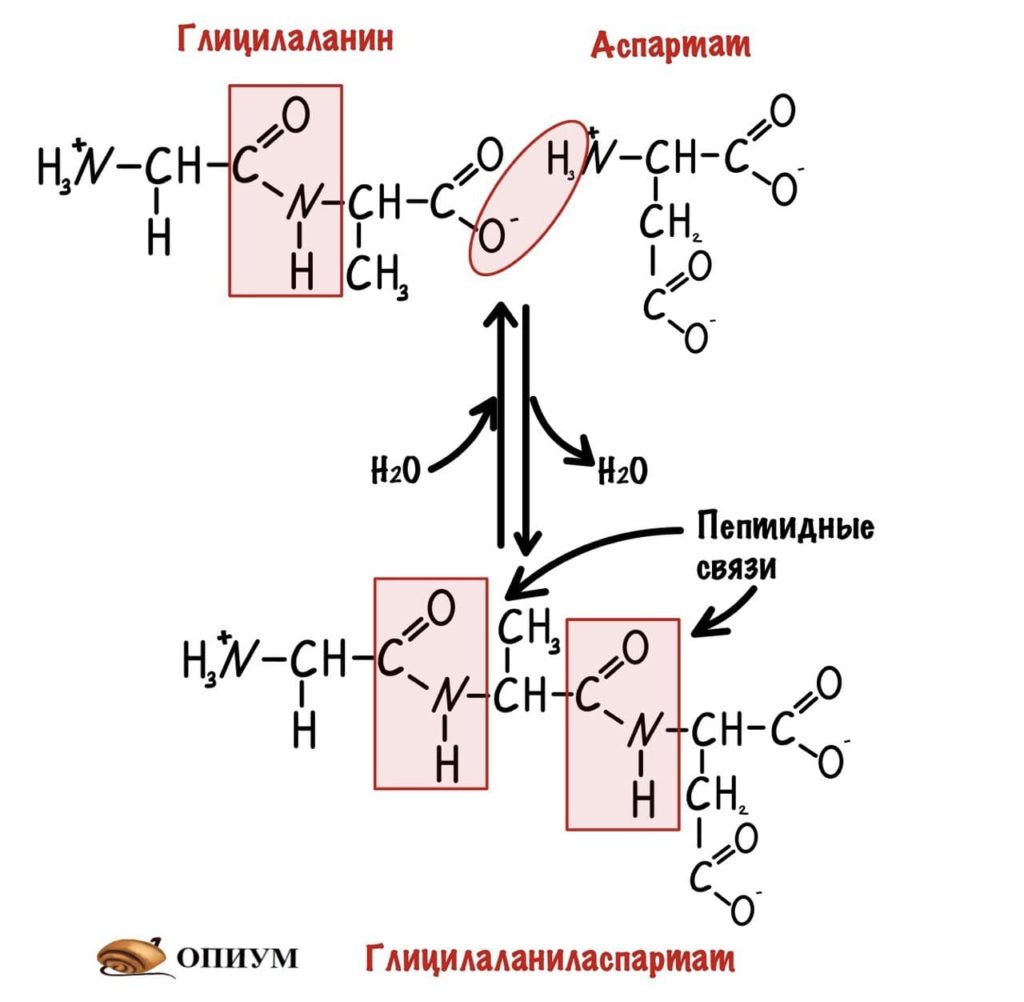
И это уже трипептид. Если соединены до 10 пептидов, то это олигопептид. От 10 до 50 — полипептид, ну а если больше 50, то это белок. Как видите реакция обратима, можно провести гидратацию по пептидной связи и пептид разрушится. На самом деле реакция гидратации идет намного лучше, а вот для дегидратации нужен источник энергии — АТФ, и рибосомальная РНК. Так что для синтеза пептидов/белков организм неплохо так тратится.
Ну и вы заметили, что я располагаю радикалы с разных сторон — то сверху, а то снизу. Это транс положение, оно более устойчиво, но можете писать как хотите.
Белок — это пептид, который содержит более 50 остатков аминокислот
Пептидная связь
У пептидной связи есть свои секретики, но мы не дадим ей хранить их просто так. Главный секрет в том, что двойная связь находится не у кислорода, а у азота… Хотя это не совсем двойная связь, но близка к ней. Как же это происходит? У азота есть неподеленная электронная пара, электроны могут перейти от азота к кислороду, а двойная связь перейдет от кислорода к азоту — неплохой такой обменчик. Это явление называется резонанс пептидной связи, именно из-за него во всех учебниках пишут про «частично-двойной характер пептидной связи».
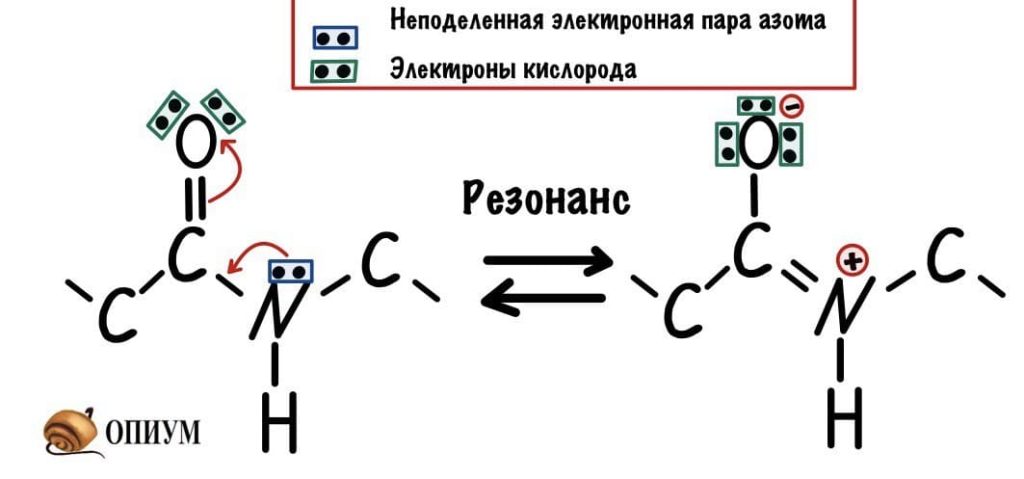
Пойдем еще немного дальше, о чем нам говорит двойная связь? Правильно, о гибридизации углерода — она здесь sp2. А значит угол между связями углерода 120 градусов, здесь они не прямо 120 градусов, но близки к этому. Идем дальше. Азот здесь тоже в sp2 гибридизации, понятно какие углы и у него. Но к чему я это все? Ах да, как будет выглядеть молекула?
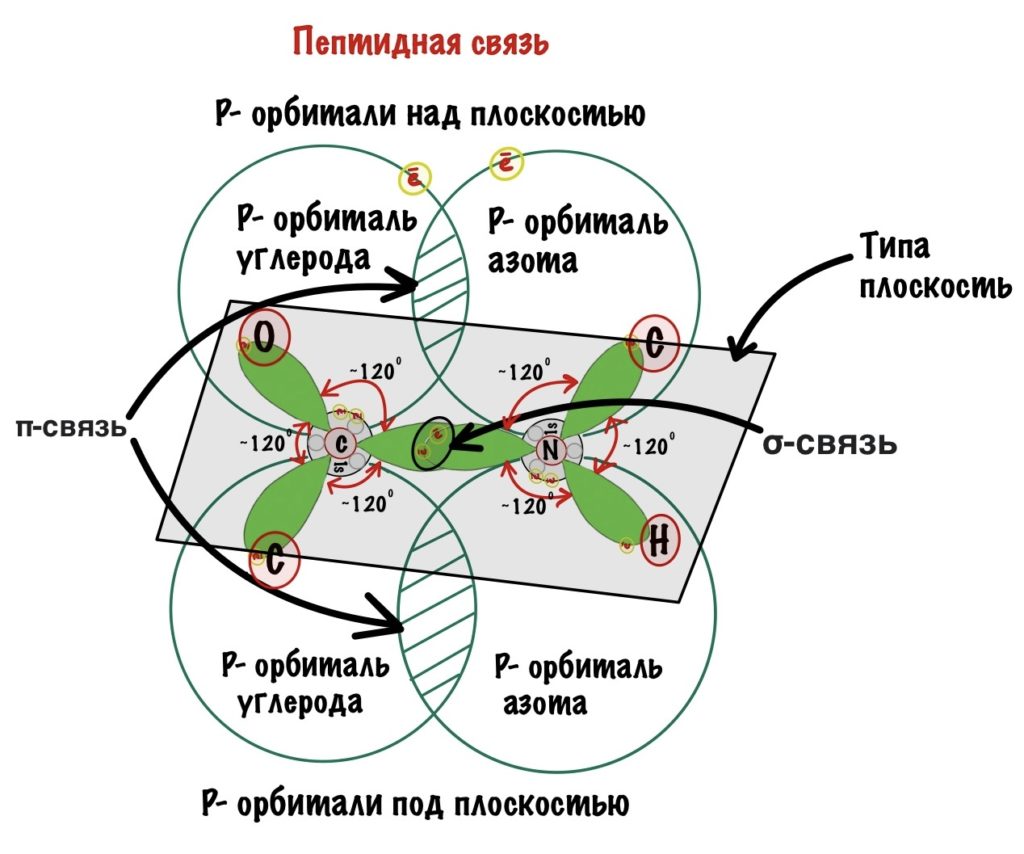
Так как все углы по 120 градусов, то все 6 атомов — 3 углерода, азот, водород и кислород, лежат в одной плоскости, как будто на ладошке. За счет того, что углерод и азот образуют две связи — одну пи и одну сигму, вращение вокруг этих связей практически невозможно. Но об этом чуть позже, сейчас давайте упростим эту схему.
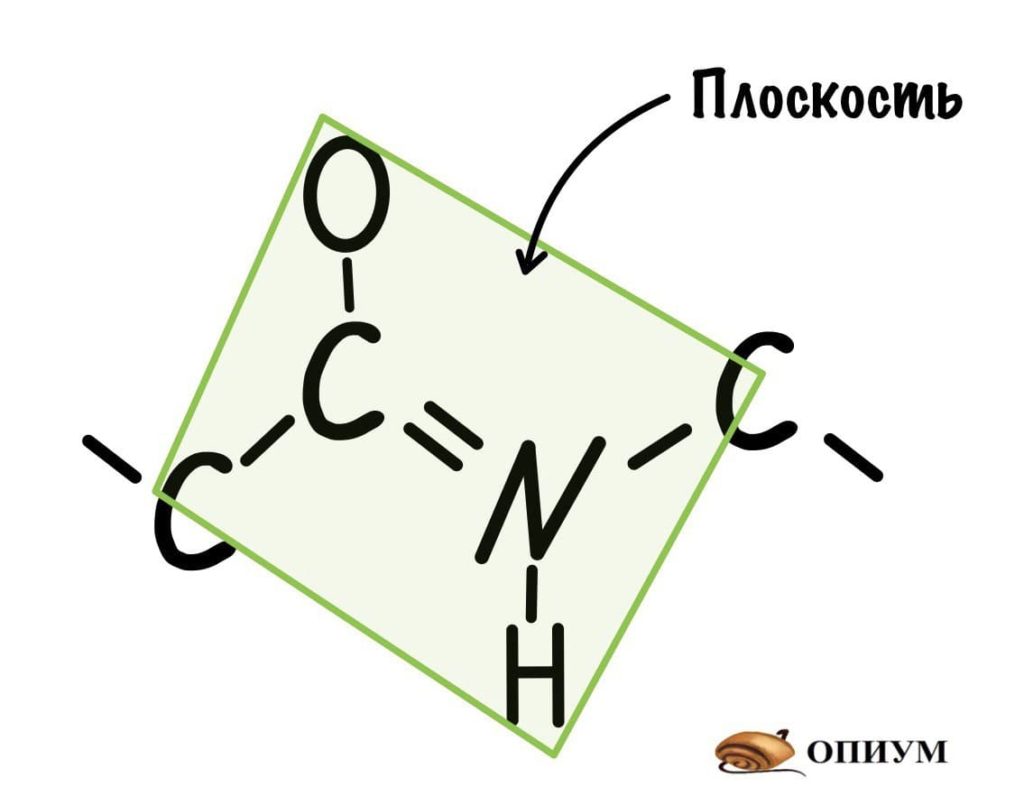
Это мы сделали только с одной пептидной связью, но что если добавить вторую? Получится кое что интересненькое…
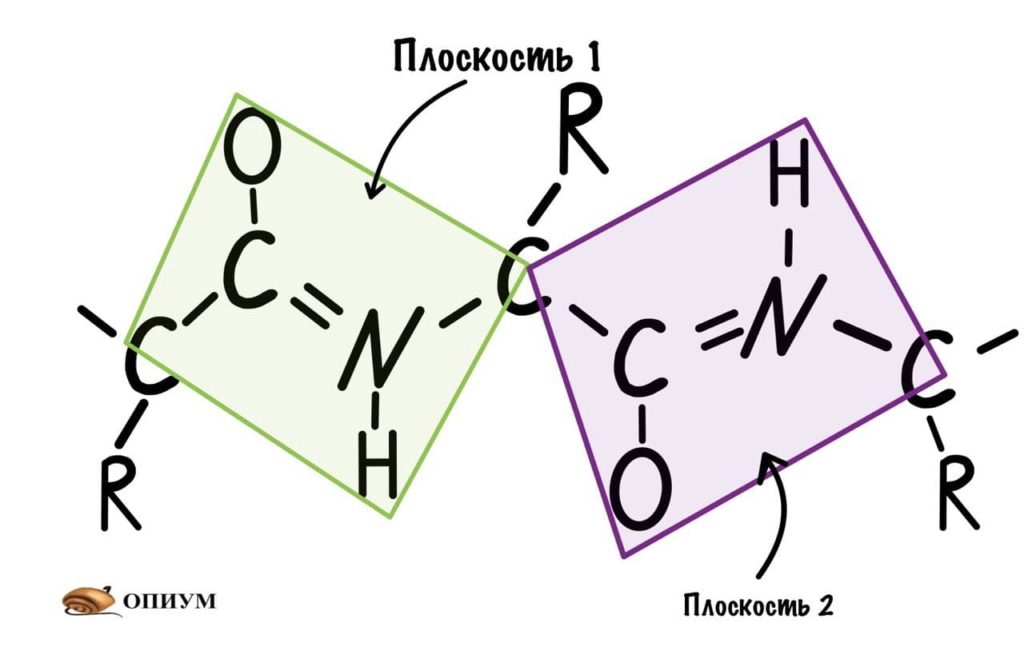
Следующая пептидная связь такая же, как и предыдущая. Получается, что опять 6 атомов лежат в одной плоскости, вы видите, что один атом углерода принадлежит сразу к двум плоскостям и это удивительно! Можно даже подумать, что все эти пептидные связи будут лежать в одной и той же плоскости, но это не так, а виной этому — вращение вокруг связей.
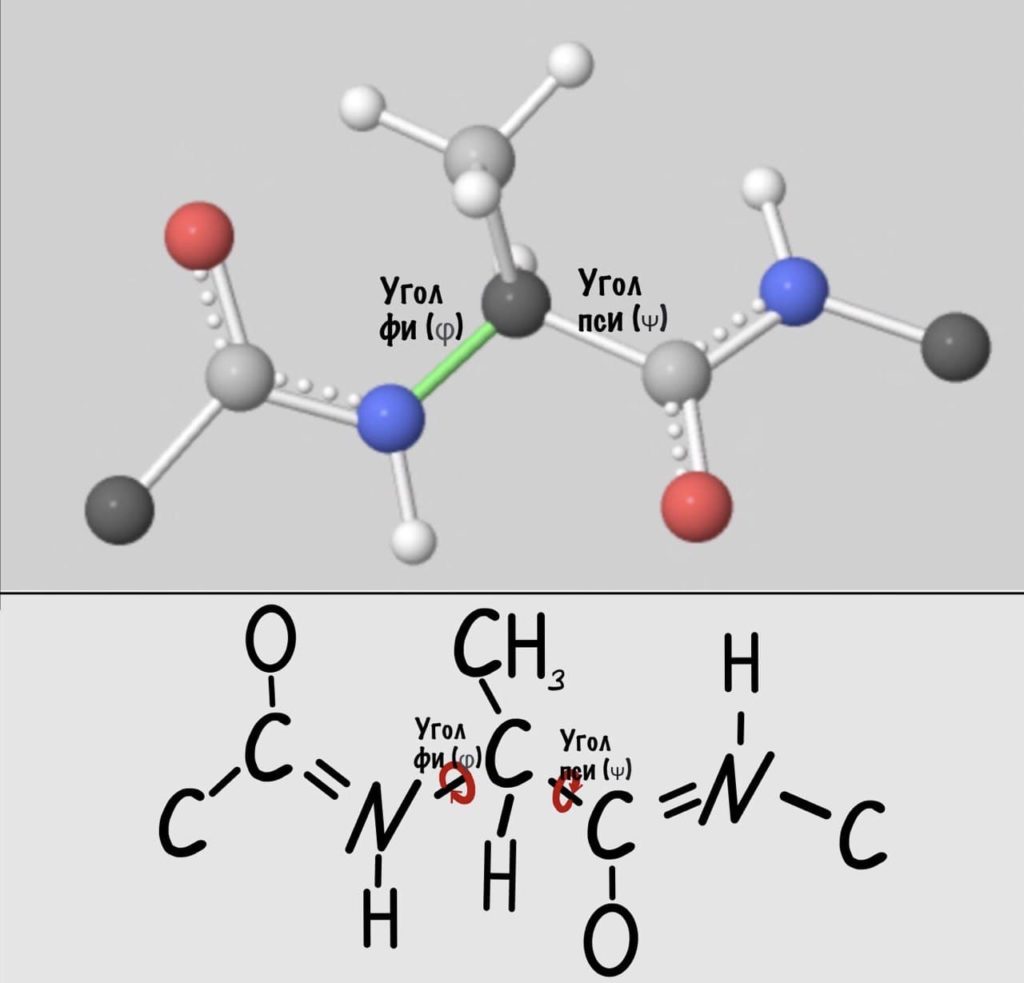
Диэдральные или торсионные углы
Название пугающее, но сейчас как устроим этим углам! Так, мы уже говорили о том, что вокруг пептидной связи не повращаться из-за того, что она частично двойная. Но ведь есть и другие связи, вокруг которых можно устроить веселуху.
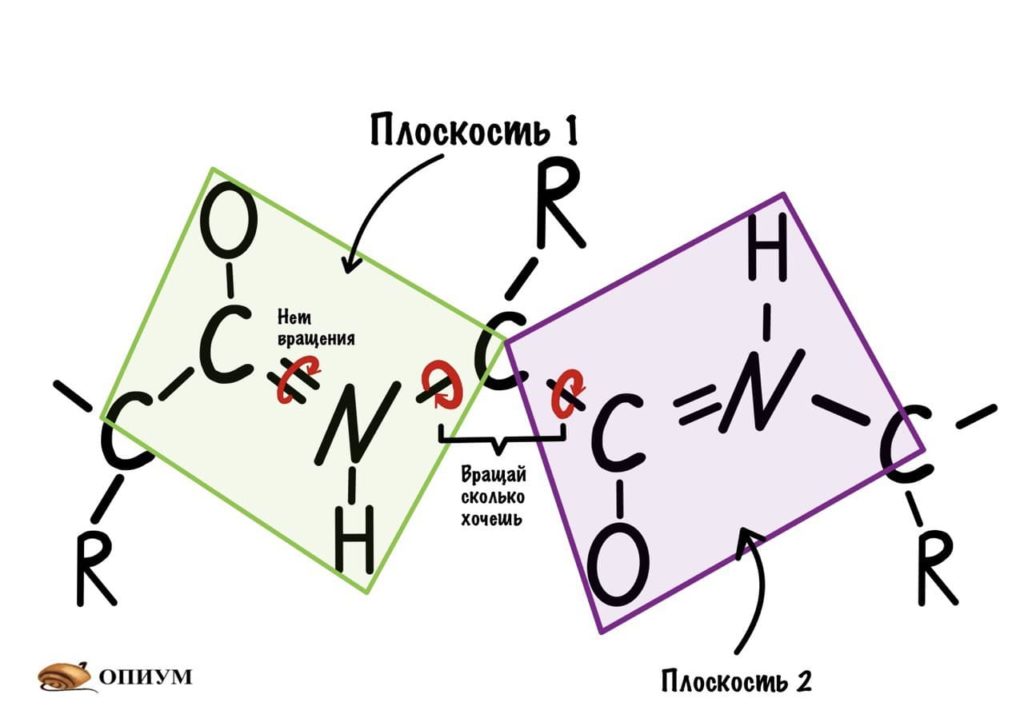
Понимаю, что представить это не так уж и легко, но можно попробовать сделать! Получится конечно не совсем так, но принцип поймем. Возьмем ручку и два колпачка, засунем бумажку под каждый колпачок и начнем крутить. Условимся, что мои пальцы — альфа-углеродный атом, то есть место пересечения двух плоскостей.
Теперь мы поняли, как происходит вращение, но это еще не все. Существуют определенные углы между плоскостями и всего их два. Представьте, что нам захочется найти угол между углеродами, у которых карбоксильная группа, двух плоскостей. Или угол между двумя атомами азота, опять же, двух разных плоскостей. Задачка кажется сложной… Но перед этим, а зачем я вообще мучаю вас этим? Дело в том, что когда мы дойдем до конформации белковых молекул, то благодаря этим углам мы поймем: как и почему образуется альфа-спираль, тоже самое с бета-складчатостью. Так что потерпите немного!
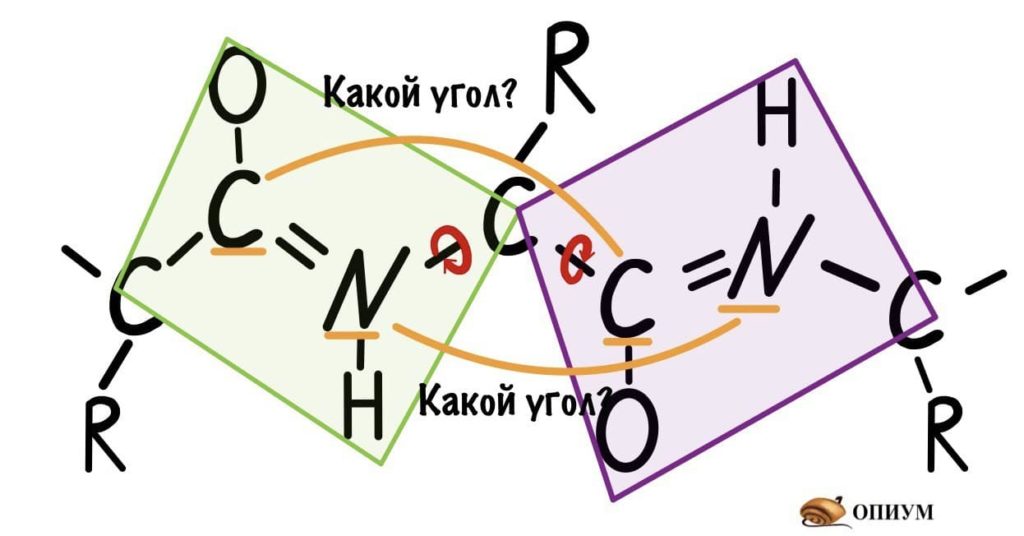
Если посмотреть на эту схему, то можно кое-что прикинуть: если мы будем вращать связь между N и C, то углерод с карбоксильной группой изменит положение относительно углерода другой плоскости, а вот азот останется на том же месте — угол между двумя азотами не изменится. А вот если начнем вращать связь между C и C, то все будет наоборот: угол между азотами изменится, но вот углероды с карбоксильной группой останутся на месте. Сложновато, но чуть дальше я дам пространственную картинку. Пока что мы пришли к выводу, что связь между N и C влияет на угол между углеродами — этот угол называется фи. А вот связь между C и C влияет на угол между атомами азота — угол пси.
Теперь можно и добавить атомы водорода в схему, они скоро нам понадобятся.
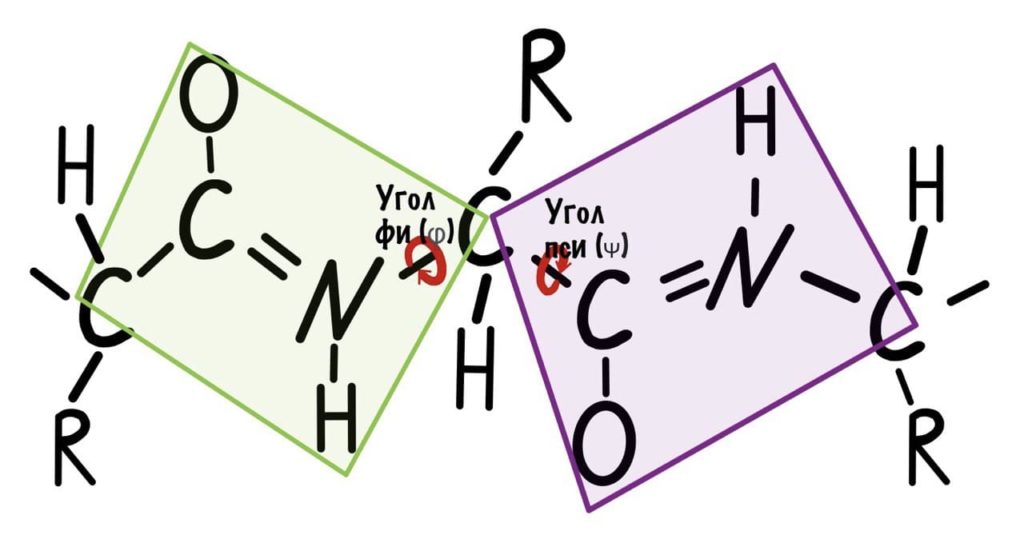
Добавим реалистичности, центральным радикалом у нас будет -CH3, а остальные радикалы уберем.
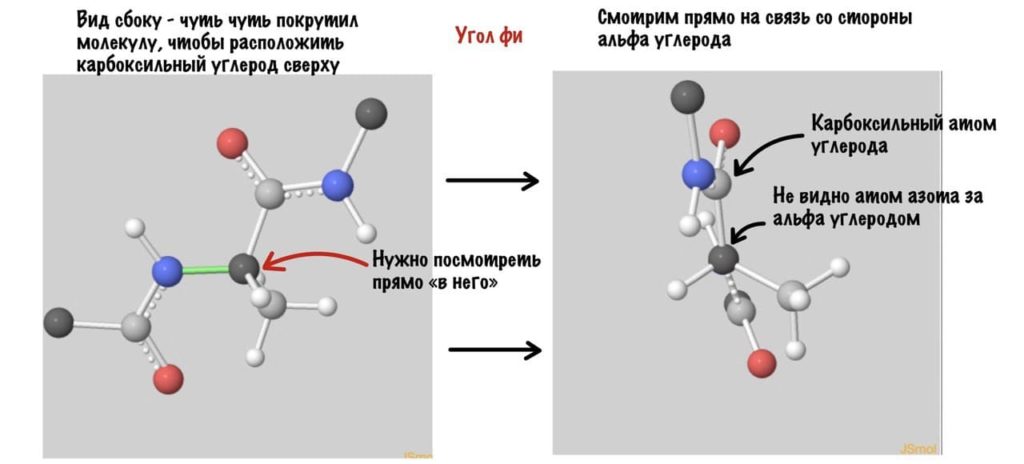
А теперь главный вопрос — как измерить эти углы? Хорошо, что уже это придумали… И мы можем сделать это вместе — заходите сюда и поехали! Первым делом нам нужно перевернуть молекулу так, чтобы расположить атом углерода с карбоксильной группой сверху. Зачем такие выкрутасы? Расскажу позже. А теперь посмотрим прямо в альфа атом углерода, да так что за ним спрятался азот. Как-то это странно звучит, но давайте попробуем.
Еще это можно посмотреть графически с помощью проекций Ньюмана.
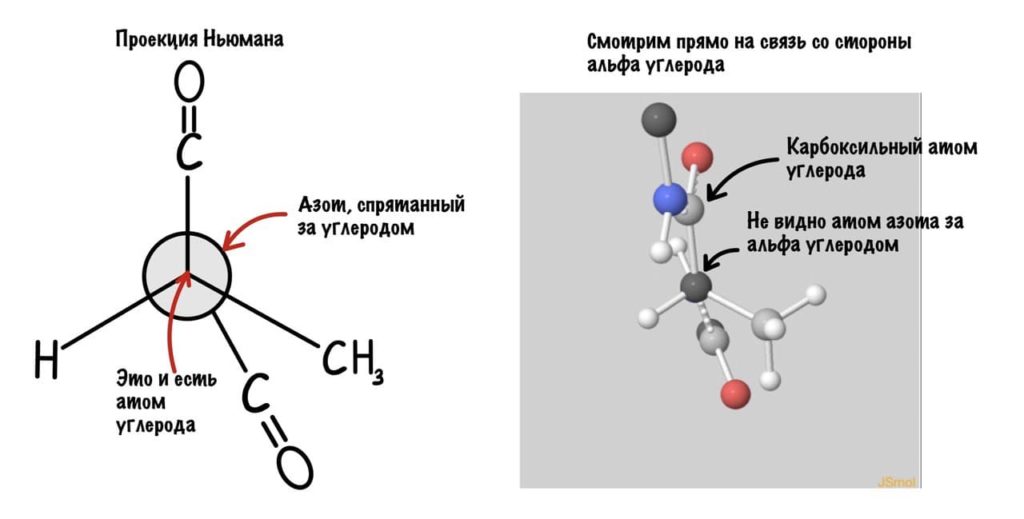
Так, повторим что такое угол фи — это угол между двумя карбоксильными атомами углерода. На рисунке уже их видно.
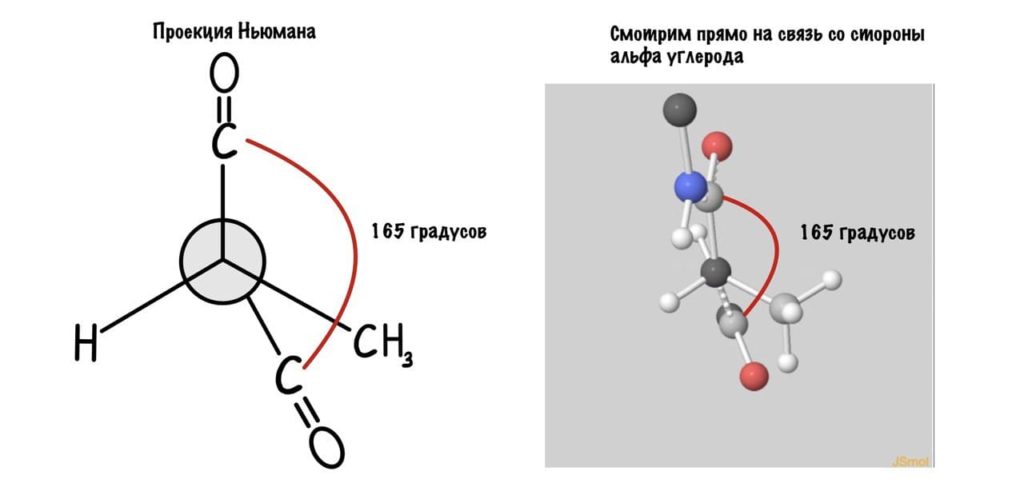
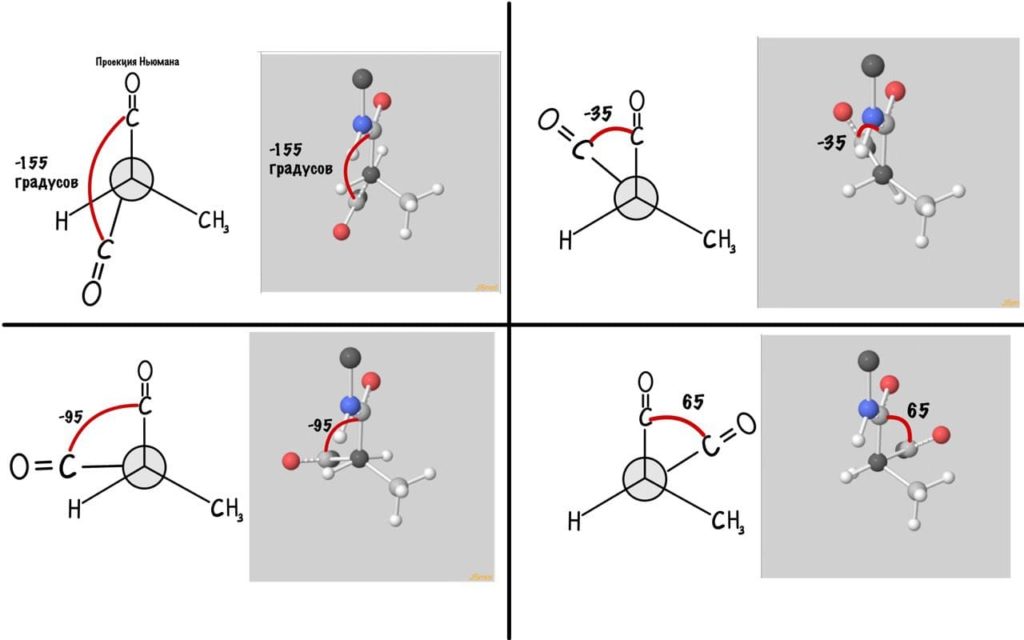
Поняли зачем так крутили молекулу? Да, просто так нам удобнее смотреть угол. А теперь начнем вращать и посмотрим как меняются углы.
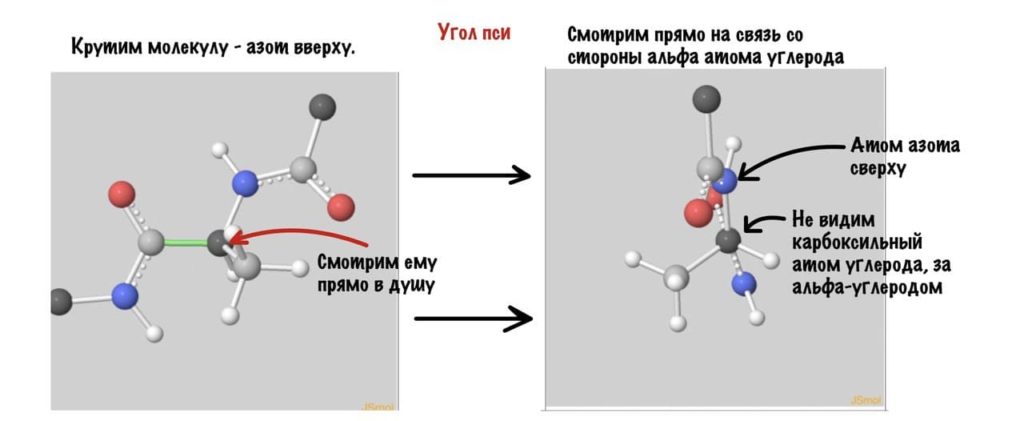
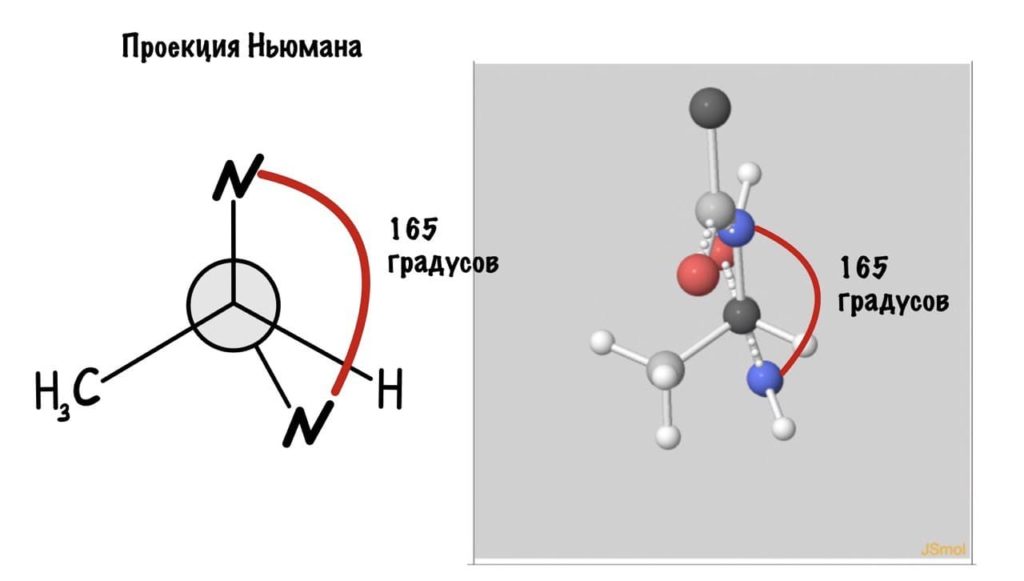
Угол пси по такой же логике. Крутим молекулу, чтобы атом азота оказался сверху и смотрим прямо в альфа атом углерода.
Еще разок построим проекцию Ньюмана, она немного отличается, и сразу же отметим углы.
Думаю, что принцип понятен. Дальше можете покрутить сами, правильно? Я не сказал про одно большое «НО» — не каждый угол возможен, так как у атомов есть электронные оболочки, которые заряжены отрицательно. Если электронные оболочки подходят слишком близко, то они отталкиваются и угол меняется. Какие углы возможны? Для этого еще разок зайдите сюда и включите на панельке справа силы Ван-дер-Вальса и show clashes.
Подробнее о влиянии этих углов в следующей статье.
The following amino acid is called lysine. I was asked to calculate its isoelectric point, with the given $mathrm pK_mathrm a$ values.
I’ve searched a lot, and the most helpful post that I found was How do I calculate the isoelectric point of amino acids with more than two pKa’s?
According to orthocresol’s answer:
Since the $mathrm{pI}$ is the $mathrm{pH}$ at which the amino acid has no overall net charge, you need to average the $mathrm pK_mathrm a$ values relevant to the protonation/deprotonation of the form with no net charge.
Let’s call the ends $e_1, e_2$ and $e_3$ (from left to right).
Approach $#1$
- deprotonate $e_3$ (i.e., carboxyl group)
- deprotonate $e_1$ or $e_2$ [neutral point]
So, $mathrm pK_mathrm a$‘s of $e_1$ and $e_2$ are relevant.
$$Rightarrow mathrm{pI} = frac{10.53 + 8.95}{2} = 9.74$$
But, is there some limit to number of protonations/deprotonations or some procedures to follow?
For instance,
Approach $#2$
- deprotonate $e_1$
- deprotonate $e_3$ [neutral point]
- deprotonate $e_2$ and protonate $e_1$ [neutral point]
This time, $mathrm pK_mathrm a$‘s of $e_3$ and $e_1$ are relevant. But, the calculated $mathrm{pI}$ isn’t correct.
So, how can I validate the approaches?
Problem source: FIITJEE study material
$mathrm pK_mathrm a$ and $mathrm{pI}$ values table for amino acids: https://www.anaspec.com/html/pK_n_pl_Values_of_AminoAcids.html
Физические свойства аминокислот
Хотя аминокислоты
обычно изображают как соединения,
содержащие амино- и карбоксильную группы
(H2N CHR COOH),
некоторые их свойства, как физические,
так и химические, не согласуются с этой
структурой. Присутствие в молекуле у
одного атома углерода двух функциональных
групп приводит к появлению ряда
специфических свойств.
Во-первых,
в противоположность аминам и карбоновым
кислотам аминокислоты представляют
собой нелетучие кристаллические
вещества, плавящиеся с разложением при
близких и довольно высоких температурах,
поэтому идентификации аминокислот по
температурам плавления достаточно
затруднительна.
Во-вторых,
аминокислоты очень плохо растворимы в
неполярных растворителях типа петролейного
эфира, диэтилового эфира, бензола и
хорошо растворимы в воде.
В-третьих,
в водных растворах аминокислоты имеют
высокие дипольные моменты.
В-четвертых,
константы
кислотности и основности для групп СООН
и NH2
необычайно малы. Так, для глицина
константа кислотности Ka
= 1,61010,
а константа основности Kb
= 2,51012;
в то время как для большинства карбоновых
кислот Ka
105
а для алифатических аминов Kb
104.
Все эти
свойства вполне объяснимы,
если
принять во внимание тот факт, что
аминокислоты существуют в виде диполярного
иона, который образуется за счет
отщепления протона от карбоксильной
группы и присоединения его к аминогруппе.
Диполярный ион часто называют внутренней
солью.
Кислотно-основные
свойства также становятся понятными,
если учесть, что измеряемая Ka
в действительности относится к кислотности
иона RNH3+:
а константа
основности (Kb)
в действительности относится к основности
карбоксилат-иона.
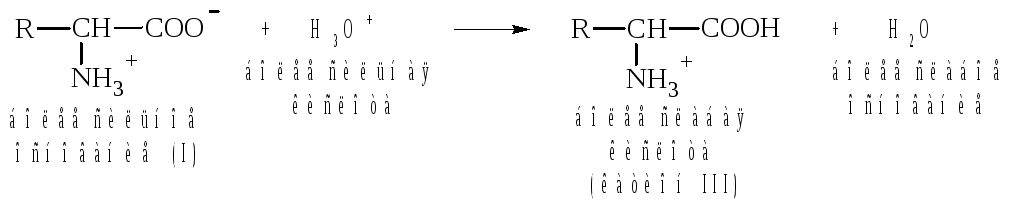
При подщелачивании
раствора аминокислоты диполярный ион
I
превращается в анион II,
так как более сильное основание
(гидроксильный ион) отрывает протон от
иона аммония и образуется более слабое
основание
амин.
Если подкислить
раствор аминокислоты, ион I
превратится в катион III,
так как более сильная кислота Н3О+
отдает протон карбоксилат-иону и
образуется более слабая кислота:
Необходимо отметить,
что ионы II
и Ш, содержащие свободную аминогруппу
или свободную карбоксильную группу,
находятся в равновесии с диполярным
ионом:
Однако следует
иметь в виду, что в данном равновесии
участвует также определенное (хотя и
небольшое) количество незаряженных
молекул аминокислот.
Изоэлектрическая точка аминокислот
Мы рассмотрели
превращение в кислой и щелочной средах
моноаминомонокарбоновых кислот, в
радикалах которых не содержится
ионогенных групп (аминокислоты с
недиссоциирующими радикалами).
Изменение суммарного
заряда аминокислот с анионными и
катионными группами в радикале, в
зависимости от рН среды, можно представить
в следующей таблице. Для сравнения в
эту же таблицу поместим аминокислоты,
в радикале которых нет диссоциирующих
групп.
В сильнокислом
растворе имеется значительный избыток
катионов, а в сильно щелочном
избыток анионов.
Если раствор
аминокислоты поместить в электрическое
поле, то в зависимости от активной
реакции среды будет наблюдаться следующая
картина: в кислой среде ион аминокислоты
мигрирует к катоду, а в щелочной
к аноду. Если при определенном рН среды
концентрация катионов станет равной
концентрации анионов, то никакого
движения аминокислоты происходить не
будет.
|
Среда |
||
|
Сильнокислая |
Нейтральная |
Сильнощелочная |
|
I. |
||
|
Заряд: |
0 |
1 |
|
II. |
||
|
Заряд: |
1 |
2 |
|
III. |
||
|
Заряд: |
+1 |
1 |
Концентрация
ионов водорода (pH),
при которой аминокислота не перемещается
в электрическом поле, называется
изоэлектрической
точкой
данной аминокислоты (рI).
Изоэлектрическая
точка аминокислоты зависит от кислотности
группы NH3+,
основности карбоксилат-аниона, природы
радикала и присутствия в молекуле
кислоты любой дополнительной основной
или кислотной группы.
При pH
≠ pI
в растворе присутствует равновесная
смесь диполярного иона и катионной или
анионной формы, что в некоторых случаях
может привести к появлению у растворов
аминокислот буферных свойств (подробнее
см. учебное пособие «Общая химия, часть
III»
под редакцией профессора А.С. Берлянда,
глава «Буферные системы»). Значительной
буферной ёмкостью в интервале
физиологических значений рН, (т.е. в
интервале 6-8) обладает только гистидин.
Отметим лишь, что при pH
= pI
растворы аминокислот буферного действия
не проявляют.
При пропускании
постоянного тока через раствор, содержащий
смесь нескольких аминокислот, каждая
из них будет двигаться к катоду или к
аноду со скоростью, зависящей от природы
этой аминокислоты и от рН среды. Разделение
и анализ смесей амино-кислот, основанное
на этом явлении, называется электрофорезом.
Соседние файлы в папке Амины, аминокислоты
- #
- #
Для аминокислот характерна амфотерность
Амфотерность является основным физико-химическим свойством аминокислот.
Понятие амфотерность означает, что вещество сочетает в себе свойства как кислот, так и оснований. В водном растворе аминокислоты одновременно ведут себя как кислоты – доноры протонов и как основания – акцепторы протонов. Данное свойство аминокислот напрямую связано со амфотерными свойствами белков, благодаря которому они участвуют в регуляции кислотно-основного состояния крови.

Амфотерность аминокислот
Если общий заряд аминокислоты равен 0, то это ее состояние называют изоэлектрическим.
Величина рН, при которой заряд аминокислоты равен 0, называется изоэлектрической точкой (ИЭТ, pI). Значение изоэлектрической точки зависит от строения радикала аминокислоты:
- ИЭТ большинства аминокислот располагается в диапазоне рН от 5,5 (фенилаланин) до 6,3 (пролин),
- ИЭТ кислых аминокислот — для глутамата 3,2, для аспартата 2,8,
- ИЭТ основных аминокислот — для гистидина 7,6, для аргинина 10,8, для лизина 9,7.
Изоэлектрическая точка гистидина позволяет ему использоваться в буферной системе гемоглобина. Гемоглобин легко принимает и легко отдает ионы водорода при малейших сдвигах физиологической рН крови (в норме 7,35-7,45).
Заряд аминокислот зависит от величины рН среды и от строения их радикала.
При снижении концентрации ионов водорода в растворе (защелачивание среды) повышается их отрыв от аминогруппы и карбоксигруппы аминокислот. Иными словами, от аминокислоты уходит положительный заряд и она становится отрицательно заряженной. Когда рН снижается (закисление среды), то имеющиеся в растворе ионы Н+ присоединяются к амино- и карбоксигруппам – заряд аминокислоты становится положительным.
Отправным пунктом для понимания причин появления заряда у конкретной аминокислоты является величина изоэлектрической точки. К уже сказанному необходимо добавить одну очень существенную вещь – изменение рН рассматривается относительно изоэлектрической точки (ИЭТ, pI). Если рН ниже pI – заряд аминокислоты становится положительным, если рН выше – отрицательным.
Изменение заряда аминокислот при смещении рН раствора
в кислую или щелочную сторону.
(кликните на рисунке, чтобы увеличить)
Лекция
№ 47
АМИНОКИСЛОТЫ. ПЕПТИДЫ
План
- Методы получения.
- Химические свойства.
- Аминокислоты, входящие в состав
белков. - Пептиды
Аминокислоты
– гетерофункциональные соединения, содержащие карбоксильную и аминогруппы. По
взаимному расположению функциональных групп различают a -,b -, g — и т.д. аминокислоты.
Аминокислоты, содержащие аминогруппу на конце цепи, называют w -аминокислотами.
1. Методы получения
!) Аммонолиз галогензамещенных кислот.
Метод используется для синтеза a
-аминокислот из доступных a -галогензамещенных
кислот.
2) Метод Штеккера- Зелинского
Включает стадии образования аминонитрила при взаимодействии альдегида с HCN
и NH3 c последующим гидролизом его в аминокислоту. В качестве
реагента применяют смесь NaCN и NH4Cl.
Метод применим для синтеза только a
-аминокислот.
3) Алкилирование N-фталимидмалонового эфира
4) Присоединение аммиака к a
,b -непредельным карбоновым
кислотам.
Метод применим для синтеза b
-аминокислот.
5) Из оксимов циклических кетонов перегруппировкой Бекмана.
Метод используется для синтеза w
-аминокислот.
2. Химические свойства
Аминокислоты
дают реакции, характерные для карбоксильной и аминогрупп, и, кроме того,
проявляют специфические свойства, которые определяются наличием двух
функциональных групп и их взаимным расположением.
2.1. Кислотно-основные свойства
Аминокислоты содержат кислотный и основный центры и являются амфотерными
соединениями. В кристаллическом состоянии они существуют в виде внутренних
солей (биполярных ионов), которые образуются в результате внутримолекулярного
переноса протона от более слабого основного центра (СОО—) к более
сильному основному центру (NH2).
Ионное строение аминокислот подтверждается их физическими свойствами.
Аминокислоты – нелетучие кристаллические вещества с высокими температурами
плавления. Они нерастворимы в неполярных органических растворителях и
растворимы в воде. Их молекулы обладают большими дипольными моментами.
Форма существования аминокислот в водных растворах зависит от рН. В кислых
растворах аминокислоты присоединяют протон и существуют преимущественно в виде
катионов. В щелочной среде биполярный ион отдает протон и превращается в анион.
При некотором значении рН, строго определенном для каждой аминокислоты, она
существует преимущественно в виде биполярного иона. Это значение рН называют изоэлектрической
точкой (рI). В изоэлектрической точке аминокислота не имеет
заряда и обладает наименьшей растворимостью в воде. Катионная форма
аминокислоты содержит два кислотных центра (COOH и NH3+)
и характеризуется двумя константами диссоциации рКа1 и рКа2.
Значение рI определяется по уравнению:
2.2. Реакции по аминогруппе
Дезаминирование
Аминокислоты содержат первичную аминогруппу и подобно первичным аминам
взаимодействуют с азотистой кислотой с выделением азота. При этом происходит
замещение аминогруппы на гидроксильную.
RCH(NH2)COOH + HNO2 ®
RCH(OH)COOH + N2 + H2O
Реакция используется для количественного определения аминокислот по объему
выделившегося азота (метод Ван-Слайка).
Алкилирование и арилирование
При взаимодействии аминокислот с избытком алкилгалогенида происходит
исчерпывающее алкилирование аминогруппы и образуются внутренние соли.
Аминокислоты арилируются 2,4-динитрофторбензолом (ДНФБ) в щелочной среде.
Реакция протекает как нуклеофильное замещение в активированном ароматическом
кольце.
Реакция используется для установления аминокислотной последовательности в
пептидах.
Ацилирование
Аминокислоты взаимодействуют с ангидридами и хлорангидридами с образованием
N-ацильных производных.
Реакция используется для защиты аминогруппы в синтезе пептидов. Такая защита
должна легко сниматься, а амиды, как известно, гидролизуются в жестких
условиях. При разработке методов синтеза пептидов были найдены защитные группы,
которые легко удаляются путем гидролиза или гидрогенолиза.
Карбобензоксизащита:
трет-Бутоксикарбонильная защита (БОК-защита).
Легкость снятия защиты обусловлена устойчивостью бензил- и трет-бутил-катионов,
которые образуются в качестве интермедиатов.
2.3. Реакции по карбоксильной группе
Декарбоксилирование
При сухой перегонке в присутствии гидроксида бария аминокислоты
декарбоксилируются с образованием аминов.
Этерификация
Аминокислоты взаимодействуют со спиртами в присутствии газообразного HCl как
катализатора с образованием сложных эфиров.
В отличие от самих аминокислот, их сложные эфиры – легко летучие соединения
и могут быть разделены путем перегонки или газожидкостной хроматографии, что
используется для анализа и разделения смесей аминокислот, полученных при
гидролизе белков.
Получение галогенангидридов и ангидридов
При действии на защищенные по аминогруппе аминокислоты галогенидов фосфора
или серы образуются хлорангидриды.
Реакция используется для активации карбоксильной группы при нуклеофильном
замещении. Чаще для этой цели получают смешанные ангидриды, которые являются
более селективными ацилирующими реагентами.
Реакция используется для активации аминогруппы в синтезе пептидов.
2.4. Специфические реакции аминокислот
Реакции с одновременным участием карбоксильной и аминогрупп идут, как
правило, с образованием продуктов, содержащих термодинамически устойчивые 5-ти-
и 6-тичленные гетероциклы.
Комплексообразование
a -Аминокислоты образуют прочные
хелатные комплексы с ионами переходных металлов (Cu, Ni, Co, Cr и др.).
Отношение аминокислот к нагреванию
Превращения аминокислот при нагревании зависят от взаимного расположения
карбоксильной и аминогруппы и определяются возможностью образования термодинамически
стабильных 5-ти- 6-тичленных циклов
a -Аминокислоты вступают в реакцию
межмолекулярного самоацилирования. При этом образуются циклические амиды – дикетопиперазины.
b -Аминокислоты при нагревании
переходят a ,b -непредельные кислоты.
g — и d
-Аминокислот претерпевают внутримолекулярное ацилирование с образованием
циклических амидов – лактамов.
Нингидриновая реакция
При взаимодействии a -аминокислот с
трикетоном – нингидрином происходит одновременное окислительное дезаминирование
и декарбоксилирование с образованием альдегида и окрашенного продукта
конденсации.
Реакция используется для количественного анализа аминокислот методом
фотометрии.
- a -Аминокислоты,
входящие в состав белков
3.1.
Строение и классификация
Природные аминокислоты отвечают общей формуле RCH(NH2)COOH и
отличаются строением радикала R. Формулы и тривиальные названия важнейших
аминокислот приведены в таблице. Для биологического функционирования
аминокислот в составе белков определяющим является полярность радикала R. По
этому признаку аминокислоты разделяют на следующие основные группы (см.
таблицу).
Таблица47.1. Важнейшие a
-аминокислоты RCH(NH2)COOH
|
Формула |
Название |
Обозначение |
pI |
|
Аминокислоты, |
|||
|
|
Глицин |
Gly |
5,97 |
|
|
Аланин |
Ala |
6,0 |
|
|
Валин |
Val |
5,96 |
|
|
Лейцин |
Leu |
5,98 |
|
|
Изолейцин |
Ile |
6,02 |
|
|
Фенилаланин |
Phe |
5,48 |
|
|
Триптофан |
Trp |
5,89 |
|
|
Пролин |
Pro |
6,30 |
|
|
Метионин |
Met |
5,74 |
|
|
Цистин |
(Cys)2 |
5,0 |
|
Аминокислоты, |
|||
|
|
Серин |
Ser |
5,68 |
|
|
Треонин |
Thr |
5,60 |
|
|
Гидроксипролин |
Hyp |
5,8 |
|
|
Аспаргин |
Asn |
5,41 |
|
|
Глутамин |
Gln |
5,65 |
|
Аминокислоты, |
|||
|
|
Лизин |
Lys |
9,74 |
|
|
5-Гидроксилизин |
9,15 |
|
|
|
Аргинин |
Arg |
10,76 |
|
|
Гистидин |
His |
7,59 |
|
Аминокислоты, |
|||
|
|
Аспаргиновая |
Asp |
2,77 |
|
|
Глутаминовая |
Gly |
3,22 |
|
|
Тирозин |
Tyr |
5,66 |
|
|
Цистеин |
Cys |
5,07 |
Аминокислоты, содержащие неполярный радикал R. Такие группы располагаются
внутри молекулы белка и обуславливают гидрофобные взаимодействия.
Аминокислоты, содержащие полярный неионогенный радикал R. Аминокислоты
этого типа имеют в составе бокового радикала полярные группы, не
способные к ионизации в водной среде (спиртовый гидроксил, амидная группа).
Такие группы могут располагаться как внутри, так и на поверхности молекулы
белка. Они участвуют в образовании водородных связей с другими полярными
группами.
Аминокислоты, содержащие радикал R, способный к ионизации в водной среде
с образованием положительно или отрицательно заряженных групп. Такие
аминокислоты содержат в боковом радикале дополнительный основный или кислотный
центр, который в водном растворе может соответственно присоединять или отдавать
протон.
В белках ионогенные группы этих аминокислот располагаются, как правило, на
поверхности молекулы и обуславливают электростатические взаимодействия.
3.2. Стереоизомерия.
Все природные a-аминокислоты (кроме
глицина) являются хиральными соединениями. По конфигурации хирального центра в
положении 2 аминокислоты относят D- или L-ряду.
Природные аминокислоты относятся к L-ряду.
Большинство аминокислот содержат один хиральный центр и имеют два
стереоизомера. Аминокислоты изолейцин, треонин, гидроксипролин, 5-гидроксилизин
и цистин содержат два хиральных центра и имеют (кроме цистина) 4 стереоизомера,
из которых только один встречается в составе белков.
Так, из 4-х стереоизомеров треонина в природе встречается только
(2S,3R)-2-амино-3-гидроксибутановая кислота.
Использование для построения белков только одного вида стереоизомеров имеет
важное значение для формирования их пространственной структуры и обеспечения
биологической активности.
a -Аминокислоты, полученные синтетическим
путем, представляют рацемические смеси, которые необходимо разделять. Наиболее
предпочтительным является ферментативный способ разделения с помощью ферментов
ацилаз, способных гидролизовать N-ацетильные производные только L-a -аминокислот. Ферментативное расщепление
проводят по следующей схеме.
Сначала рацемическую аминокислоту ацилируют уксусным ангидридом:
Затем рацемическую смесь ацетильных производных подвергают ферментативной
обработке. При этом гидролизуется ацетильное производное только L-аминокислоты:
Полученная после ферментативного смесь легко разделяется, так как свободная
L-аминокислота растворяется и в кислотах, и в щелочах, а ацилированная – только
в щелочах.
3.3. Кислотно-основные свойства.
По кислотно-основным свойствам аминокислоты разделяют на три группы.
Нейтральные аминокислоты не содержат в радикале R дополнительных
кислотных или основных центров, способных к ионизации в водной среде. В кислой
среде они существуют в виде однозарядного катиона и являются двухосновными
кислотами по Бренстеду. Как видно на примере аланина, изоэлектрическая точка у
нейтральных аминокислот не равна 7, а лежит в интервале 5,5 – 6,3.
pI=1/2(2,34+9,69)=6,01
Основные аминокислоты содержат в радикале R дополнительный основный
центр. К ним относятся лизин, гистидин и аргинин. В кислой среде они существуют
в виде дикатиона и являются трехосновными кислотами. Изоэлектрическая точка
основных аминокислот, как видно на примере лизина, лежит в области рН выше 7.
pI= 1/2(9,0+10,05)=9,74
Кислые аминокислоты содержат в радикале R дополнительный кислотный
центр. К ним относятся аспаргиновая и глутаминовая кислоты. В кислой среде они
существуют в виде катиона и являются трехосновными кислотами. Изоэлектрическая
точка этих аминокислот лежит в области рН много ниже 7.
pI= 1/2(2,09+3,86)=2,77
Тирозин и цистеин содержат в боковых радикалах слабые кислотные центры,
способные к ионизации при высоких значениях рН.
Важное значение имеет тот факт, что при физиологическом значении рН (~7) ни
одна аминокислота не находится в изоэлектрической точке. В организме все
аминокислоты ионизированы, что обеспечивает им хорошую растворимость в воде.
Различие в кислотно-основных свойствах используется для разделения
аминокислот методом электрофореза и ионообменной хроматографии. При данном
значении рН разные аминокислоты могут иметь разный по величине и знаку
электрический заряд. Например, при рН6 лизин имеет заряд +1 и движется к
катоду, аспаргиновая кислота имеет заряд –1 и перемещается к аноду, а аланин
находится в изоэлектрической точке и не перемещается в электрическом поле.
Таким образом при рН6 они могут быть разделены с помощью электрофореза.
Для разделения аминокислот методом ионообменной хроматографии используют
катионообменные смолы (сульфированный полистирол). Процесс ведут в кислой
среде, когда аминокислоты находятся катионной форме.
Скорость продвижения аминокислот по хроматографической колонке зависит от
силы их электростатических и гидрофобных взаимодействий со смолой. Наиболее
прочно связываются со смолой основные аминокислоты, имеющие наибольший
положительный заряд, наименее прочно – кислые аминокислоты. Наибольшим
гидрофобным связыванием со смолой обладают аминокислоты с неполярными боковыми
радикалами, особенно ароматическими. Таким образом, порядок элюирования
аминокислот следующий. Легче других элюируются кислые аминокислоты (Asp и Glu),
следом за ними идут аминокислоты, содержащие полярные неионогенные группы (Ser,
Thr, Asn, Gln), затем из колонки вымываются аминокислоты с неполярными боковыми
радикалами (Phe, Trp, Ile и др.) и в последнюю очередь элюируются основные аминокислоты
(His, Lys, Arg).
4. Пептиды
Петиды – это полиамиды, построенные из a
-аминокислот. По числу аминокислотных остатков в молекуле пептида различают дипептиды,
трипептиды, тетрапептиды и т.д. Пептиды, содержащие до 10 аминокислотных
остатков, называют олигопептидами, более 10 аминокислотных остатков – полипептидами.
Природные полипептиды, включающие более 100 аминокислотных остатков, называют белками.
4.1. Строение пептидов
Формально пептиды можно рассматривать как продукты поликонденсации аминокислот.
Аминокислотные остатки в пептиде связаны амидными (пептидными)
связями. Один конец цепи, на котором находится аминокислота со свободной
аминогруппой, называют N-концом. Другой конец, на котором находится
аминокислота со свободной карбоксильной группой, называют С-концом. Пептиды
принято записывать и называть, начиная с N-конца.
Название пептида строят на основе тривиальных названий, входящих в его
состав аминокислотных остатков, которые перечисляют, начиная с N-конца. При
этом в названиях всех аминокислот за исключением С-концевой суффикс “ин”
заменяют на суффикс “ил”. Для сокращенного обозначения пептидов используют
трехбуквенные обозначения входящих в его состав аминокислот.
Пептид характеризуется аминокислотным составом и аминокислотной
последовательностью.
Аминокислотный состав пептида может быть установлен путем полного гидролиза
пептида (расщепления до аминокислот) с последующим качественным и
количественным анализом образовавшихся аминокислот методом ионобменной
хроматографии или ГЖХ-анализом сложных эфиров аминокислот. Полный гидролиз
пептидов проводят в кислой среде при кипячении их с 6н. HCl.
Одному и тому же аминокислотному составу отвечает несколько пептидов. Так,
из 2-х разных аминокислот может быть построено 2 дипептида, из трех разных
аминокислот – 6 трипептидов, из n разных аминокислот n! пептидов одинакового
состава. Например, составу Gly:Ala:Val=1:1:1 отвечают следующие 6 трипептидов.
Gly-Ala-Val Gly- Val-Ala Val-Gly-Ala Val-Ala-Gly Ala-Gly-Val Ala-Val-Glu
Таким образом, для полной характеристики пептида необходимо знать его
аминокислотный состав и аминокислотную последовательность.
4.2. Определение аминокислотной последовательности
Для определения аминокислотной последовательности используют комбинацию двух
методов: определение концевых аминокислот и частичный гидролиз.
Определение N-концевых аминокислот.
Метод Сегнера. Пептид обрабатывают 2,4-динитрофтробензолом (ДНФБ), а
затем полностью гидролизуют. Из гидролизата выделяют и идентифицируют
ДНФ-производное N-концевой аминокислоты.
Метод Эдмана состоит во взаимодействии N-концевой аминокислоты с
фенилизотиоцианатом в щелочной среде. При дальнейшей обработке слабой кислотой
без нагревания происходит отщепление от цепи “меченой” концевой аминокислоты в
виде фенилгидантоинового (ФТГ) производного.
Преимущество этого метода состоит в том, что при отщеплении N-концевой
аминокислоты пептид не разрушается и операцию по отщеплению можно повторять.
Метод Эдмана используют в автоматическом приборе – секвенаторе, с помощью
которого можно осуществить 40 – 50 стадий отщепления, идентифицируя полученные
на каждой стадии ФТГ-производные методом газожидкостной хроматографии.
Частичный гидролиз полипептидов
При частичном гидролизе пептиды расщепляются с образованием более коротких
цепей. Частичный гидролиз проводят с помощью ферментов, которые гидролизуют
пептидные связи избирательно, например, только с N-конца (аминопептидазы)
или только с С-конца (карбоксипептидазы). Существуют ферменты,
расщепляющие пептидные связи только между определенными аминокислотами. Меняя
условия гидролиза, можно разбить пептид на различные фрагменты, которые
перекрываются по составляющим их аминокислотным остаткам. Анализ продуктов
частичного гидролиза позволяет воссоздать структуру исходного пептида.
Рассмотрим простейший пример установления структуры трипептида. Частичный
гидролиз по двум разным направлениям трипептида неизвестного строения дает
продукты представленные на схеме.
Единственный трипептид, структура которого не противоречит продуктам
частичного гидролиза – Gly-Ala-Phe.
Установление аминокислотной последовательности пептидов, содержащих
несколько десятков аминокислотных остатков, – более сложная задача, которая
требует комбинации различных методов.
4.3. Синтез петидов
Синтез пептида с заданной аминокислотной последовательностью – чрезвычайно
сложная задача. В простейшем случае синтеза дипептида из 2-х разных аминокислот
возможно образование 4-х разных продуктов.
В настоящее время разработана стратегия синтеза пептидов, основанная на
использовании методов активации и защиты функциональных групп на
соответствующих этапах синтеза. Процесс синтеза дипептида включает следующие
стадии:
- защита аминогруппы
N-концевой аминокислоты; - активация карбоксильной
группы N-концевой аминокислоты; - конденсация
модифицированных аминокислот - снятие защитных групп
Таким образом, последовательно присоединяя аминокислоты, шаг за шагом
наращивают цепь полипептида. Такой синтез очень длителен, трудоемок и дает
низкий выход конечного продукта. Основные потери связаны с необходимостью
выделения и очистки продуктов на каждой стадии.
Этих недостатков лишен используемый в настоящее время твердофазный синтез
пептидов. На первой стадии защищенная по аминогруппе С-концевая
аминокислота закрепляется на твердом полимерном носителе (полистироле,
модифицированном введением групп –CH2Cl). После снятия защиты
проводят ацилирование аминогруппы закрепленной на носителе аминокислоты другой
аминокислотой, которая содержит активированную карбоксильную и защищенную
аминогруппу. После снятия защиты проводят следующую стадию ацилирования.
Отмывание продукта от примесей проводят прямо на носителе и лишь после
окончания синтеза полипептид снимают с носителя действием бромистоводородной
кислоты. Твердофазный синтез автоматизирован и проводится с помощью приборов –
автоматических синтезаторов.
Методом твердофазного синтеза получено большое количество пептидов,
содержащих 50 и более аминокислотных остатков, в том числе инсулин (51
аминокислотный остаток) и рибонуклеаза (124 аминокислотных остатка).