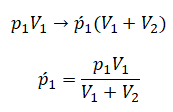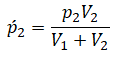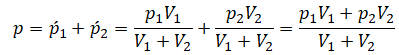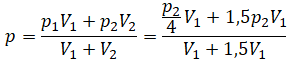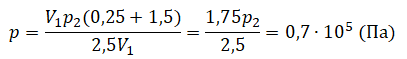Содержание:
- Свойства газов
- Давление газов
- Зависимость между объёмом и давлением газа. Закон Еойля — Мариотта
- Зависимость между плотностью газа и его давлением
- Зависимость объёма газа от температуры. Закон Гей-Люссака
- Зависимость давления газа от температуры. Закон Шарля
- Абсолютная шкала температур
- Зависимость между объёмом, давлением и температурой газа
- Физическая сущность понятия абсолютного нуля
- Изменение температуры газа при быстром расширении и сжатии
- Применение сжатых газов
Газ — это одно из трёх основных агрегатных состояний вещества, характеризующееся очень слабыми связями между составляющими его частицами (молекулами, атомами или ионами), а также их большой подвижностью. Частицы газа почти свободно и хаотически движутся в промежутках между столкновениями, во время которых происходит резкое изменение характера их движения.
На странице -> решение задач по физике собраны решения задач и заданий с решёнными примерами по всем темам физики.
Свойства газов
Главные свойства газов – это подвижность и хаотичное движение частиц, направление которых меняется при столкновении. Газ – одно из 4 агрегатных состояний веществ, которые на сегодняшний день известны науке.
Давление газов
Всякий газ производит давление на оболочку, внутри которой он находится.
Давление, производимое газом на стенки сосуда, объясняется ударами движущихся молекул.
При ударе о стенку молекулы газа отдают ей определённое количество движения; стенка испытывает при этом действие некоторой силы.
Удар каждой отдельной молекулы о стенку сосуда производит очень небольшое действие. Но молекул газа очень много, удары о стенки сосуда происходят беспрерывно, поэтому в результате получается значительное давление.
Хаотичность движения молекул приводит к тому, что давление газа одинаково во всех направлениях.
При нагревании давление газа увеличивается. Так как при этом число молекул газа не изменяется, то увеличение давления можно объяснить только тем, что удары молекул о стенки заключающего газ сосуда делаются при нагревании чаще и что каждый удар становится сильнее. Удары же могут стать чаще и сильнее, если увеличивается скорость движения молекул. Это подтверждается, как мы видели (гл. V), многочисленными опытами.
Зависимость между объёмом и давлением газа. Закон Еойля — Мариотта
Состояние газа определяется его объёмом, давлением и температурой. С изменением этих величин меняется и состояние газа. Мы будем рассматривать последовательно процессы, при которых одна из величин, характеризующих состояние газа, постоянна, а две другие меняются.
Изучим сначала такой процесс, при котором давление и объём газа изменяются, а температура остаётся постоянной. Такой процесс называется изотермическим 1.
1 От греч. слов: изос — равный, термос — тёплый.
Итак, рассмотрим, как изменяется давление данной массы газа при изменении его объёма, если температура газа не меняется.
Опыты, устанавливающие эту зависимость, можно произвести на приборе, три положения которого изображены на рисунке 134.
Рис. 134. Прибор для установления зависимости между объёмом и давлением газа (в трёх положениях).
В этом приборе стеклянная трубка А соединяется резиновой трубкой с другой стеклянной трубкой В. Трубка А вверху снабжена краном 
Откроем кран 
Поднимем теперь трубку В вверх на столько, чтобы объём воздуха в трубке А уменьшился вдвое (положение II). Уровень ртути в трубке В при этом значительно поднимется над уровнем в трубке А.
Рассмотрим теперь, чему будет равно давление воздуха в трубке А. Это давление уравновешивает атмосферное давление и давление всего столба ртути в трубке В, стоящего выше уровня n1 высота этого столба n1n оказывается равной 76 см. Таким образом, давление воздуха в трубке А уравновешивает не одну, как в первом случае, а две атмосферы (р2 = 2 am).
Значит, с уменьшением объёма данной массы газа в два раза давление его увеличивается в два раза. Если уменьшить объём газа в 1,5; 2,5; 3 раза, то соответственно в 1,5; 2,5; 3 раза увеличится его давление.
Опустим теперь трубку В так, чтобы масса воздуха в трубке А заняла вдвое больший объём (положение III). Уровень ртути в трубке А при этом понизится. Атмосферное давление теперь уравновешивает давление воздуха в трубке А и давление столба ртути от уровня n в трубке А до уровня в трубке В. Измерения показывают, что высота этого столба ртути равна 38 см. Давление, производимое воздухом в трубке А, найдём, вычтя из атмосферного давления давление столба ртути: р3 = 76 см—38 см = 38 см; следовательно, р3 = 0,5 am.
Итак, при увеличении объёма газа в два раза его давление уменьшается в два раза.
Перемещая трубку В в различные положения и отсчитывая каждый раз объём и давление воздуха в трубке А, найдём, что при уменьшении объёма исследуемой массы воздуха в некоторое число раз давление его увеличивается во столько же раз. Температура воздуха при всех опытах остаётся постоянной.
Опыты, проведённые с другими газами, дали те же результаты.
Изучая на опыте зависимость давления газа от его объёма, английский учёный Бойль (1627—1691) и французский учёный Мариотт (1620—1684) независимо один от другого открыли следующий закон.
Давление данной массы газа при неизменной температуре обратно пропорционально объёму газа.
Этот закон называется законом Бойля — Мариотта.
Выразим закон Бойля — Мариотта математически. Пусть температура некоторой массы газа постоянная и пусть:
V1 — объём газа при давлении р1,
V2 » » » » р2.
Согласно закону Бойля — Мариотта можно написать:
Из этой формулы следует, что:
Полученное равенство можно рассматривать как новое выражение закона Бойля — Мариотта.
Произведение объёма данной массы газа на его давление при неизменной температуре есть величина постоянная.
Изобразим графически изотермическое изменение состояния газа. Для этого по оси абсцисс будем откладывать значения объёмов газа, а по оси ординат соответствующие им значения давлений. Выберем масштаб так, чтобы начальные значения объёма и давления были равны 1. Тогда начальное состояние газа будет изображено точкой А (рис. 135). Если давление увеличится вдвое, объём уменьшится в два раза, состояние газа изобразится на графике точкой В. При уменьшении первоначального давления вдвое объём удвоится, получим точку С. Беря далее давления в три, четыре и т. д. раза больше или меньше начального, а объёмы соответственно в три, четыре и т. д. раза меньше или больше, получим ряд точек, изображающих различные состояния одной и той же массы газа при одинаковой температуре.
Рис. 135. График изотермического процесса.
Проведя через эти точки линию, получим кривую, которая называется изотермой.
Тщательными исследованиями установлено, что для реально существующих газов закон Бойля — Мариотта имеет лишь приближённое значение. Так, например, если произведение pV при 1 am равно единице, то при 2 am оно имеет следующие значения:
для воздуха ………………………0,99977
» водорода …………………….. 1,00026
» окиси углерода………………….. 0,99974
» двуокиси углерода………………… 0,99720
При очень больших давлениях (в сотни и тысячи атмосфер) закон Бойля — Мариотта становится совершенно неприменимым; в таких случаях зависимость между объёмом и давлением газа выражается более сложными уравнениями.
Зависимость между плотностью газа и его давлением
Плотность газа численно равна массе, заключённой в единице объёма.
Масса газа не меняется при его сжатии или расширении, но объём меняется; следовательно, меняется и плотность газа.
Пусть при постоянной температуре: D1 — плотность газа при объёме V1 и давлении p1 , a D2 — плотность газа при объёме V2 и давлении p2.
Если масса газа равна m, то можно написать:
откуда:
Но 
При постоянной температуре плотность газа прямо пропорциональна его давлению.
Нетрудно понять справедливость этого вывода, исходя из молекулярно-кинетической теории. В самом деле, давление газа обусловлено ударами его молекул. Если объём газа уменьшится вдвое, то в новом объёме , плотность газа станет вдвое больше. Вдвое увеличится и число ударов молекул о стенки, т. е. давление газа возрастёт в два раза.
Зависимость объёма газа от температуры. Закон Гей-Люссака
Как и все тела, газы при нагревании расширяются, причём весьма заметно даже при незначительном нагревании. Это легко обнаружить на следующем простом опыте (рис. 136).
Рис. 136. Установка для наблюдения расширения газа при нагревании.
Колба А соединяется с расположенной горизонтально трубкой CD, которая укреплена вдоль шкалы. Внутри этой трубки находится небольшой столбик ртути. Достаточно к колбе прикоснуться рукой, как столбик ртути в трубке CD начнёт двигаться.
При охлаждении колбы столбик ртути перемещается влево, а при нагревании — вправо; следовательно, газ при охлаждении сжимается, а при нагревании расширяется. Зная объём колбы и диаметр трубки, можно измерить увеличение объёма газа.
Постепенно нагревая газ в колбе, можно установить, что при постоянном давлении изменение объёма данной массы газа пропорционально изменению температуры. Поэтому тепловое расширение газа, так же как и других тел, можно охарактеризовать при помощи коэффициента объёмного расширения.
Пусть при температуре 0°С объём газа равен V0 , а при температуре t объём Vt. Увеличение объёма, приходящееся на каждую единицу объёма, взятого при 0°С, при нагревании на один градус будет равно:
откуда: 
Величина 
Жозеф Луи Гей-Люссак (1778—1850)— один из выдающихся французских химиков и физиков. Он открыл ряд важных химических и физических законов, из которых в физике широко известен закон одинакового расширения газов и паров при одинаковом повышении температуры.
Французский учёный Гей-Люссак, исследуя на опыте тепловое расширение газов, открыл, что, коэффициент объёмного расширения у всех газов при постоянном давлении одинаков и численно равен
В этом отношении расширение газов при нагревании отличается от расширения твёрдых и жидких тел, где, как мы видели (см. § 81 и 82), коэффициент объёмного расширения зависит от химического состава тел.
Положим в формуле (1):
получим: 

Этот закон получил название закона Гей-Люссака. Процессы, подобные рассмотренному, протекающие при постоянном давлении, называются изобарными1.
1 От греч. слов: изос — равный, барос — тяжесть, вес.
Формула (1) показывает, что объём газа при температуре t° равен произведению его объёма, взятого при 0°С, на двучлен объёмного расширения
Пример. 1. Объём некоторой массы газа при 0°С равен 10 л. Найти объём его при t=273°С, если давление постоянно.
По условиям задачи нам известен объём газа при 0°С, т. е. V0 = 10 л; подставляя числовые данные задачи в формулу 
Пример 2. При температуре 273°С объём некоторой массы газа равен 10 л. Чему будет равняться объём этого газа при температуре 546°С, если давление постоянно?
Нам известен объём газа при температуре 273°С; чтобы определить объём этого газа при t2 = 546°С, надо предварительно найти его объём при 0°.
Этот объём найдётся из равенства:
откуда:
Найдём теперь объём газа при 546°:
Зависимость давления газа от температуры. Закон Шарля
Нагревая газ в закрытом цилиндре, например в папиновом котле (рис. 136а), можно по манометру заметить, что давление газа увеличивается. Следя по термометру за повышением температуры, легко установить, что при постоянном объёме давление газа возрастает пропорционально повышению температуры.
Рис. 136а. При нагревании газа в закрытом цилиндре давление его повышается.
Аналогично тому, как для характеристики теплового расширения газов мы ввели коэффициент объёмного расширения, введём величину, характеризующую изменение давления газа при изменении его температуры.
Обозначим буквой р0 давление газа при 0°С, a pt — давление при t°. Увеличение давления, приходящееся на каждую единицу начального давления при нагревании на 1°С, будет равно:

Величина 
Измерения показывают, что величина термического коэффициента давления для всех
газов одинакова и равна
Определяя из формулы (1) величину pt получим:

Положим в формуле (2) 
Отсюда следует, что давление данной массы газа при нагревании на 1° при постоянном объеме увеличивается на 
Этот закон называется законом Шарля, по имени французского учёного, открывшего его в 1787 г.
Из закона Шарля следует, что термический коэффициент давления газа 

Пусть некоторая масса газа заключена в цилиндре под поршнем (рис. 137, а) и пусть температура её в этом начальном состоянии равна 0°, объём V0 и давление р0. Закрепим поршень АВ и нагреем газ до температуры t° (рис. 137, б); тогда давление газа увеличится и станет равным рt объём же его останется прежним.
По закону Шарля:
Будем теперь газ нагревать от 0 до t° (рис. 137, в), предоставив поршню свободно перемещаться. Давление газа останется таким же, каким было в начальном его состоянии, т. е. р0 , объём же увеличится до Vt. По закону Гей-Люссака:
Рис. 137.
а) начальное состояние газа: 0°, V0, р0;
б) состояние газа, определяемое величинами:
в) состояние газа, определяемое величинами:
Итак, имеем: при температуре t° объём данной массы газа V0 и давление 

После упрощения этого выражения получаем равенство:
Выразим сначала в виде таблицы, а потом графически зависимость давления газа от температуры. Для этого воспользуемся уравнением:
Рис. 138. График изменения давления газа от температуры.
Отложим по оси абсцисс в некотором условном масштабе температуры газа, а по оси ординат соответствующие этим температурам давления, взятые из написанной выше таблицы.
Соединяя на графике отмеченные точки, получим прямую LM (рис. 138), представляющую собой график зависимости давления газа от температуры при постоянном объёме.
Процесс изменения состояния газа, происходящий при неизменном объёме газа, называется изохорным 1 процессом, а линия LM, изображающая изменение давления газа при постоянном объеме в зависимости от температуры, называется изохорой.
1 От греч. слов: изос — разный, хорема — вместимость.
Пример 1. Давление газа при 0°С равно 780 мм рт. ст. Определить давление этого газа при температуре 273°С.
По формуле 
Пример 2. Чему будет равно давление газа при температуре 546°, если давление его при температуре 273° равно 780 мм рт. cm.?
В этой задаче прежде всего надо определить давление газа при 0°С. По формуле 
Теперь можно определить давление газа при t = 546°:
Законы Гей-Люссака и Шарля так же, как и закон Бойля — Мариотта, лишь приближённо отражают свойства газов. Это можно видеть хотя бы. из того факта, что для разных газов величины 


Точные измерения показывают, что для каждого данного газа значения 

Абсолютная шкала температур
Вернёмся ещё раз к графику изменения давления газа с температурой (рис. 138).
Продолжим прямую LM на этом графике до пересечения её с горизонтальной осью, по которой откладываются температуры газа, она пересечёт эту ось в точке K. Отрезок ОК будет изображать на этом графике такую температуру газа, при которой давление его равно нулю. Чему равна эта температура?
Обратимся к уравнению 
Так как давление газа при 0°С не равно нулю 
откуда: 
Итак, давление газа равняется нулю при температуре —273°С.
Вильям Томсон (Кельвин) (1824— 1907) — выдающийся английский физик. Ему принадлежат важные открытия в области теории электричества и теплоты и изобретения, из которых наиболее значительным было усовершенствование телеграфной связи. Он ввёл в физику понятие об абсолютной температуре. Его именем названы градусы шкалы абсолютных температур — градусы Кельвина.
Английский учёный Вильям Томсон (Кельвин) предложил такую шкалу температур, при которой за нуль градусов принята температура — 273°. Эта шкала получила название абсолютной шкалы температур, или шкалы Кельвина, а нуль градусов этой шкалы, равный — 273°, называется абсолютным нулём температур.
В шкале Кельвина величина градуса та же, что и в стоградусной шкале.
Будем обозначать температуру по шкале Кельвина буквой Т.
При нормальном атмосферном давлении температура таяния льда по шкале Кельвина Т0 = 273°, температура же кипения воды T = 373°.
Всякая другая температура t° стоградусной шкалы связана с абсолютной температурой Т соотношениями:
Зависимость между объёмом, давлением и температурой газа
Объединённый закон газового состояния. Мы рассмотрели процессы, в которых одна из трёх величин, характеризующих состояние газа (объём, давление и температура), не меняется.
Вы видели, что если не меняется температура, то давление и объём газа связаны друг с другом законом Бойля —- Мариотта. При постоянном давлении объём газа изменяется с изменением температуры по закону Гей-Люссака, и, наконец, при постоянном объёме давление газа меняется с изменением температуры по закону Шарля.
Однако в природе часто имеют место процессы, когда одновременно меняются все три величины, характеризующие состояние газа. Установим теперь, какая связь существует между объёмом, давлением и температурой.
Пусть для двух каких-либо произвольных состояний некоторой массы газа эти величины будут:
Из этих состояний изменением величин р, V или t газ можно перевести в любые другие состояния. Будем, например, сохраняя постоянным давление, переводить газ из состояний 1) и 2) в состояния, при которых температура газа будет равна 0°С.
По закону Гей-Люссака объём газа V1 после уменьшения температуры от до 0° будет равен 
Новые состояния газа выразятся так:
В обоих этих состояниях температура газа одинакова, поэтому на основании закона Бойля — Мариотта можно написать:

Так как величины р, V, t, характеризующие состояние рассматриваемого газа и обозначенные индексами 1 и 2, выбраны были нами произвольно, то равенство (1) справедливо для любых состояний этого газа. Поэтому можно утверждать, что:

Для данной массы газа произведение давления газа на его объём, делённое на двучлен объёмного расширения, есть величина постоянная.
Выведенная нами зависимость между объёмом, давлением и температурой газа называется объединённым законом газового состояния, а равенство (1) или (2) — уравнением состояния газа.
Уравнение состояния газа можно упростить, введя в него вместо температуры t по стоградусной шкале температуру Т по абсолютной шкале температур. Для этого преобразуем уравнение:
Введя в него значение 
что после сокращения на 273 даст:
Но 

Это означает, что для данной массы газа произведение давления на объём, делённое на абсолютную температуру, постоянно при всех температурах:
В частности, если при температуре Т = 273° объём газа равен V0 и давление его р0 , то можно написать:
Физическая сущность понятия абсолютного нуля
Мы уже отмечали, что реальные газы лишь приближённо следуют законам Гей-Люссака, Шарля и Бойля — Мариотта. Однако можно представить себе газ, для которого эти законы выполнялись бы в точности. Молекулы такого газа можно представить себе в виде упругих шариков исчезающе малого объёма, взаимодействие между которыми осуществляется только через их столкновения друг с другом. В физике такой газ принято называть идеальным газом.
Из уравнения 
Опыт показывает, что при малых давлениях свойства реальных газов очень близки к свойствам идеального газа. Следовательно, при приближении к температуре абсолютного нуля должно прекратиться тепловое движение молекул и реального газа. Этот вывод относится не только к газам, но и к твёрдым и жидким телам.
Физикой установлено, что такое состояние вещества недостижимо, но к нему можно подойти очень близко. В настоящее время достигнута температура, которая выше абсолютного нуля всего на несколько стотысячных долей градуса.
Изменение температуры газа при быстром расширении и сжатии
Опыты показывают, что при быстром сжатии температура газа повышается, а при быстром расширении понижается.
Увеличение температуры газа при сжатии можно показать на следующем простом опыте. Возьмём толстостенный цилиндрический стеклянный сосуд, внутри которого может двигаться поршень (рис. 139). При быстром сжатии воздух в сосуде сильно нагревается, и легко воспламеняющееся вещество (например, ватка, смоченная эфиром), положенное на дно сосуда, вспыхивает. Такого рода явление используется, например, в двигателях внутреннего сгорания —дизелях: при сжатии воздуха в цилиндре двигателя горючая смесь, введённая в цилиндр, нагревается до температуры воспламенения (работа двигателя описана в § 131).
Рис. 139. При быстром сжатии воздух в цилиндре сильно нагревается и легко воспламеняющееся вещество вспыхивает.
При быстром же расширении газа температура его понижается. Это можно наблюдать на следующем опыте. Будем накачивать воздух в прочную закрытую пробкой стеклянную банку, содержащую пары воды. При достижении определённого давления пробка выскочит; при этом воздух, расширяясь, совершит работу и охладится, вследствие чего водяной пар превратится в туман (рис. 140).
Рис. 140. Сжатый в сосуде воздух, выбрасывая пробку, расширяется. Совершая при этом работу, он охлаждается, вследствие чего водяной пар в сосуде превращается в туман.
Понижение температуры при быстром расширении газа используется для получения сжиженных газов; об этом будет рассказано в § 122.
Изменение температуры тела, как было установлено в § 71, связано с изменением внутренней энергии тела. Так как при быстром сжатии температура газа повышается, то внутренняя энергия его при этом увеличивается. Увеличение внутренней энергии газа происходит в результате работы, совершённой при его сжатии. Расширяясь же, газ совершает работу; при этом внутренняя энергия его уменьшается, и если расширение происходит быстро, то температура газа, как мы видели в наших опытах, понижается.
Процесс, происходящий в теле без теплообмена с окружающими его другими телами, называется адиабатным процессом.
Все быстро протекающие процессы практически могут считаться адиабатными.
Применение сжатых газов
Многие сжатые газы в настоящее время находят широкое применение в технике.
Сжатый воздух, например, применяется в работе различных пневматических инструментов: отбойных молотков, заклёпочных молотков, в разбрызгивателях краски и др.
На рисунке 141 показана схема устройства отбойного молотка. Сжатый воздух подаётся в молоток по шлангу М. Золотники Z, аналогичные применяемым в паровых машинах, направляют его поочерёдно то в заднюю, то в переднюю часть цилиндра. Поэтому воздух давит на поршень Р то с одной, то с другой стороны, что вызывает быстрое возвратно-поступательное движение поршня и пики молотка В. Последняя наносит быстро следующие друг за другом удары, внедряется в уголь и откалывает куски его от массива.
Рис. 141. Схема устройства отбойного молотка.
Существуют также пескоструйные аппараты, которые дают сильную струю воздуха, смешанную с песком. Эти аппараты применяются, например, для очистки стен. Сейчас нередко можно видеть работу специальных аппаратов, применяемых для окраски стен, где краска распыляется сжатым воздухом. Сжатым воздухом открываются двери вагонов метро и троллейбусов. Сжатый воздух используется в работе тормозов на транспорте. Схематическое устройство одного из видов пневматического тормоза железнодорожного вагона изображено на рисунке 142.
Компрессор подаёт воздух по магистрали в стальной резервуар А. Поршень В тормозного цилиндра оказывается под одинаковым давлением справа и слева; поэтому соединённая с ним тормозная колодка D отжата от колеса. Если открыть тормозной кран М, то находящийся в магистрали под давлением воздух устремится в атмосферу; клапан К захлопнется, и, таким образом, стальной резервуар изолируется от магистрали. Теперь давление на поршень В справа станет больше, чем давление слева, вследствие чего тормозная колодка прижмётся к ободу колеса. Если теперь кран М закрыть и снова подать в магистраль сжатый воздух, то восстановится первоначальное положение.
Рис. 142. Схема устройства железнодорожного пневматического тормоза.
В технике применяется не только сжатый воздух, но и некоторые другие газы, так, например, водород, ацетилен и кислород применяются при газовой сварке; аммиак используется в холодильном деле. Чтобы газы было удобно перевозить, их помещают в прочные стальные баллоны, накачивая до давления 60—200 am.
Рис. 142а. Внешний вид мощного компрессора.
Сжатие газов осуществляется с помощью мощных нагнетательных насосов — компрессоров.
На рисунке 143, а, б дана схема работы компрессора.
Компрессор состоит из цилиндра с поршнем и двумя клапанами; один из них входной, другой выходной. При движении поршня вниз (рис. 143, б) открывается входной клапан и в цилиндр поступает воздух из помещения; при движении поршня вверх (рис. 143, а) входной клапан закрывается, вошедший воздух сжимается поршнем и через выходной клапан поступает в стальной баллон для хранения сжатого газа.
Существуют так называемые многоступенчатые компрессоры, в которых газ последовательно
сжимается в трёх или четырёх цилиндрах. Такие компрессоры позволяют получить газ, сжатый до давления в тысячи атмосфер. На рисунке 142а изображён внешний вид одного из типов многоступенчатых компрессоров.
Рис. 143, а, б. Схема работы компрессора.
Услуги по физике:
- Заказать физику
- Заказать контрольную работу по физике
- Помощь по физике
Лекции по физике:
- Физические величины и их измерение
- Основные законы механики
- Прямолинейное равномерное движение
- Прямолинейное равнопеременное движение
- Сила
- Масса
- Взаимодействия тел
- Механическая энергия
- Импульс
- Вращение твердого тела
- Криволинейное движение тел
- Колебания
- Колебания и волны
- Механические колебания и волны
- Бегущая волна
- Стоячие волны
- Акустика
- Звук
- Звук и ультразвук
- Движение жидкости и газа
- Молекулярно-кинетическая теория
- Молекулярно-кинетическая теория строения вещества
- Молекулярно — кинетическая теория газообразного состояния вещества
- Теплота и работа
- Температура и теплота
- Термодинамические процессы
- Идеальный газ
- Уравнение состояния идеального газа
- Изменение внутренней энергии
- Переход вещества из жидкого состояния в газообразное и обратно
- Кипение, свойства паров, критическое состояние вещества
- Водяной пар в атмосфере
- Плавление и кристаллизация
- Тепловое расширение тел
- Энтропия
- Процессы перехода из одного агрегатного состояния в другое
- Тепловое расширение твердых и жидких тел
- Свойства жидкостей
- Свойства твёрдых тел
- Изменение агрегатного состояния вещества
- Тепловые двигатели
- Электрическое поле
- Постоянный ток
- Переменный ток
- Магнитное поле
- Электромагнитное поле
- Электромагнитное излучение
- Электрический заряд (Закон Кулона)
- Электрический ток в металлах
- Электрический ток в электролитах
- Электрический ток в газах и в вакууме
- Электрический ток в полупроводниках
- Электромагнитная индукция
- Работа, мощность и тепловое действие электрического тока
- Термоэлектрические явления
- Распространение электромагнитных волн
- Интерференционные явления
- Рассеяние
- Дифракция рентгеновских лучей на кристалле
- Двойное лучепреломление
- Магнитное поле и электромагнитная индукция
- Электромагнитные колебания и волны
- Природа света
- Распространение света
- Отражение и преломление света
- Оптические приборы и зрение
- Волновые свойства света
- Действия света
- Линзы и получение изображений с помощью линз
- Оптические приборы и глаз
- Фотометрия
- Излучение и спектры
- Квантовые свойства излучения
- Специальная теория относительности в физике
- Теория относительности
- Квантовая теория и природа поля
- Строение и свойства вещества
- Физика атомного ядра
- Строение атома
Онлайн калькулятор поможет рассчитать какое будет конечное давления идеального газа от изменения температуры, при условии, что объем газа остается постоянным. Зависимость давления от температуры в этом случае описывается законом Гей-Люссака (законом Шарля).
Формула: P2 = P1×T2/T1
Где:
P1 — начальное давление;
P2 — конечное давление;
T1 — начальная температура (в Кельвинах);
T2 — конечная температура (в Кельвинах).
Например, данный калькулятор поможет приблизительно определить зависимость давления в шинах от температуры.
×
Пожалуйста напишите с чем связна такая низкая оценка:
×
Для установки калькулятора на iPhone — просто добавьте страницу
«На главный экран»
Для установки калькулятора на Android — просто добавьте страницу
«На главный экран»
Смотрите также
Давление газа
Содержание:
- Давление газа — что это за параметр
- Причина возникновения давления в газах
- Формула давления идеального газа из молекулярно-кинетической теории
- Второй способ записи основного уравнения МКТ
Давление газа — что это за параметр
Определение
Давление в физике представляет собой один из трех ключевых термодинамических макроскопических характеристик для измерения любой газовой системы.
Определение
Газ — это одно из четырех, включая плазму, агрегатных состояний материи, характеризующееся очень слабыми связями между составляющими его частицами, а также их большой подвижностью.
В газообразной среде частицы в определенной концентрации расположены не упорядоченно и перемещаются в хаотичном порядке в разных направлениях с одинаковой вероятностью. Подобное строение не позволяет газам сохранять стабильность объема и формы даже при малом внешнем силовом воздействии. Для любого газа, включая одноатомный, значение средней кинетической энергии его частиц в виде атомов и молекул будет превышать энергию межмолекулярного взаимодействия между ними.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Кроме того, расстояние, на которое удалены частицы, значительно превышает их собственные размеры. В том случае, когда молекулярными взаимодействиями и габаритами частиц допускается пренебрегать, газ считают идеальным. Для такой формы материи характерен только один тип внутреннего взаимодействия в виде упругих столкновений. Так как размер частиц пренебрежимо мал по сравнению с расстоянием, на которое они удалены, вероятность столкновений частиц между собой будет низкой.
Примечание
По этой причине в идеальной газовой среде можно наблюдать лишь столкновения частиц со стенками сосуда. Какой-либо реальный газ с хорошей точностью можно отнести к идеальному, когда их температура выше, чем комнатная, а давление несущественно больше, чем атмосферное.
Причина возникновения давления в газах
Давление газа нельзя объяснить теми же причинами, что и давление твердого тела на опору. Расстояние, на которое удалены молекулы газообразной среды, существенно больше. В результате хаотичного движения они сталкиваются между собой и со стенками сосуда, который они занимают. Давление газа на стенки сосуда и вызвано ударами его молекул.
Данный параметр увеличивается по мере того, как нарастает сила ударов молекул о стенки. Газ характеризуется одинаковым давлением во всех направлениях, которое является следствием хаотичного движения огромного числа молекул.
Примечание
Важно отметить, что газ оказывает давление на дно и стенки сосуда, объем которого он занимает, во всех направления равномерно. В связи с этим, воздушный шарик сохраняет форму, несмотря на то, что его оболочка достаточно эластична.
Перед тем как транспортировать или отправить на хранение газообразные вещества, их сильно сжимают. В этом случае давление газа увеличивается. Его помещают в специальные баллоны из стали высокой прочности. Такие емкости необходимы для хранения сжатого воздуха на подводных лодках и кислорода, предназначенного для сварки металлов.
Свойства давления газа:
- Если объем уменьшается, то давление газа возрастает, а во время увеличения объема, давление будет снижаться при постоянных величинах массы и температуры вещества.
- Газ, находящийся в закрытом сосуде, характеризуется давлением, которое возрастает по мере увеличения температуры вещества при условии постоянства его массы и объема.
- В том случае, когда масса газа увеличивается, его давление также будет возрастать и наоборот.
Запись формул для определения давления газа начинают с выяснения причин, по которым оно возникает в рассматриваемой системе. Исходя из физического смысла, давление представляет собой величину, равную отношению силы, перпендикулярно воздействующей на некоторое основание, к площади этого основания:
(P=frac{F}{S})
Как было отмечено ранее, для идеальной газовой системы характерен лишь один тип взаимодействия — это абсолютно упругие столкновения. В процессе частицы передают количество движения Δp стенкам сосуда в течение времени соударения Δt. В данном случае применим второй закон Ньютона:
(F*Δt = Δp)
Таким образом, конкретно сила F является причиной формирования давления на стенки сосуда. Данная величина F, производимая одной частицей, незначительна. Однако, когда количество частиц огромно, они в совокупности создают ощутимый эффект, проявляемый в виде наличия давления в сосуде.
Формула давления идеального газа из молекулярно-кинетической теории
Объяснение концепции идеального газа построено на основных положениях молекулярно-кинетической теории, которая вытекает из принципов статистической механики. Наука получила активное развитие во второй половине XIX, благодаря таким ученым, как Джеймс Максвелл и Людвиг Больцман. Основы дисциплины были заложены еще Бернулли в первой половине XVIII века.
Исходя из статистики Максвелла-Больцмана, все частицы в системе обладают разными скоростями движения. При этом можно наблюдать небольшой процент частиц со скоростями, приближенными к нулю, и малую долю частиц, обладающих огромной скоростью. Средняя квадратичная скорость в этом случае будет соответствовать некоторой величине, не изменяющейся с течением времени.
Средняя квадратичная скорость частиц однозначно характеризует температуру газа. Используя приближения молекулярно-кинетической теории в виде невзаимодействующих безразмерных и хаотично движущихся частиц, получают формулу для расчета давления газа в сосуде:
(P=frac{N*m*v^{2}}{3*V})
где N является количеством частиц в системе; V обозначает объем; v представляет собой среднюю квадратичную скорость; m является массой одной частицы.
При наличии указанных в формуле параметров, выраженных в единицах СИ, можно вычислить давление газа в сосуде.
Второй способ записи основного уравнения МКТ
Определение
В середине 30-х годов XIX столетия французскому инженеру Эмилю Клапейрону удалось обобщить накопленный до этого времени экспериментальный опыт изучения поведения газов во время разнообразных изопроцессов и получить формулу, которую в будущем назвали универсальным уравнением состояния идеального газа:
(P*V = n*R*T )
n является количеством вещества в молях; T представляет собой температуру по абсолютной шкале и обозначается в кельвинах.
Величина R является универсальной газовой постоянной. Этот термин был введен в уравнение русским химиком Д.И. Менделеевым. Исходя из этого, запись уравнения называют законом Клапейрона-Менделеева.
Определение
С помощью данного выражения можно определить формулу для расчета давления газа:
(P=frac{n*R*T}{V})
Полученное уравнение объясняет линейный рост давления при увеличении температуры в условиях стабильности объема. Если объем уменьшается с сохранением температуры, то давление увеличивается по гиперболе. Данные закономерности явления отражены в законах Гей-Люссака и Бойля-Мариотта.
Сравнивая представленное выражение с записью формулы, которая вытекает из положений молекулярно-кинетической теории, можно установить связь кинетической энергии одной частицы, либо системы в общем, и абсолютной температуры.
Важно отметить, что при расчетах с использованием формулы для Р, вытекающей из уравнения Клапейрона, связь с химическим составом газа отсутствует. Если давление определяют с помощью выражения, согласно понятию молекулярно-кинетической теории, то данную связь следует учитывать в виде параметра m. В том случае, когда определяют давление смеси идеальных газов, применяют один из следующих методов:
- Расчет средней массы частиц m, либо среднего значения молярной массы М с учетом атомных процентов каждого газа в смеси.
- Применение закона Дальтона, согласно которому давление в системе равно сумме парциальных давлений всех ее компонентов.
Пример
Предположим, что молекулы кислорода движутся со средней скоростью в 500 м/с. Требуется рассчитать, каково давление в сосуде, объем которого равен 10 литров, содержащий 2 моль молекул.
Для того чтобы найти ответ, следует применить формулу для Р из молекулярно-кинетической теории:
(P=frac{N*m*v^{2}}{3*V})
Из-за неизвестных параметров m и N требуется выполнить некоторые преобразования формулы:
(m=frac{M}{NA})
(n=frac{N}{NA})
(m*N= M*n)
(P=frac{M*n*v^{2}}{3*V})
Таким образом, удельный объем сосуда в кубических метрах равен 0,01. Молярная масса молекулы кислорода М составляет 0,032 кг/моль. Данные параметры можно подставить в уравнение вместе со скоростью и количеством вещества. Тогда Р = 533333 Па, что представляет собой давление в 5,3 атмосферы.
Давление смеси газов равно сумме их парциальных давлений.
p = p1’ + p2’ + … .
К примеру, давление воздуха складывается из давления азота, кислорода, углекислого газа, водяного пара и т. д.
Определение
Парциальное давление — давление, которое производил бы данный газ, если бы другие газы отсутствовали.
Применение закона Дальтона при решении задач
Самая популярная задача на закон Дальтона, это случай, когда газы находятся в сосудах, соединенных трубкой с краном. По условию этой задачи нужно найти давление, которое установится после того, как этот кран будет открыт.
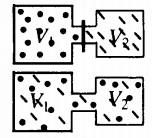
После открытия крана первый и второй газы заполнят оба сосуда. Используем закон Бойля — Мариотта для первого газа (так как температура остается постоянной):
Этот же закон можем применить для второго газа. Тогда мы получим:
Применим закон Дальтона и получим:
Пример №1. Два сосуда соединены трубкой с краном. Определить давление, которое установится после того, как кран будет открыт. Считать, что объем второго сосуда в 1,5 раза больше первого. Давление во втором сосуде составляет половину от атмосферного давления. В первом сосуде оно меньше в 4 раза.
Проанализируем условия задачи и запишем:
V2 = 1,5V1
p2 = 4p1
p2 = 105 Па
Теперь можем применить выведенную ранее формулу:
Преобразуем выражение и найдем установившееся давление:
Задание EF17512
Три одинаковых сосуда, содержащих разреженный газ, соединены друг с другом трубками малого диаметра: первый сосуд – со вторым, второй – с третьим. Первоначально давление газа в сосудах было равно соответственно р, 3р и р. В ходе опыта сначала открыли и закрыли кран, соединяющий второй и третий сосуды, а затем открыли и закрыли кран, соединяющий первый сосуд со вторым. Как изменилось в итоге (уменьшилось, увеличилось или осталось неизменным) количество газа в первом сосуде? (Температура газа оставалась в течение всего опыта неизменной.)
Алгоритм решения
1.Записать исходные данные.
2.Применить закон Дальтона для определения давления в первом сосуде.
3.Применить закон Менделеева — Клапейрона для установления характера изменения количества газа в первом сосуде в ходе эксперимента.
Решение
Запишем исходные данные:
• Объемы сосудов равны: V1 = V2 = V3 = V.
• Температуры равны: T1 = T2 = T3 = T.
• Давления распределены следующим образом: p1 = p, p2 = 3p, p3 = p.
После того, как открыли кран между 2 и 3 сосудом, объем возрос вдвое, и давление распределилось по нему равномерно. Согласно закону Дальтона, оно стало равным сумме давлений, оказываемых газами в количестве вещества ν2 и ν3. Так как объем после открытия крана увеличивается вдвое, то парциальное давление каждого из количества вещества равно половине исходного давления:
p23=p2+3p2=2p
Потом кран 2–3 закрыли, но открыли кран 1–2. Применим закон Дальтона, получим:
p12=2p2+p2=3p2
Теперь применим закон Менделеева — Клапейрона:
pV=νRT
Для начального состояния газа в 1 сосуде:
pV=ν1RT
Для конечного состояния газа в 1 сосуде:
3p2V=ν2RT
Так как температура и объем неизменны, но давление увеличилось в 1,5 раза, то и количество газа в первом сосуде увеличилось в 1,5 раза.
Ответ: Увеличилось
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18873

Для каждой величины определите соответствующий характер изменения:
- увеличилась
- уменьшилась
- не изменилась
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Алгоритм решения
1.Записать исходные данные.
2.Установить характер изменения парциального давления неона.
3.Применить закон Менделеева — Клапейрона, чтобы установить характер изменения общего давления смеси газов.
Решение
Исходные данные:
• Количество неона: ν1 = 1 моль.
• Количество аргона: ν2 = 1 моль.
• Количество впущенного аргона: ν4 = 1 моль.
Сначала парциальное давление неона и аргона равно. Это объясняется тем, что давление газов при неизменном количестве вещества зависит только от объема и температуры. Эти величины постоянны.
Когда из сосуда выпустили половину газовой смеси, в нем оказалось по половине моля каждого из газов. Затем в сосуд впустили 1 моль аргона. Следовательно, в сосуде стало содержаться 0,5 моль неона и 1,5 моль аргона. Запишем уравнение Менделеева — Клапейрона:
pV=νRT
Из уравнения видно, что давление и количество вещества — прямо пропорциональные величины. Следовательно, если количество неона уменьшилось, то его парциальное давление тоже уменьшилось.
Общая сумма количества вещества равна сумме количеств вещества 1 (неона) и 2 (аргона): 0,5 + 1,5 = 2 (моль). Изначально в сосуде тоже содержалось 2 моль газа. Так как количество вещества, температура и объем сохранились, давление тоже осталось неизменным.
Ответ: 23
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 3.5k
План урока:
Можно ли бежать по снегу?
Способы изменения давления
Давление газа
Закон Паскаля
Давление жидкости
Сообщающиеся сосуды
Можно ли бежать по снегу?
В соревнованиях, когда одна команда бежит на лыжах по рыхлому снегу, а другая без лыж победит, конечно же, команда с лыжами. Все дело в лыжах. Когда человек стоит на лыжах, его вес равномерно распределяется по всей площади лыж. Нетрудно сравнить площадь двух лыж и площадь подошв обуви.
Площадь лыж больше площади подошв. Если одинаковый вес человека распределить на разные площади, получится, что каждой единице площади лыж достанется веса меньше, чем такой же единице площади подошв. (Чтобы лучше понять это, надо представить простую ситуацию: на разные по размерам куски хлеба намазать по одинаковому количеству сливочного масла. На маленьком куске хлеба получится толстый слой масла, а на большом — масло размажется очень тонко).
Сила, которая давит на длинные лыжи и небольшие подошвы – это вес человека. А вот сила, которая приходится на единицу площади лыжи или подошвы – это уже не полный вес человека, а лишь маленькая часть этого веса. Эту силу в физике называют давлением.
Значит, команда на лыжах выиграла, так как оказывала на снег меньшее давление, и передвигаться ей, не проваливаясь, было легче.
Нужно отличать давление от силы давления. В примере в роли силы давления выступает вес человека, а давление – это часть веса, которая достается единице площади.
Давление принято обозначать буквой p (маленькая латинская буква) и находить по правилу:
p = F/S.
Достаточно понятная формула: «силу давления F разделить (распределить) на площадь S».
Источник
Давление измеряют и другими единицами:
Источник
Давление оказывают тела не только своим весом. Когда, например, режут хлеб или сыр на части, то нож разрезает продукты под действием мышечной силы руки.
Зная давление, можно найти силу, которая действует на поверхность:
F = p ∙ S
Способы изменения давления
Жарким летним днем, когда асфальт будто плавится, на нем остаются следы.
Какая обувь оставляет самые заметные, глубокие следы? Несомненно, ответ прост: это шпильки женских туфель. Маленькая площадь, следовательно, большое давление – и видимый результат.
Иногда давление необходимо сделать большим, иногда — маленьким.
Большое давление нужно там, где имеют дело с режущими и колющими инструментами. Необходимо, чтобы они были остро заточены, чтобы площадь соприкосновения была минимальной. Если нажать посильнее, то можно получить огромные давления. Резец токарного станка срезает стружку, оказывая давление на деталь 2,45 ∙ 109 Па.
Источник
В рукопашном бое востока преобладают колющие и рубящие удары пальцами рук, ног и ребром ладони. Обладая маленькой массой, можно нанести резкий болевой удар, ведь площадь кончиков пальцев или ребра ладони значительно меньше площади всей ладони или кулака. А значит, при одинаковой силе можно оказать большее давление на место удара.
А какое давление оказывает лезвие из дамасской стали, если легкая шелковая лента, упав на саблю, перерезается пополам!
В тех случаях, когда давление должно быть маленьким, сила должна быть тоже небольшой, а это в современных технологиях встречается редко. Тогда для уменьшения давления нужно увеличить площадь опоры.
Гусеницы тракторов, вездеходов значительно уменьшают давление на почву (всего 40 — 50 кПа), поэтому этот вид транспорта хорошо проходим даже в условиях болота. Для сравнения давление, которое оказывают колеса легкового автомобиля на дорогу равно 200 – 300 кПа, причем вес автомобиля значительно меньше, чем у трактора. Человек для прохождения по болотистой почве применяет специальные болотоходы, а по снегу – снегоходы.
Для того, чтобы дома и другие строения не давали осадку, необходимо под них подводить широкий фундамент (увеличение площади). Известная всему миру Останкинская башня, высотой 533 м, давит своим фундаментом на землю всего в 270 кПа (как легковой автомобиль). Таким же фундаментом для железнодорожных рельсов являются шпалы, уменьшающие давление вагонов на рельсы.
Для похода лучше выбирать рюкзак с широкими лямками, даже не нужно объяснять, почему.
Животным природа подарила возможность учитывать и использовать давление:
- клыки (хищники легко разрывают ими мясо);
- когти (кошки свободно забираются на дерево, спасаясь от собаки);
- острые зубы (пираньи – хищные рыбы пресных вод в считанные секунды обгладывают свои жертвы):
- клювы (дятел быстро долбит кору деревьев, находя там жучков для еды);
- острые носы (комар мгновенно протыкает кожу людей и животных и высасывает кровь);
Приведенные примеры говорят о том, как животные приспособились к борьбе за существование.
Итак, давление учитывает и человек, и природа, стремясь держать его большим или маленьким в нужных случаях.
Давление газа
Воздушные шары и мыльные пузыри знакомы всем взрослым и детям. Это обязательный атрибут игр или праздников. А как получить такой шарик? Он наполняется воздухом, который человек вдувает в шарик при выдохе. С каждым выдохом шарик растет все больше, и делается все более упругим. На резину шарика воздух давит, стараясь растянуть его в разные стороны. Силе давления противостоит сила упругости деформированного шарика, и нужно вовремя остановиться, иначе сила давления перерастет силу упругости, произойдет громкий хлопок – шарик лопнет.
Твердое тело весом давит на часть поверхности, на которой стоит (если ведро стоит на полу, то оно и давит только на пол), а газ действует во всех направлениях одинаково, поэтому мыльные пузыри имеют форму шара. Форму воздушного шара определяет резина, из которой он изготовлен. Если резина везде одинакова, то шар будет круглым. Если резина имеет в разных частях шара разную упругость, то и шар надуется по-разному, и будет иметь заданную форму.
Молекулы газообразного вещества мечутся беспорядочно и хаотично, но такой хаос большого количества частиц обеспечивает некий порядок: в любых направлениях зигзагообразными траекториями движется примерно одинаковое количество молекул. Суммарная сила удара сразу всех молекул, действующая на единицу площади, и образует давление газа.
Источник
Если накачивать насосом камеру велосипеда или мяча, то с каждым качком камера становится будто бы более твердой, потому что молекулы воздуха все прибывают и прибывают, сила суммарного удара по стенкам камеры становится все больше и больше. А значит, давление растет. Если воздух выходит, то камера на глазах «худеет», давление уменьшается. С ростом числа молекул связано увеличение массы газа, а уменьшение числа молекул ведет к уменьшению массы. Поэтому давление газа зависит от его массы, которую опытным путем гораздо легче определить, чем само давление.
С повышением температуры тела молекулы перемещаются быстрее. Чем выше скорость, тем сильнее молекулы ударяются о сосуд, в котором газ находится. Значит, чем температура выше, тем значительнее давление, оказываемое газом.
Еще интересный пример изменения давления. Надо взять бумажный пакет, надуть его и резко ударить по нему ладонью. Хлопок, и пакет разорван. Все очень быстро и просто, а ведь здесь произошли вполне объяснимые физические процессы. Кулек под ударом ладони сжимается, объем газа в нем становится меньше, количество молекул не увеличивается, но так как молекулы расположены плотнее, на единицу площади стенок их количество растет, что приводит к росту давления. Давление разрывает бумагу, резко вырвавшийся воздух является причиной звука в виде хлопка. Получается, давление газа связано и с объемом: давление становится больше с уменьшением объема газа, а если объем газа увеличивается, то давление его уменьшается.
И следующее. У разных газов молекулы различны по массе. С ростом молекулярной массы увеличивается ударная сила молекулы о поверхность, что приводит к росту давления. Поэтому различные газы в одном объеме, с одной и той же температурой оказывают неодинаковые давления.
Итак:
- давление газа определяется общими ударами большого числа молекул о поверхности, окружающие газ;
- если изменить количество молекул газа, его температуру или объем сосуда, в котором газ находится, то можно изменить давление этого газа;
- в одинаковых прочих условиях (число молекул, объем, температура) у различных газов давление неодинаково.
Закон Паскаля
Твердые тела, соприкасаясь с поверхностью, давят на нее перпендикулярно. Газы давят в различных направлениях. А как давят жидкости?
Молекулы жидкости, перемещаясь, долго не задерживаются на месте. Здесь они подобны молекулам газов. Различие лишь состоит в расстояниях между молекулами. Поэтому в жидкостях, как и газах, есть давление, которое действует в любых направлениях одинаково. Почему в ванной вода из крана течет одной струей, а эта же самая вода из душа течет большим количеством одинаковых струек? Если бы вместо душевого сита был шар с дырками, то вода лилась бы во все стороны, и даже вверх. Объясняет эти явления знаменитый закон Паскаля:
Источник
Закон Паскаля справедлив для газов тоже. Примером из жизни служит уже рассмотренное надувание воздушного шарика. Струю воздуха человек направляет прямо перед собой (он же не крутит головой, чтобы заполнить шар), а шар заполняется везде, во всех направлениях. Накачивая резиновую лодку ручным насосом, рыбак нажимает сверху вниз на насос, воздух же наполняет полностью всю форму лодки.
Этот закон давления нашел широчайшее применение в механизмах, использующих принцип работы гидравлического пресса (изобретен Б. Паскалем). Если нажать на маленький поршень S1 силой F1, давление получится p1 = F1/ S1. Это давление без изменения (по закону Паскаля) будет передаваться во всех направлениях и дойдет до поршня S2. Значит, там давление p2 = F2/S2 такое же. p1 = p2, то есть F1/ S1 = F2/S2.
Используя математику, из этого равенства можно получить следующее: F1/F2 = S1/S2. Это равенство выражает закон гидравлического пресса (гидравлический — водяной или жидкостный). Оно означает: действуя маленькой силой на небольшую площадь можно получить большую силу, действующую на большую площадь. Силы будут отличаться во столько же раз, во сколько отличаются площади. Если действовать на малую площадь маленькой силой, используя площадь в несколько раз большую, можно получить силу во столько же раз большую.
Источник
Само слово «пресс» обозначает: механизм для обработки материалов давлением.
С помощью пресса макулатуре, металлолому, сену придают формы удобные для транспортировки.
Методом прессования изготовляют детали сложнейших приборов и машин.
В водяных насосах, отбойных молотках, также используется закон Паскаля и закон гидравлического пресса. Нажимая на тормоз, шофер останавливает автомобиль. Усиленное давление по этим законам передается на тормозные колодки, которые не дают вращаться колесам. Но это, конечно, далеко не весь перечень примеров проявления и использования свойств давления.
Давление жидкости
Можно ли численно рассчитать давление жидкости? Ответ получается, если применить нетрудные математические преобразования.
По определению p = F/S. F – сила, с которой жидкость (ведь она обладает весом P) давит на дно. Дальше, вспомнив формулы веса (P = mg), массы (m = ρV), объема (V = Sh), можно получить:
p = P/S = mg/S = ρVg/S = ρShg/S. Сократить полученную дробь на S, и результат готов:
p = ρgh
Изначально в формуле была задействована площадь дна, а в результате получилось выражение, в котором давление жидкости зависит ни от формы сосуда, ни от площади его стенок и дна, а от плотности ρ и глубины h жидкости (физики называют глубину высотой столба жидкости). Число g ≈ 10 Н/кг осталось от формулы веса.

А теперь самое интересное. Можно ли водой из кружки разрушить большую бочку? Тот факт, что высота столба определяет давление жидкости, позволяет ответить на этот вопрос: « Да, можно!»
Если взять несколько сосудов различной формы, одинаковой высоты и с одинаковой площадью дна, которое затянуто эластичной пленкой, наполнить сосуды водой, то дно прогнется одинаково во всех трех случаях. Хотя вес жидкости разный, сила давления возникает одинаковая (но ведь силой давления является вес!). Что происходит? А вот что:
F = p ∙ S, а p = ρgh и F = ρgh ∙ S
Одна жидкость, плотность ρ, высота h и площадь S дна — одинаковы. Значит, и сила давления одинаковая. Это явление «гидростатического парадокса».
Источник
Первое объяснение этому парадоксу (противоречие с общепринятым утверждением; перевод с греческого «докса» — «мнение», «пара» — «против») дано опять же Б.Паскалем.

Явления, связанные со стоячей жидкостью (в сосуде, в луже, в пруду) и давлением называют гидростатическими.
Сообщающиеся сосуды
Красивое зрелище – действующие фонтаны. Они всегда привлекают к себе внимание детей и взрослых. А каков же их принцип действия?
Первый человек, который это объяснил, опять был Блез Паскаль. Если взять две стеклянные трубочки и соединить их трубкой резиновой, и через воронку наливать воду в одну трубочку, то при любом положении трубочек вода в них будет на одинаковом уровне.
Эти трубочки, а на их месте могут быть любые сосуды, соединяются (сообщаются) друг с другом. Давление в обеих трубочках одинаково (по закону Паскаля), значит, и высота столбиков жидкости в этих соединенных, сообщающихся сосудах — одинакова.
Источник
Если один сосудов поднять на большую высоту, то из второго сосуда жидкость будет стремиться подняться до уровня первого сосуда, но сила тяжести, возвращает ее обратно на землю. Таков основной принцип работы фонтана. Вот его примерная схема:
Фонтан соединяется с большой башней, в которую закачивается вода с помощью насосов. Такую башню называют водонапорной. А если водонапорную башню соединить с водопроводной сетью, то вода поступит в любую квартиру, в любое здание. Водопровод — это пример применения в жизни сообщающихся сосудов.
Источник
К сообщающимся сосудам относятся насосы со шлангами, лейки, чайники, кофейники. В них по два сосуда: емкость под жидкость и носик. Звучит непривычно, но это так.
При помощи сообщающихся сосудов измеряют небольшое давление. Прибор называется жидкостным манометром. Один сосуд закрыт, а ко второму эластичной трубкой присоединена пластмассовая коробочка, затянутая пленкой. Если на пленку нажать, по закону Паскаля давление передастся на жидкость. В одном колене такого манометра жидкость опускается, а в другом поднимается. Давление тем больше, чем больше разница уровней жидкости.

Принцип сообщающихся сосудов используется в шлюзах – устройствах, пропускающих речные корабли через плотины, перегораживающие реки. Плотины обычно устраивают там, где работают гидроэлектростанции. Плотины разделяют течение реки на части: верхнее течение (там накапливается вода) и нижнее. Там, где проходят корабли, сделаны специальные огромные ворота, которые удерживают воду. Получается, что большие сообщающиеся сосуды между собой перекрыты.
Пусть корабль идет по течению реки вниз. Он попадает в верхнюю часть шлюза, где уровень воды высокий. Ворота открываются, и вода начинает перетекать в нижнюю часть, уровень воды снижается, а вместе с ним опускается и корабль (в нижней части наоборот уровень повышается). Снижение происходит до тех пор, пока не произойдет выравнивание (закон сообщающихся сосудов) верхнего и нижнего течений. Корабль может дальше двигаться по реке. Если корабль движется вверх по течению, он вначале попадает в нижнюю часть шлюза. Ворота открываются, вода из верхней части поступает в нижнюю до выравнивания уровней. В нижней части вода поднимается, и вместе с ней поднимается корабль. После выравнивания уровней корабль может двигаться дальше. Шлюзы очень больших плотин могут иметь не одни ворота, а сразу несколько. Ворота могут открываться, как обычные двери (по течению реки) или вертикально.
Источник
Если дно непрозрачного бака соединить с тонкой стеклянной трубкой снизу, расположенной вертикально ему, то можно увидеть высоту воды в баке (см. рисунок). Так устроены водомерные стекла в паровых котлах.
Важный момент. В данных примерах используется одна жидкость. А если в разные сосуды налить разные жидкости, например, воду и керосин. Что будет наблюдаться?
Давление в обоих сосудах одинаково (закон Паскаля). Но ведь плотность воды 1000 кг/м3, а керосина – 800 кг/м3, тогда столб керосина с меньшей плотностью должен быть выше, чем столб воды в 1,25 раза, т. к. плотности отличаются тоже в 1,25 раза.
Наблюдается обратно пропорциональная зависимость:
h1/h2 = ρ2/ρ1

Значит, в сообщающихся сосудах уровни одинаковы для однородной жидкости, а для разных жидкостей уровни различны.