| Гидрокарбонат натрия | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
гидрокарбонат натрия |
| Традиционные названия | пищевая (питьевая) сода, сода двууглекислая, двууглекислый натрий, бикарбонат натрия, кислый углекислый натрий |
| Хим. формула | CHNaO₃ |
| Рац. формула | NaHCO3 |
| Состояние | твёрдое |
| Молярная масса | 84,0066 г/моль |
| Плотность | 2,159 г/см³ |
| Т. разл. | 60—200 °C |
| Растворимость в воде | 9,59 г/100 мл |
| ГОСТ | ГОСТ 2156-76 ГОСТ 4201-79 ГОСТ 32802-2014 |
| Рег. номер CAS | 144-55-8 |
| PubChem | 516892 |
| Рег. номер EINECS | 205-633-8 |
| SMILES |
[Na+].OC([O-])=O |
| InChI |
1S/CH2O3.Na/c2-1(3)4;/h(H2,2,3,4);/q;+1/p-1 UIIMBOGNXHQVGW-UHFFFAOYSA-M |
| Рег. номер EC | 205-633-8 |
| Кодекс Алиментариус | E500(ii) |
| RTECS | VZ0950000 |
| ChEBI | 32139 |
| ChemSpider | 8609 |
| ЛД50 | 4220 мг/кг |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Гидрокарбонат натрия (лат. Natrii hydrocarbonas), другие названия: бикарбонат натрия, чайная сада, питьевая или пищевая сода, двууглекислый натрий — неорганическое соединение, натриевая кислая соль угольной кислоты с химической формулой NaHCO3.
В обычном виде — мелкокристаллический порошок белого цвета.
Используется в промышленности, пищевой промышленности, в кулинарии, в медицине как нейтрализатор химических ожогов кожи и слизистых оболочек концентрированными кислотами и для снижения кислотности желудочного сока. Также применяется в буферных растворах.
Содержание
- 1 Химические свойства
- 1.1 Реакция с кислотами
- 2 Термическое разложение
- 3 Получение
- 4 Применение
- 4.1 В химической промышленности
- 4.2 В кулинарии
- 4.3 В медицине
- 4.3.1 Противопоказания к применению в медицинских целях
- 4.4 Пожаротушение
- 4.5 В быту
- 4.6 В транспорте
- 5 Производство
- 6 Хранение
- 7 Безопасность
Химические свойства
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты. Проявляет все свойства соли сильного основания и слабой кислоты. В водных растворах имеет слабощелочную реакцию. В широком диапазоне концентраций в водном растворе pH раствора изменяется незначительно, на этом основано применение раствора вещества в качестве буферного раствора.
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами с образованием соответствующей кислоте соли, например, хлорида натрия, сульфата натрия и угольной кислоты, которая в процессе реакции распадается на углекислый газ и воду, при этом углекислый газ выделяется из раствора в виде пузырьков:
- NaHCO3 + HCl → NaCl + H2CO3
- H2CO3 → H2O + CO2↑
- 2NaHCO3 + H2SO4 → Na2SO4 + 2H2O + 2CO2↑
В быту обычно применяется реакция «гашения соды» уксусной кислотой, с образованием ацетата натрия или гашение лимонной кислотой с образование цитрата натрия, реакция с уксусной кислотой:
- NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
Термическое разложение
При температуре выше 60 °C гидрокарбонат натрия начинает распадаться на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C, при более высоких температурах карбонат натрия начинает распадаться на оксид натрия и углекислый газ):
- 2NaHCO3 →60−200∘C Na2CO3 + H2O + CO2↑
При этом процессе выделения воды в виде водяного пара и углекислого газa масса исходного продукта уменьшается примерно на 37 %.
Получение
В промышленности гидрокарбонат натрия получают аммиачно-хлоридным способом. В концентрированный раствор хлорида натрия, насыщенный аммиаком, под давлением пропускают углекислый газ. В процессе синтеза происходят две реакции:
- NH3 + CO2 + H2O → NH4HCO3
- NH4HCO3 + NaCl → NaHCO3↓ + NH4Cl
В холодной воде гидрокарбонат натрия мало растворим, и его отделяют от охлаждённого раствора фильтрованием, а из полученного после фильтрования раствора хлорида аммония снова получают аммиак, возвращаемый в производство вновь:
- 2NH4Cl + Ca(OH)2 → 2NH3↑ + CaCl2 + 2H2O
Применение
Двууглекислый натрий (бикарбонат) применяется в химической, пищевой, лёгкой, медицинской, фармацевтической промышленности, цветной металлургии, в быту. Зарегистрирован в качестве пищевой добавки E500 (ii), входит в состав пищевой добавки E500.
В химической промышленности
Применяется для производства красителей, пенопластов и других органических продуктов, фторорганических соединений, продуктов бытовой химии, наполнителей в огнетушителях, Реагент для отделения диоксида углерода, сероводорода из газовых смесей, например, отходящих газов топливосжигающих установок. В этом процессе углекислый газ поглощается раствором гидрокарбоната натрия при повышенном давлении и пониженной температуре, далее поглощённый углекислый газ выделяется из раствора при подогреве и снижении давления;
В лёгкой промышленности — в производстве резины для подошв обуви и в производстве искусственных кож, кожевенном производстве при дублении и нейтрализации кожи после кислого дубления, текстильной промышленности при отделке шёлковых и хлопчатобумажных тканей;
В пищевой промышленности — в хлебопечении, производстве кондитерских изделий, приготовлении газированных напитков.
В кулинарии
Основное применение пищевой соды в пищевой промышленности и в быту — кулинария, где применяется, преимущественно, в качестве основного или дополнительного разрыхлителя в составе кислого и пресного теста. При добавлении питьевой соды в кислое тесто происходит реакция с молочной кислотой, продуцированной при заквашивании дрожжевыми микроорганизмами, при этой реакции выделяется углекислый газ, вспучивающий тесто.
При добавлении в пресное тесто углекислый газ выделяется при выпечке из-за термического разложения.
При применении соды в чистом виде важно соблюсти правильную дозировку, так как она оставляет в продукте карбонат натрия, дающий определённый привкус. Порядок замешивания для теста: соду — в муку, кислые компоненты (уксус, кефир и пр.) — в жидкость.
В медицине
Традиционно раствор питьевой соды используется для дезинфекции зубов и дёсен при зубных болях и полости рта и горла, при сильном кашле, ангине, фарингите, а также как общепринятое средство от изжоги и болей в желудке.
Применяется при заболеваниях, сопровождающиеся выраженным ацидозом (при диабете, инфекциях и др), для борьбы с ацидозом при хирургических вмешательствах (назначается 3-5 г. внутрь).
Применяется в качестве антиаритмического средства.
Как антацидное средство (как и все другие щелочи) применяется при язвенной болезни желудка, и двенадцатиперстной кишки, при повышенной кислотности желудочного сока.
Имеются так же данные о применении препарата (в виде капельных и внутривенных вливаний) при гипертонической болезни, симптоматической почечной гипертонии, и хронической почечной недостаточности. Эффект связан с увеличением выделения ионов натрия и хлора и возрастанием осмотического диуреза.
В виде свечей применяется против укачивания при морской и воздушной болезнях
Применяется в качестве отхаркивающего средства, т.к. повышая щелочные резервы крови, сдвигает в щелочную сторону реакцию бронхиальной слизи, делая мокроту менее вязкой.
При ринитах, конъюнктивитах, стоматитах, ларингитах и т.п. применяют для полосканий, промываний, ингаляций 0,5 — 2% р-ры гидрокарбоната натрия.
Применяется внутривенно с целью быстрого устранения метаболического ацидоза во время реанимационных мероприятий, заболеваниях почек.
Нужно иметь ввиду, что в результате применения может возникнуть т.н. кислотный рикошет (при реакции содой с соляной кислотой происходит выделение CO2, который оказывает раздражающее действие на стенку желудка, усиливая выделение гастрина).
В альтернативной медицине питьевая сода иногда заявляется как «лекарство» от рака, однако, никакой экспериментально подтверждённой эффективности применения такого «лечения» не существует.
Противопоказания к применению в медицинских целях
Индивидуальная гиперчувствительность; состояния, сопровождающиеся развитием алкалоза; гипокальциемия, при приеме внутрь усиливает алкалоз и повышает риск развития тетанических судорог, гипохлоремия — снижение концентрации в крови ионов Cl—, в том числе вызванная рвотой, или снижением всасывания в желудочно-кишечном тракте, может привести к тяжёлому алкалозу.
Является источником натрия, тем самым увеличивая объём циркулирующей крови, усугубляя отёки и повышая артериальное давление. Применение при сниженной скорости клубочковой фильтрации может привести к метаболическому алкалозу.
Пожаротушение
Гидрокарбонат натрия вместе с карбонатом аммония используется в качестве наполнителя в огнетушителях с сухим наполнением и в стационарных системах сухого пожаротушения. Это применение обусловлено тем, что от воздействия высокой температуры в очаге горения вещество выделяет углекислый газ, атмосфера которого затрудняет доступ кислорода воздуха в очаг горения.
В быту
Применяется как безопасное для здоровья средство для чистки поверхностей столовой и кухонной посуды, поверхностей кухонных столов, иных поверхностей, соприкасающихся с пищей, путем протирки их с помощью влажной тряпки с сухим порошком питьевой соды.
В транспорте
Применяется для нейтрализации следов электролита — серной кислоты на поверхности пластмассовых корпусов свинцовых аккумуляторов насыщенным водным раствором питьевой соды.
Производство
В Российской Федерации двууглекислый натрий выпускается в соответствии с требованиями и техническими условиями, выпускается на предприятиях АО «Башкирская содовая компания» в г. Стерлитамак, Республика Башкортостан, а также на Крымском содовом заводе в г. Красноперекопск, Крымский полуостров.
Хранение
Гидрокарбонат натрия хранят в закрытых упаковках, в сухом месте вдали от источников огня. Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления. Срок годности не ограничен.
Безопасность
Вещество нетоксично, пожаро- и взрывобезопасно.
Имеет солоноватый, мыльный вкус. При попадании пыли вещества на слизистые оболочки глаз и носа вызывает лёгкое раздражение. При частой работе в атмосфере, загрязнённой пылью двууглекислого натрия, может возникнуть раздражение верхних дыхательных путей. Предельно допустимая концентрация пыли бикарбоната натрия в воздухе производственных помещений 5 мг/м3.
- ГОСТ 2156-76. Натрий двууглекислый. Технические условия (с Изменениями № 1, 2, 3, 4).
- ГОСТ 32802-2014. Добавки пищевые. Натрия карбонаты E500. Общие технические условия.
Гидрокарбонат натрия это химическое соединение, кислая соль угольной кислоты, в водных растворах проявляет слабощелочную реакцию.
У гидрокарбоната натрия есть другие названия: бикарбонат натрия, гидрокарбонат, пищевая сода, применяется для выпечки во время приготовления пищи, в медицине и т.д.
Формула гидрокарбоната натрия NaHCO3
Что такое гидрокарбоната натрия
Международный союз чистой и прикладной химии (IUPAC) дал название гидрокарбонату натрия химическому элементу, который также известен как бикарбонат натрия. Он широко известен как гидрокарбонат.
Существует еще одно распространенное название гидрокарбоната натрия, которое мы используем в нашей повседневной жизни: пищевая сода (бикарбонат соды).
Если мы разбиваем его на соединения, он состоит из соли (Na+) и карбоната (HCO3). Следовательно, мы получаем его формулу с этим. Формула NaHCO3. Его основная текстура/форма-твердая кристаллическая. Люди обычно используют его в виде мелкого белого порошка.
Если мы посмотрим на формулу и поместим туда их определенные значения, мы также сможем рассчитать его молекулярную массу. Вес 84,006 г/моль. Теперь давайте обсудим несколько свойств гидрокарбоната натрия.
Интересный факт о соде: Спутник Сатурна богат содой. В 2009 году ученые обнаружили, что под ледяной поверхностью Энцелада (спутника Сатурна) существует океан воды.
Этот факт подтвердили взятые на анализ кристаллы льда. В их составе ученые нашли не что иное, как соду.
Свойства NaHCO3
- Говоря химическими терминами, он имеет положительный (+ve) ион Na+ и отрицательный (-ve) ион HCO3.
- Текстура гидрокарбоната натрия, которая является кристаллической, имеет моноклинную структуру.
- Всякий раз, когда вы хотите сделать промышленное производство гидрокарбоната, карбонат натрия будет использоваться в качестве основного элемента.
- Следующая реакция будет обработана при производстве гидрокарбоната натрия:
Na2CO3 + CO2 + H2O2 ⟶ NaHCO3
(Химическая формула гидрокарбоната натрия)
Получение гидрокарбоната натрия процесс Сольвея
Это еще один процесс получения гидрокарбоната натрия, и этот процесс известен как процесс Сольвея. Этот процесс в основном рекомендуется, если вы хотите получить карбонат натрия в виде промежуточного продукта. Следующая формула создается в процессе Solvay:
NaCl + CO2 + NH3 + H2O ⟶ NaHCO3 + NH4Cl
(Символ гидрокарбоната натрия + символ хлорида аммония)
Давайте подробно обсудим весь процесс. Углекислый газ, аммиак и хлорид натрия-это элементы, которые должны вступать в реакцию с образованием гидрокарбоната натрия. В ходе этого процесса в качестве промежуточного результата получают карбонат гидроксида натрия и хлорид аммония.
Поскольку все (включая элементы) имеет жизнь, гидрокарбонат натрия также имеет жизнь до двух — трех лет. Эта жизнь также зависит от определенного условия, и это условие заключается в том, что он должен храниться в прохладном и сухом месте.
Примечание: Если вы храните гидрокарбонат натрия в герметичном контейнере, влаги не будет, и он откажется разлагаться. В результате чего он длится до трех лет.
Сода обладает отличными противопожарными качествами, поэтому ее всегда нужно держать на кухне поблизости от плиты. Если вдруг возникнет пламя, просто посыпьте его этим порошком.
Использование гидрокарбоната натрия
Существует множество применений гидрокарбоната натрия, которые варьируются от обычных бытовых до промышленных целей. Он также работает как обычная бытовая медицинская помощь при определенных условиях. Некоторые из его применений перечислены ниже:
Общее название гидрокарбоната натрия-пищевая сода, так как он используется для основной цели выпечки во время приготовления пищи. Общее название происходит от распространенного, но важного использования этого соединения в выпечке в качестве разрыхлителя.
Обычно, когда он вступает в реакцию с кислыми веществами, такими как фосфаты водорода, винный камень, сок лимона, йогурт, пахта, какао и уксус, он выделяет углекислый газ.
Благодаря этому выделению углекислого газа при выпечке тесто расширяется и образует характерную текстуру и структуру зерна, которые вы обычно наблюдаете в быстром хлебе, содовом хлебе, иногда идлисе, хаммане и многих других выпеченных и жареных продуктах.
Для выделения CO2 из гидрокарбоната натрия сбалансированное уравнение дается следующим образом:
NaHCO3 + H+ → Na +CO2 + H2O.
Общее название гидрокарбоната натрия происходит от его использования в приготовлении разрыхлителя, который также используется для приготовления пищи. Разрыхлитель содержит около 30% бикарбоната натрия и кислых реагентов или соединений, которые активируются при контакте с водой.
Это приводит к обычному процессу, как упоминалось выше. Но одна вещь, которую вы должны знать, это то, что пищевая сода щелочная.
Бикарбонат натрия также используется в пиротехнике и фейерверках. Обычные таблетки черной змеи, которые можно найти в основном во время фестиваля Дивали, содержат бикарбонат натрия.
В этом фейерверке образуется длинная змеевидная зола из-за термического разложения с выделением углекислого газа и золы, являющейся продуктом сгорания сахарозы.
Гидрокарбонат натрия иногда используется для задержки горения, потому что он производит углекислый газ и воду в качестве продукта сгорания, и оба они используются для управления огнем или остановки горения. Благодаря этому свойству он также используется в огнетушителях.
Он также используется для нейтрализации кислот, особенно разливов кислот в промышленности, поскольку они самопроизвольно реагируют и выделяют углекислый газ в качестве продукта реакции.
Из-за его мгновенной реакции с кислотами он также используется в качестве антацида для лечения расстройства желудка, возникающего из-за кислотности, а также для лечения изжоги.
Часто задаваемые вопросы ответы о гидрокарбонате натрия?
Что такое пищевая сода? Является ли пищевая сода гидрокарбонатом натрия такой же?
Пищевая сода (бикарбонат соды) — это общее название гидрокарбоната натрия, который мы используем в нашей повседневной жизни. Формула NaHCO3.
Его основная текстура/форма-твердая кристаллическая. Люди обычно используют его в виде мелкого белого порошка.
Если мы разбиваем его на соединения, он состоит из соли (Na) и карбоната (HCO3). Следовательно, мы получаем его формулу с этим. Да, гидрокарбонат и пищевая сода одинаковы.
Каковы химические свойства гидрокарбоната натрия?
Говоря химическими терминами, он имеет положительный (+ve) ион Na+ и отрицательный (-ve) ион HCO3. Следующая реакция будет обработана при производстве гидрокарбоната натрия:
Na2CO3 + CO2 + H2O → 2NaHCO3 (химическая формула гидрокарбоната натрия). Всякий раз, когда вы хотите сделать промышленное производство гидрокарбоната, карбонат натрия будет использоваться в качестве основного элемента.
Текстура гидрокарбоната натрия, которая является кристаллической, имеет моноклинную структуру.
Что пользы гидрокарбоната натрия?
Гидрокарбонат натрия также обычно называют бикарбонатом натрия. Пищевая сода, которая обычно используется в домашних условиях, -это не что иное, как гидрокарбонат натрия.
Пищевая сода также известна как бикарбонат соды, который является источником углекислого газа.
Наиболее часто используемый гидрокарбонат натрия используется для приготовления разрыхлителя, который используется для приготовления пищи, в напитках, в шипучих солях, а также используется для сухого химического огнетушителя.
Сколько моль составляют 1,04 грамма гидрокарбоната натрия (NaHCO3).
Решение задачи
Рассчитаем молярную массу гидрокарбоната натрия (NaHCO3):
M (NaHCO3) = 23 + 1 + 12 + 3 ∙ 16 = 84 (г/моль).
Найдем химическое количество гидрокарбоната натрия (NaHCO3), по формуле устанавливающей связь между химическим количеством вещества и массой:
Под количеством вещества понимают определенное число структурных единиц этого вещества. За единицу количества вещества принят один моль.
Получаем:
n (NaHCO3) = 1,04 / 84 = 0,01 (моль).
Ответ:
химическое количество гидрокарбоната натрия (NaHCO3) равно 0,01 моль.
Формула гидрокарбоната натрия
Определение и формула гидрокарбоната натрия
В обычных условиях гидрокарбонат натрия – это твердое вещество белого цвета (рис. 1), разлагающееся при слабом нагревании. Во влажном состоянии начинает разлагаться при комнатной температуре. Умеренно растворяется в воде (гидролизуется по аниону). Кристаллогидратов не образует.
Рис. 1. Гидрокарбонат натрия. Внешний вид.
Химическая формула гидрокарбоната натрия
Химическая формула гидрокарбоната натрия NaHCO3. Она показывает, что в состав данной молекулы входят один атом натрия (Ar = 23 а.е.м.), один атом водорода (Ar = 1 а.е.м.), один атом углерода (Ar = 12 а.е.м.) и три атома кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу гидрокарбоната натрия:
Mr(NaHCO3) = Ar(Na) + Ar(H) + Ar(C) + 3×Ar(O);
Mr(NaHCO3) = 23 + 1 + 12+ 3×16= 44 + 48 = 92
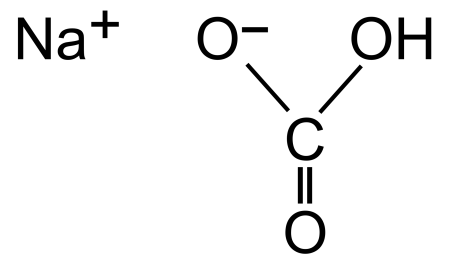
Графическая (структурная) формула гидрокарбоната натрия
Структурная (графическая) формула гидрокарбоната натрия является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
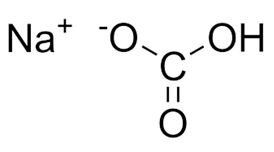
Ионная формула
Гидрокарбонат натрия представляет собой кислую соль угольной кислоты, которая подвергается диссоциации в водном растворе согласно следующему уравнению реакции:
NaHCO3 ↔ Na+ + HCO3—
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
Физические свойства. Гидрокарбонат
натрия представляет собой белый
кристаллический порошок, растворимый
в воде.
Химические свойства. При взаимодействии
с кислотами и при нагревании разлагается
с выделением диоксида углерода
NаHCO3
+ HCl = NaCl + CO2
+ H2O
2NаHCO3
= Na2CO3
+ CO2
+ H2O
Готовый продукт. Получают очищенный
и сырой гидрокарбонат. Очищенный
гидрокарбонат выпускается двух сортов:
медицинский и технический. В готовом
продукте должны полностью отсутствовать
соли аммония, тяжёлые металлы и мышьяк
Исходное сырьё. Исходным сырьём
для производства гидрокарбоната
является содовый раствор. Содовый
раствор готовят двумя способами:
– из готовой кальцинированной соды;
– из сырого гидрокарбоната (получаемого
на фильтрах в производстве кальцинированной
соды).
По первому способу исходную кальцинированную
соду растворяют в воде и получают
содовый раствор.
По второму – в конечном счёте, также
готовят раствор соды, но из сырого
гидрокарбоната. Как это делают? Во-первых,
сырой гидрокарбонат должен быть
тщательно очищен от хлорида аммония
NH4Cl,
для чего его отделяют от раствора и
тщательно промывают. Сырой гидрокарбонат
размешивают в воде и в маточных щелоках,
которые содержат NаHCO3.
Пульпу подают в декарбонизатор,
где под действием пара происходит
разложение гидрокарбоната:
2NаHCO3
= Na2CO3
+ CO2 + H2O.
Одновременно разлагаются содержащиеся
в пульпе соли аммония:
(NH4)2CO3
= 2NH3
+ CO2
+ H2O
NH4HCO3
= NH3
+ CO2
+ H2O
Аммиак и диоксид углерода под действием
пара из системы удаляются.
Полученные (и первым, и вторым способами)
содовые растворы после фильтрования
подвергают карбонизации. В результате
образуется осадок чистого гидрокарбоната
Nа2CO3
+ CO2 + H2O
= 2NaHCO3
Выпавший осадок гидрокарбоната натрия
отфильтровывают, центрифугируют, сушат
горячим воздухом и измельчают.
Готовый гидрокарбонат упаковывают.
Упакованный продукт хранят в сухих
помещениях.
Лекция № 17 производство гидроксида натрия или каустической соды химическим способом
ВОПРОСЫ.
1. Общие сведения.
2.
Известковый способ производства
гидроксида натрия.
2.1. Химические реакции.
2.2. Физико-химические основы процесса
каустификации.
2.3. Основные операции технологического
процесса.
3. Ферритный способ производства
гидроксида натрия.
3.1. Сырьё.
3.2. Химические реакции.
3.3.Основные стадии.
3.4. Расходные коэффициенты.
3.5. Совершенствование метода.
1. Общие сведения.
Кроме электрохимических методов
получения гидроксида натрия (NaOH),
которые были рассмотрены ранее, в
промышленности существуют химические
способы.
Электрохимический метод имеет в
настоящее время наибольшее значение,
так как кроме каустической соды NaOH
получаются и другие ценные продукты –
хлор водород.
Из химических способов в промышленности
используются два:
– известковый;
– ферритный.
По известковому способу производится
основное количество химического
гидроксида натрия NaOH
Различие химических методов заключается
лишь в процессах приготовления
разбавленных растворов, или щелоков.
Дальнейшая переработка щелоков для
получения более концентрированых
растворов или твердого гидроксида
натрия одинакова как для химических
методов, так и для электрохимических,
что рассматривалось ранее.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #




