| Гидрокарбонат кальция | |
|---|---|
| Систематическое наименование |
Гидрокарбонат кальция |
| Традиционные названия | Бикарбонат кальция, кислый углекислый кальций, двууглекислый кальций |
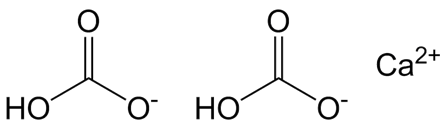
| Хим. формула | Ca(HCO3)2 |
| Молярная масса | 162.1124 г/моль |
| Рег. номер CAS | 3983-19-5 |
| PubChem | 10176262 |
| SMILES |
C(=O)(O)[O-].C(=O)(O)[O-].[Ca+2] |
| InChI |
1S/2CH2O3.Ca/c2*2-1(3)4;/h2*(H2,2,3,4);/q;;+2/p-2 NKWPZUCBCARRDP-UHFFFAOYSA-L |
| ChemSpider | 8351767 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Гидрокарбонат кальция — неорганическое соединение, кислая соль кальция и угольной кислоты. Химическая формула — Ca(HCO3)2 .
Содержание
- 1 Свойства
- 2 Применение
- 3 Получение
Свойства
Как известно, все гидрокарбонаты растворимы в воде. Гидрокарбонат кальция обусловливает временную жёсткость воды. В организме гидрокарбонаты выполняют важную физиологическую роль — регулируют постоянство реакций в крови. При нагревании раствора гидрокарбоната кальция он разлагается:
Ca(HCO3)2 →t CaCO3↓ + H2O + CO2
Таким образом, реакция разложения гидрокарбоната кальция является обратной реакцией его образования. Именно это уравнение является основным, по которому образуется накипь в чайниках и водонагревательных системах, так как в исходной воде почти всегда содержится гидрокарбонат кальция, который более растворим, чем карбонат.
Применение
Нормативы рекомендуют концентрацию гидрокарбонатов в питьевой воде в диапазоне 30—400 мг/дм³.
Получение
Гидрокарбонат кальция получают взаимодействием карбоната кальция с углекислым газом и водой:
CaCO3 + CO2 + H2O ⟶ Ca(HCO3)2
From Wikipedia, the free encyclopedia
|
|
| Names | |
|---|---|
| IUPAC name
Calcium hydrogencarbonate |
|
| Systematic IUPAC name
Calcium bicarbonate |
|
| Other names
Cleansing lime |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
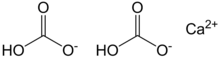
Ca(HCO3)2 |
| Molar mass | 162.11464 g/mol |
|
Solubility in water |
16.1 g/100 mL (0 °C) 16.6 g/100 mL (20 °C) 18.4 g/100 mL (100 °C)[citation needed] |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Irritant |
| Flash point | Non-flammable |
| Related compounds | |
|
Other cations |
Magnesium bicarbonate |
|
Related compounds |
Sodium bicarbonate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Calcium bicarbonate, also called calcium hydrogencarbonate, has the chemical formula Ca(HCO3)2. The term does not refer to a known solid compound; it exists only in aqueous solution containing calcium (Ca2+), bicarbonate (HCO−
3), and carbonate (CO2−
3) ions, together with dissolved carbon dioxide (CO2). The relative concentrations of these carbon-containing species depend on the pH; bicarbonate predominates within the range 6.36–10.25 in fresh water.
All waters in contact with the atmosphere absorb carbon dioxide, and as these waters come into contact with rocks and sediments they acquire metal ions, most commonly calcium and magnesium, so most natural waters that come from streams, lakes, and especially wells, can be regarded as dilute solutions of these bicarbonates. These hard waters tend to form carbonate scale in pipes and boilers and they react with soaps to form an undesirable scum.
Attempts to prepare compounds such as solid calcium bicarbonate by evaporating its solution to dryness invariably yield instead the solid calcium carbonate:[1]
- Ca(HCO3)2(aq) → CO2(g) + H2O(l) + CaCO3(s).
Very few solid bicarbonates other than those of the alkali metals (other than ammonium bicarbonate) are known to exist.[clarification needed]
The above reaction is very important to the formation of stalactites, stalagmites, columns, and other speleothems within caves, and for that matter, in the formation of the caves themselves. As water containing carbon dioxide (including extra CO2 acquired from soil organisms) passes through limestone or other calcium carbonate-containing minerals, it dissolves part of the calcium carbonate, hence becomes richer in bicarbonate. As the groundwater enters the cave, the excess carbon dioxide is released from the solution of the bicarbonate, causing the much less soluble calcium carbonate to be deposited.
In the reverse process, dissolved carbon dioxide (CO2) in rainwater (H2O) reacts with limestone calcium carbonate (CaCO3) to form soluble calcium bicarbonate (Ca(HCO3)2). This soluble compound is then washed away with the rainwater. This form of weathering is called carbonation.
In medicine, calcium bicarbonate is sometimes administered intravenously to immediately correct the cardiac depressor effects of hyperkalemia by increasing calcium concentration in serum, and at the same time, correcting the acid usually present.
References[edit]
- ^ «Baking Soda». Archived from the original on 2000-09-29.
Содержание
- Свойства
- Особенности обращения, биологическое действие
- Сферы использования
- Токсикология
- Получение
Гидрокарбонат кальция — неорганическое химическое соединение, кислая соль кальция и угольной кислоты. Химическая формула — 
| Гидрокарбонат кальция | |
|---|---|
| Общие | |
| Систематическое наименование |
Гидрокарбонат кальция |
| Традиционные названия | Гидрокарбонат кальция; бикарбонат кальция, кислый углекислый кальций, двууглекислый кальций |
| Хим. формула | C2H2CaO6 |
| Рац. формула | Ca(HCO3)2 |
| Физические свойства | |
| Молярная масса | 162.1124 г/моль |
| Классификация | |
| Рег. номер CAS | 3983-19-5 |
| PubChem | 10176262 |
| SMILES |
C(=O)(O)[O-].C(=O)(O)[O-].[Ca+2] |
| InChI |
1S/2CH2O3.Ca/c2*2-1(3)4;/h2*(H2,2,3,4);/q;;+2/p-2 NKWPZUCBCARRDP-UHFFFAOYSA-L |
| Кодекс Алиментариус | Е170(ii) |
| ChemSpider | 8351767 |
| Безопасность | |
| Предельная концентрация | 6 мг/дм³ |
| ЛД50 | 6420-24000 мг/кг |
| Токсичность | Класс опасности IV |
Свойства
Все гидрокарбонаты растворимы в воде. Гидрокарбонат кальция обусловливает временную жёсткость воды. В организме гидрокарбонаты выполняют важную физиологическую роль — регулируют постоянство реакций в крови. При нагревании раствора гидрокарбоната кальция он разлагается:
Таким образом, реакция разложения гидрокарбоната кальция является обратной реакцией его образования. Именно это уравнение является основным, по которому образуется накипь в чайниках и водонагревательных системах, так как в исходной воде почти всегда содержится гидрокарбонат кальция, который более растворим, чем карбонат.
Особенности обращения, биологическое действие
Нормативы рекомендуют концентрацию гидрокарбонатов в питьевой воде в диапазоне 30—400 мг/дм³.
Сферы использования
Бикарбонат кальция нашёл некоторое применение в качестве пищевой добавки Е170(ii).
Токсикология
Вещество нетоксично. ПДК 180 мг/дм³ (в воде, по ионам кальция). ЛД50 на крысах — 6420-24000 мг/кг.
Получение
Гидрокарбонат кальция получают взаимодействием карбоната кальция с углекислым газом и водой:
Формула гидрокарбоната кальция
Определение и формула гидрокарбоната кальция
При нагревании до температуры 60oC и выше разлагается и переходит в нерастворимый в воде карбонат кальция.
Химическая формула гидрокарбоната кальция
Химическая формула гидрокарбоната кальция имеет вид Ca(HCO3)2. Она показывает, что в состав данной молекулы входят два атома углерода (Ar = 12 а.е.м.), два атома водорода (Ar = 1 а.е.м.), один атома кальция (Ar = 40 а.е.м.) и шесть атомов кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу гидрокарбоната кальция:
Mr(Ca(HCO3)2) = Ar(Ca) + 2×Ar(H) + 2×Ar(C) + 6×Ar(O);
Mr(Ca(HCO3)2) = 40 + 2×1 +2×12 + 6×16 = 40 + 2 + 24 + 96 = 162.
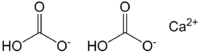
Графическая (структурная) формула гидрокарбоната кальция
Структурная (графическая) формула является более наглядной, она отражает то, как атомы связаны между собой внутри молекулы гидрокарбоната кальция (рис. 1).
Рис. 1. Графическая формула гидрокарбоната кальция.
Ионная формула
Гидрокарбонат кальция – сильный электролит. В водном растворе под действием электрического тока он диссоциирует на ионы согласно следующему уравнению:
Ca(HCO3)2 ↔ Ca2+ + 2HCO3—.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
| Гидрокарбонат кальция | |
 |
|
| Общие | |
|---|---|
| Традиционные названия | Гидрокарбонат кальция |
| Химическая формула | Ca(HCO3)2 |
| Физические свойства | |
| Молярная масса | 162.1124 г/моль |
| Термические свойства |
Гидрокарбонат кальция — соль угольной кислоты. Химическая формула — 
Свойства
Как известно, все гидрокарбонаты в воде растворимы. Гидрокарбонат кальция обусловливает временную жёсткость воды. В организме гидрокарбонаты выполняют важную физиологическую роль — регулируют постоянство реакций в крови. При нагревании раствора гидрокарбоната кальция он разлагается:
Таким образом, реакция разложения гидрокарбоната кальция является обратной реакцией его образования. Именно это уравнение является основным, по которому образуется накипь в чайниках и водонагревательных системах, так как в исходной воде почти всегда содержится гидрокарбонат кальция, который более растворим, чем карбонат.
Применение
Нормативы рекомендуют концентрацию гидрокарбонатов в питьевой воде в диапазоне 30—400 мг/дм³.
Получение
Гидрокарбонат кальция получают взаимодействием карбоната кальция с углекислым газом и водой:
См. также
- Накипь
- Карбонат кальция