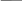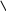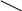|
§ 17 |
Валентность. Составление формул оксидов |
Вы, наверное, обратили внимание на то, что оксиды различных химических элементов по составу отличаются друг от друга. Например, на один атом кислорода в воде H2O приходятся два атома водорода, а в оксиде магния MgO — один атом магния. Как это можно объяснить?
В XIX в. учёные предположили, что атомы разных элементов обладают различной способностью присоединять к себе другие атомы. Так, атом водорода может присоединить лишь один атом другого химического элемента, кислород — два атома, азот — три. В настоящее время известно, что атомы, входящие в состав молекул, соединены между собой химическими связями в определённой последовательности. Чтобы показать это, используют структурные формулы, выражающие не только число атомов, но и последовательность их соединения. Химические связи между атомами в молекулах принято обозначать чёрточками.
Число связей, которые данный атом образует с другими атомами, называют валентностью.
Слово «валентность» в переводе с латинского означает «сила, способность».
Изобразим структурную формулу воды:
Обратите внимание на то, что атомы водорода в молекуле воды не связаны друг с другом, а соединены только с атомом кислорода. Каждый атом водорода образует одну химическую связь (от символа H отходит одна чёрточка) — он одновалентен. Атом кислорода образует две связи — он двухвалентен. Число чёрточек, отходящих от символа химического элемента в структурной формуле, и есть валентность данного атома.
Установлено, что и в других соединениях водород всегда одновалентен, т. е. атомы водорода образуют лишь одну связь. Валентность кислорода всегда равна двум.
В молекуле углекислого газа CO2 атом углерода образует с каждым атомом кислорода две двойные связи, которые равноценны четырём одинарным (четыре чёрточки в структурной формуле), следовательно, углерод в этом веществе четырёхвалентен:
O

Зная валентность одного химического элемента в соединении, можно определить валентность другого. Так, хлор в хлороводороде HCl одновалентен, азот в аммиаке NH3 трёхвалентен, а валентность углерода в метане CH4 равна четырём:
Для обозначения валентности обычно используют римские цифры, которые ставят в формуле над символом химического элемента:
Чтобы подсчитать валентность, нет необходимости каждый раз рисовать структурные формулы. Легко заметить, что в соединении общее число единиц валентности всех атомов одного элемента всегда равно общему числу единиц валентности всех атомов другого элемента. Иными словами, произведение числа атомов одного элемента на его валентность равно произведению числа атомов второго элемента на его валентность.
Таблица 4
|
Последовательность действий |
Составление формулы |
|
|
Указать валентность кислорода |
|
|
|
Умножить число атомов кислорода на численное значение его валентности (II) |
3•2 = 6 |
2•2 = 4 |
|
Разделить полученное значение на индекс, показывающий число атомов другого элемента |
6 : 2 = 3 |
4 : 1 = 4 |
|
Записать значение валентности над символом этого элемента |
|
|
Например:

Для углерода (число атомов равно 1): IV•1 = 4;
для кислорода (число атомов равно 2): II•2 = 4.
Чтобы определить валентность элемента в оксиде по формуле, необходимо провести следующие математические вычисления (табл. 4).
Некоторые химические элементы проявляют в соединениях постоянную валентность (табл. 5), её надо запомнить, другие — переменную.
Химические элементы с постоянной валентностьюТаблица 5
|
Валентность |
Химические элементы |
|
I |
H, Na, K, Ag |
|
II |
O, Mg, Ca, Ba, Zn |
|
III |
Al |
Таблица 6
|
Последовательность действий |
Составление формулы |
|
|
Записываем символы химических элементов (кислород на втором месте) и указываем их валентность (кислород двухвалентен, валентность второго элемента либо дана в названии, либо постоянна и приведена в таблице 5) |
Оксид алюминия |
Оксид углерода(IV) |
|
Находим наименьшее общее кратное двух числовых значений валентности |
III и II ⇒ 6 |
IV и II ⇒ 4 |
|
Находим индексы, поделив наименьшее общее кратное на численные значения валентности данного элемента |
6 : 3 = 2 (Al) 6 : 2 = 3 (O) |
4 : 4 = 1 (C) 4 : 2 = 2 (O) |
|
Записываем индексы после знаков химических элементов |
Al2O3 |
CO2 |
Обратите внимание, что значения валентности многих металлов совпадают с номерами групп Периодической системы химических элементов Д. И. Менделеева, в которых они находятся.
Значение переменной валентности принято указывать в скобках в названии соединения, например: 

Рассмотрим, как можно составить формулу оксида по его названию (табл. 6).
Понятие о валентности возникло на заре современной химии, поэтому его использование в настоящее время вызывает много вопросов. Как, например, определить валентность атомов в простых веществах? В железе при комнатной температуре у каждого атома 8 ближайших соседей (см. рис. 23, а). Означает ли это, что железо восьмивалентно? Как быть с другими веществами немолекулярного строения? Так, оксиды металлов, как правило, не образуют молекул. Строение того же оксида алюминия Al2O3 лишь формально можно изобразить структурной формулой O



1.Дайте определение понятия «валентность».
2.Зная, что водород одновалентен, определите валентность химических элементов по формулам соединений: NaH, CaH2, AlH3, CH4, PH3, H2S, HF.
3.Определите валентность элементов по формулам оксидов и назовите вещества: P2O5, SO2, SO3, NO, Na2O, CaO, Mn2O7, SnO2, I2O5, H2O.
4.Напишите формулы следующих оксидов: оксида магния, оксида фосфора(III), оксида калия, оксида хлора(IV), оксида железа(III), оксида меди(II), оксида кремния(IV), оксида хлора(VII), оксида цинка, оксида алюминия, оксида водорода, оксида золота(III).
5.В соединениях с кислородом марганец проявляет валентности II, III, IV, VII. Составьте формулы этих оксидов и назовите их.
6.Хлор образует четыре оксида, в которых он проявляет валентности I, III, V и VII. Составьте формулы этих соединений и назовите их.
7.При горении магния, цинка и алюминия в кислороде образуются их оксиды. Составьте формулы этих соединений, напишите уравнения реакций.
Таблица оксидов.
Оксиды: основные оксиды, кислотные оксиды, амфотерные оксиды:
Оксид (именуемые также окисел, окись) – это бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом.
Химический элемент кислород по электроотрицательности находится на втором месте после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. Исключение составляет, например, дифторид кислорода OF2.
В зависимости от химических свойств различают:
— солеобразующие оксиды:
- основные оксиды. К ним относятся оксиды металлов, степень окисления которых +1, + 2;
- кислотные оксиды. К ним относятся оксиды металлов со степенью окисления +5, + 6, + 7, и оксиды неметаллов;
- амфотерные оксиды. К ним относятся оксиды металлов со степенью окисления +3, +4, и оксиды-исключения: ZnO, BeO, SnO, PbO;
— несолеобразующие оксиды: оксид углерода (II) СО, оксид азота (I) N2O, оксид азота (II) NO, оксид кремния (II) SiO и оксид серы (II) SO.
В зависимости от количества атомов элементов в оксиде, кроме кислорода различают:
— простые, включающие в молекулу атомы одного элемента, кроме кислорода, и находящихся в в одной степени окисления. Например, оксид лития Li2O.
— сложные оксиды, включающие в молекулу атомы двух и более элементов, кроме кислорода. Например, оксид лития-кобальта (III) Li2O·Co2O3;
— двойные оксиды, в которые атомы одного и того же элемента входят в двух или более степенях окисления. Например, оксид марганца (II, IV) Mn5O8. Во многих случаях такие оксиды могут рассматриваться как соли кислородсодержащих кислот.
Таблица оксидов (1 часть):
| Атомный номер | Химический элемент | Символ | Оксиды |
| 1 | Водород | H | H2O (вода) |
| 2 | Гелий | He | нет |
| 3 | Литий | Li | Li2O (оксид лития) |
| 4 | Бериллий | Be | BeO (оксид бериллия) |
| 5 | Бор | B | B2O3 (оксид бора (III)) |
| 6 | Углерод | C | CO (оксид углерода (II), монооксид углерода, угарный газ),
CO2 (оксид углерода (IV), диоксид углерода, углекислый газ), C3O2 (диоксид триуглерода), (C3O2)n (политрикарбодиоксид), C5O2 (1,2,3,4-пентатетраен-1,5-дион), C6O6 (диангидрид этилентетракарбоновой кислоты) C12O9 (меллитовый ангидрид), C12O12 (гексагидроксибензол трисоксалат), и др. |
| 7 | Азот | N | N2O (оксид азота (I), закись азота, оксонитрид азота, веселящий газ),
NO (оксид азота (II), мон(о)оксид азота, окись азота, нитрозил-радикал), N2O3 (оксид азота (III), азотистый ангидрид, сесквиоксид азота), NO2 (диоксид азота, оксид азота (IV), двуокись азота), N2O5 (оксид азота (V), пентаоксид азота, пентаоксид диазота, нитрат нитрила, нитрат нитрония, азотный ангидрид), N2O4 (димер диоксида азота, тетраоксид диазота, азотный тетраоксид), и др. |
| 8 | Кислород | O | — |
| 9 | Фтор | F | нет |
| 10 | Неон | Ne | нет |
| 11 | Натрий | Na | Na2O (оксид натрия) |
| 12 | Магний | Mg | MgO (оксид магния) |
| 13 | Алюминий | Al | Al2O3 (оксид алюминия) |
| 14 | Кремний | Si | SiO (оксид кремния (II), монооксид кремния),
SiO2 (оксид кремния (IV), диоксид кремния, кремнезём) |
| 15 | Фосфор | P | P4O (монооксид тетрафосфора),
P4O2 (диоксид тетрафосфора), P2O3 или P4O6 (оксид фосфора (III), фосфористый ангидрид, гексаоксид тетрафосфора), P4O8 (оксид фосфора (IV), октаоксид тетрафосфора), P2O5 или P4O10 (оксид фосфора (V), пентаоксид фосфора, фосфористый ангидрид, гексаоксид тетрафосфора) |
| 16 | Сера | S | SO (оксид серы (II), монооксид серы, моноокись серы),
SO2 (оксид серы (IV), диоксид серы, двуокись серы, сернистый газ, сернистый ангидрид), SO3 (оксид серы (VI), трёхокись серы, серный газ, ангидрид серной кислоты) |
| 17 | Хлор | Cl | Cl2O (оксид хлора (I), гемиоксид хлора, ангидрид хлорноватистой кислоты),
ClO2 (диоксид хлора, оксид хлора (IV), двуокись хлора), ClOClO3 (перхлорат хлора ), Cl2O6 (дихлоргексаоксид, оксид хлора (V, VII), перхлорат хлорила), Cl2O7 (оксид хлора (VII), дихлорогептаоксид, хлорный ангидрид), и др. |
| 18 | Аргон | Ar | нет |
| 19 | Калий | K | K2O (оксид калия) |
| 20 | Кальций | Ca | CaO (оксид кальция, окись кальция, негашёная известь, в просторечии — кирабит, кипелка) |
| 21 | Скандий | Sc | Sc2O3 (оксид скандия, сесквиоксид скандия) |
| 22 | Титан | Ti | TiO (оксид титана (II)),
Ti2O3 (оксид титана(III), трёхокись титана), TiO2 (оксид титана (IV), диоксид титана, двуокись титана, титановые белила) |
| 23 | Ванадий | V | VO (оксид ванадия (II), окись ванадия),
V2O3 (оксид ванадия (III), трехокись ванадия), VO2 (оксид ванадия (IV), диоксид ванадия, двуокись ванадия), V2O5 (оксид ванадия (V), пентаоксид диванадия) |
| 24 | Хром | Cr | CrO (оксид хрома (II), закись хрома),
Cr2O3 (оксид хрoма (III), сесквиоксид хрома, хромовая зелень, эсколаит), CrO2 (оксид хрома (IV), диоксид хрома, двуокись хрома), CrO3 (оксид хрома (VI), триоксид хрома, трёхокись хрома, хромовый ангидрид) |
| 25 | Марганец | Mn | MnO (оксид марганца (II), окись марганца, монооксид марганца),
Mn3O4 (оксид марганца (II,III), окисел марганца), Mn5O8 (оксид марганца (II,IV), окисел марганца), Mn2O3 (оксид марганца (III), окисел марганца), MnO2 (оксид марганца (IV), диоксид марганца), MnO3 (оксид марганца (VI), окисел марганца), Mn2O7 (оксид марганца (VII)) |
| 26 | Железо | Fe | FeO (оксид железа (II), закись железа),
Fe2O3 (оксид железа (III), окись железа, колькотар, крокус, железный сурик, гематит), Fe3O4 (оксид железа (II,III), закись-окись железа, железная окалина, магнетит, магнитный железняк), и др. |
| 27 | Кобальт | Co | CoO (оксид кобальта (II), окись кобальта),
Co3O4 (оксид кобальта (II,III), окись кобальта), Co2O3 (оксид кобальта (III), окись кобальта), CoO2•H2O (оксид кобальта (IV), гидрат оксида кобальта) |
| 28 | Никель | Ni | NiO (оксид никеля (II), окись никеля, бунзенит),
Ni2O3 (оксид никеля (III), окисел никеля; сесквиоксид никеля) |
| 29 | Медь | Cu | Cu2O (оксид меди (I), гемиоксид меди, оксид димеди, закись меди, куприт),
CuO (оксид меди (II), окись меди), Cu2O3 (оксид меди (III), триоксид димеди) |
| 30 | Цинк | Zn | ZnO (оксид цинка, окись цинка) |
| 31 | Галлий | Ga | Ga2O (оксид галлия (I), закись галлия, гемиоксид галлия),
Ga2O3 (оксид галлия (III)) |
| 32 | Германий | Ge | GeO (оксид германия (II), окись германия),
GeO2 (оксид германия (IV), диоксид германия, двуокись германия) |
| 33 | Мышьяк | As | As2O3 (оксид мышьяка (III), триоксид мышьяка),
As2O5 (оксид мышьяка (V), пентоксид мышьяка) |
| 34 | Селен | Se | SeO2 (оксид селена (IV), диоксид селена, двуокись селена, доунеит, селенолит),
SeO3 (оксид селена (VI), триоксид селена, селеновый ангидрид) |
| 35 | Бром | Br | Br2O (оксид брома, оксид брома (I), окись брома, ангидрид бромноватистой кислоты) |
Таблица оксидов (2 часть):
| 36 | Криптон | Kr | нет |
| 37 | Рубидий | Rb | Rb2O (оксид рубидия, окись рубидия) |
| 38 | Стронций | Sr | SrO (оксид стронция, окись стронция) |
| 39 | Иттрий | Y | Y2O3 (оксид иттрия, сесквиоксид иттрия) |
| 40 | Цирконий | Zr | ZrO2 (оксид циркония (IV), оксид циркония, диоксид циркония) |
| 41 | Ниобий | Nb | NbO (оксид ниобия (II), окись ниобия),
Nb2O3 (оксид ниобия (III), окись ниобия), NbO2 (оксид ниобия (IV), окись ниобия), Nb2O5 (оксид ниобия (V), окись ниобия) |
| 42 | Молибден | Mo | Mo2O3 (оксид молибдена (III), окись молибдена),
MoO2 (оксид молибдена (IV), окись молибдена), Mo2O5 (оксид молибдена (V), окись молибдена), MoO3 (оксид молибдена (VI), триоксид молибдена, триоксомолибден, молибдит) |
| 43 | Технеций | Tc | TcO2 (оксид технеция (IV), окись технеция (IV)),
Tc2O7 (оксид технеция (VII), окись технеция (VII)) |
| 44 | Рутений | Ru | Ru2O3 (оксид рутения (III), окись рутения (III), сесквиоксид рутения),
RuO2 (оксид рутения(IV), окись рутения (IV)), RuO4 (оксид рутения(VIII), тетраоксид рутения) |
| 45 | Родий | Rh | RhO (оксид родия (II), окисел родия),
Rh2O3 (оксид родия (III), сесквиоксид родия), RhO2 (оксид родия (IV), окисел родия) |
| 46 | Палладий | Pd | PdO (оксид палладия (II), окись палладия),
Pd2O3•n H2O (оксид палладия (III), окисел палладия), PdO2 (оксид палладия (IV), окисел палладия) |
| 47 | Серебро | Ag | Ag2O (оксид серебра (I)),
Ag+1Ag+3O2 или Ag2O2 (оксид серебра (I,III), оксид серебра (III)-серебра (I), монооксид серебра, диоксид дисеребра) |
| 48 | Кадмий | Cd | Cd2O (оксид кадмия (I)),
CdO (оксид кадмия (II)) |
| 49 | Индий | In | In2O (оксид индия (I), окись индия (I), гемиоксид индия, закись индия),
InO (оксид индия (II), окись индия (II)), In2O3 (оксид индия (III)) |
| 50 | Олово | Sn | SnO (оксид олова (I), монооксид олова, олово окись (II), олово закись, олово одноокись),
SnO2 (оксид олова (IV), окись олова, двуокись олова, диоксид олова, касситерит), Sn3O4 |
| 51 | Сурьма | Sb | Sb2O3 (оксид сурьмы (III), сесквиоксид сурьмы, сурьмянистый ангидрид),
Sb2O5 (оксид сурьмы (V), пятиокись сурьмы, сурмяный ангидрид), Sb2O4 или SbIIISbVO4 (тетраоксид сурьмы, диоксид сурьмы) |
| 52 | Теллур | Te | TeO2 (оксид теллура (IV), диоксид теллура, теллурит, двуокись теллура, ангидрид теллуристой кислоты),
TeO3 (оксид теллура (VI), триоксид теллура, трёхокись теллура, ангидрид теллуровой кислоты), Te2O5, Te4O9 |
| 53 | Йод | I | I+12O (монооксид дийода),
I+2O (монооксид йода), I+4O2 (диоксид йода), I+3, +52O4 или I+3O(I+5O3) или (I+3, +5O2)2 (тетраоксид дийода, иодноватокислый йод), I+52O5 или O(IO2)2 (оксид йода (V), пентаоксид дийода, иодноватый ангидрид), I+3, +54O9 или I+3(I+5O3)3 или I+3(OI+5O2)3 (иодат йода (III), иодноватокислый йод, нонаоксид тетрайода) |
| 54 | Ксенон | Xe | XeO2 (оксид ксенона (IV), диоксид ксенона),
XeO3 (триоксид ксенона), XeO4 (тетраоксид ксенона) |
| 55 | Цезий | Cs | Cs2O (оксид цезия, окись цезия) |
| 56 | Барий | Ba | BaO (оксид бария, окись бария, безводный барит) |
| 57 | Лантан | La | La2O3 (оксид лантана (III), сесквиоксид лантана) |
| 58 | Церий | Ce | Ce2O3 (оксид церия (III)),
CeO2 (оксид церия (IV), диоксид церия, двуокись церия) |
| 59 | Празеодим | Pr | PrO (оксид празеодима (II), монооксид празеодима),
Pr2O3 (оксид празеодима (III), сесквиоксид празеодима), PrO2 (оксид празеодима (IV), окись празеодима), Pr6O11 (оксид празеодима (III, IV), ундекаоксид гексапразеодима) |
| 60 | Неодим | Nd | NdO (оксид неодима (II), окисел неодима),
Nd2O3 (оксид неодима (III), сесквиоксид неодима) |
| 61 | Прометий | Pm | Pm2O3 (оксид прометия (III), сесквиоксид прометия) |
| 62 | Самарий | Sm | SmO (оксид самария (II), монооксид самария, окись самария),
Sm2O3 (оксид самария (III), сесквиоксид самария, окись самария) |
| 63 | Европий | Eu | EuO (оксид европия (II), монооксид европия, окись европия),
Eu3O4 или или EuO•Eu2O3 (оксид европия (II,III)), Eu2O3 (оксид европия (III)) |
| 64 | Гадолиний | Gd | Gd2O3 (оксид гадолиния (III), окись гадолиния) |
| 65 | Тербий | Tb | Tb2O3 (оксид тербия (III), трехокись тербия, триоксид тербия),
Tb4O7 (оксид тербия (III, IV), гептаоксид тетратербия), TbO2 (оксид тербия (IV), диоксид тербия), Tb6O11 |
| 66 | Диспрозий | Dy | Dy2O3 (оксид диспрозия (III), окись диспрозия, триоксид диспрозия) |
| 67 | Гольмий | Ho | Ho2O3 (оксид гольмия (III), окись гольмия) |
| 68 | Эрбий | Er | Er2O3 (оксид эрбия (III), окись эрбия, триоксид эрбия) |
| 69 | Тулий | Tm | Tm2O3 (оксид тулия (III), сесквиоксид тулия) |
| 70 | Иттербий | Yb | Yb2O3 (оксид иттербия (III), окись иттербия , сесквиоксид иттербия) |
Таблица оксидов (3 часть):
| 71 | Лютеций | Lu | Lu2O3 (оксид лютеция (III), окисел лютеция) |
| 72 | Гафний | Hf | HfO2 (оксид гафния (IV), окись гафния) |
| 73 | Тантал | Ta | Ta2O (оксид тантала (I), закись тантала),
TaO (оксид тантала (II), окись тантала), TaO2 (оксид тантала (IV), окись тантала), Ta2O5 (оксид тантала (V), окись тантала, пентаоксид тантала) |
| 74 | Вольфрам | W | WO2 (оксид вольфрама (IV), окись вольфрама, двуокись вольфрама, диоксид вольфрама),
WO3 (оксид вольфрама (VI), триоксид вольфрама, трёхокись вольфрама, вольфрамовый ангидрид, ангидрид вольфрамовой кислоты) |
| 75 | Рений | Re | Re2O (оксид рения (I), окись рения),
ReO (оксид рения (II), окись рения), Re2O3 (оксид рения (III), окисел рения), ReO2 (оксид рения (IV), окись рения (IV)), Re2O5 (оксид рения (V), окисел рения), ReO3 (оксид рения (VI), окись рения (VI)), Re2O7 (оксид рения (VII), окись рения (VII), рениевый ангидрид) |
| 76 | Осмий | Os | |
| 77 | Иридий | Ir | |
| 78 | Платина | Pt | |
| 79 | Золото | Au | |
| 80 | Ртуть | Hg | |
| 81 | Таллий | Tl | |
| 82 | Свинец | Pb | |
| 83 | Висмут | Bi | |
| 84 | Полоний | Po | |
| 85 | Астат | At | |
| 86 | Радон | Rn | |
| 87 | Франций | Fr | |
| 88 | Радий | Ra | |
| 89 | Актиний | Ac | |
| 90 | Торий | Th | |
| 91 | Протактиний | Pa | |
| 92 | Уран | U | |
| 93 | Нептуний | Np | |
| 94 | Плутоний | Pu | |
| 95 | Америций | Am | |
| 96 | Кюрий | Cm | |
| 97 | Берклий | Bk | |
| 98 | Калифорний | Cf | |
| 99 | Эйнштейний | Es | |
| 100 | Фермий | Fm | |
| 101 | Менделевий | Md | |
| 102 | Нобелий | No | |
| 103 | Лоуренсий | Lr | |
| 104 | Резерфордий (Курчатовий) | Rf | |
| 105 | Дубний (Нильсборий) | Db | |
| 106 | Сиборгий | Sg | |
| 107 | Борий | Bh | |
| 108 | Хассий | Hs | |
| 109 | Мейтнерий | Mt | |
| 110 | Дармштадтий | Ds |
Коэффициент востребованности
33 680
|
Библиотека
Соглашение об Материалы
Во всех остальных Ó |
Савельев
А.Е.
Химия.
Изучение
с пониманием.
-
Светлой
памяти моей любимой мамочки
посвящается…
Предлагаемое
учебное пособие содержит материал
необходимый для полноценного обучения
основам общей химии. В книге приведены
правила общей химии, которые подробно
разобраны на конкретных примерах.
Алгоритмы составления формул, уравнений
реакций и т.п. снабжены пояснительными
схемами.
Пособие
предназначено для школьников, абитуриентов
и учителей химии.
Учитель
химии средней школы № 405
Copyright.
Савельев Алексей Евгеньевич, 1998 ©
¾
1 ¾
Существует
четыре основных класса неорганических
веществ:
кислоты,
основания, оксиды, соли.
Таблица
1.
-
КЛАСС
ВЕЩЕСТВОКСИДЫ
ОСНОВАНИЯ
КИСЛОТЫ
СОЛИ
КАК
ОТЛИЧИТЬ ОДИН КЛАСС ОТ ДРУГОГО
?Слово
“ОКСИД”в
названииСлово
“ГИДРОКСИД”
в
названииСлово
“КИСЛОТА”
в
названииЛюбое
другоеслово
кроме:оксид,
гидроксид или кислота1)
Два элемента2)
Второй элемент —КИСЛОРОД
1)
Справа отпервого
элементаОН
— группа1)
Первый элементв
формуле —ВОДОРОД
1)
Справа отпервого
элементакислотный
остаток
Сu
ONa2
OFe2
O
3K
OHСa
(OH)2Fe
(OH)3H
ClH2
SO4H3
PO4Cu
Cl2Na2
SO4Mg3
(PO4)2
Правила
составления формул по названию.
I. Составление формул оксидов и оснований.
Чтобы
рационально научиться составлять
формулы веществ, принадлежащих к этим
классам необходимо действовать следующим
образом:
1)
Прочитайте название вещества и напишите
составные части символами элементов:
-
Название
вещества:Выполненное
действие:Пояснения:
оксид
алюминияAl
OСлово
оксид означает, чтопосле
символа алюминия ( Al ) надозаписать
символ кислорода ( О )
гидроксид
железа (III)Fe
OHСлово
гидроксид означает, чтопосле
символа железа ( Fe ) надозаписать
гидроксильную группу ( ОН )
2)
Проставьте валентности химических
элементов над символами элементов.
¾
2 ¾
-
Название
вещества:Выполненное
действие:Пояснения:
оксид
алюминияIII
IIAl
OВалентность
алюминия ( Аl )не
указана в названии. Смотримв
таблицу Менделеева (cм. ниже)Там
этот металл стоит в III группе, значит,
его валентность равна III.Валентность
кислорода ( О )всегда
равна II
гидроксид
железа (III)III
IFe
OHВалентность
железа ( Fe )указана
в названии. Она равна III.Валентность
ОH — группывсегда
равна I
Таблица:
Определение валентности по периодической
системе:
В
таблице Менделеева вертикальные столбцы,
обозначенные римскими цифрами
(I,
II, III и т.д.) — это ГРУППЫ ЭЛЕМЕНТОВ.
-
Периоды
Группы
элементовI
II
III
IV
V
VI
VII
VIII
1
H
He
2
Li
Be
B
C
N
O
F
Ne
3
Na
Mg
Al
Si
P
S
Cl
Ar
4
K
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
Kr
5
Rb
Sr
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
In
Sn
Sb
Te
I
Xe
6
Cs
Ba
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
TI
Pb
Bi
Po
At
Rn
7
Fr
Ra
Ac
Db
JI
Rf
Bh
Hn
Mt
3)
Найдите наименьшее общее кратное (НОК)
— самое маленькое число, которое можно
разделить на обе валентности и получить
целые числа. Наименьшее общее кратное
(НОК) разделите на каждую из валентностей
и проставьте ИНДЕКСЫ ( цифры внизу справа
у символа элемента) в формулу.
-
Выполненное
действие:Пояснения:
НОК
= 6III
IIAl2O3
6
: III = 2 6 : II = 3Самое
маленькое число, делящаеся на обе
валентностит.е.
на III и на II это 6.Разделив
6 на обе валентности, получаем индексы,которые
записываем справа внизу от знака
элемента.
¾
3 ¾
-
Выполненное
действие:Пояснения:
НОК
= 3III
IFe(OH)3
3
: III = 1 3 : I = 3Самое
маленькое число, делящаеся на обе
валентностинацело,
т.е. на III и на I это 3.Разделив
3 на обе валентности, получаем индексы.Для
железа индекс 1 не записываемОН
— группа состоит из двух элементов,
поэтому,её
берут в скобки и за скобками пишут
индекс 3
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
.
Порядок составления формул оксидов
Формулы
оксидов можно составлять по правилу креста:

Рис.1

формул первым ставят
элемент степень окисления. которого со знаком +, а
вторым элемент с отрицательной степенью окисления. Для оксидов это
всегда кислород.
Далее
необходимо:
1. расставить степени
окисления
(с.о.) для каждого атома. Кислород в оксидах всегда имеет с.о. -2
(минус два).
2. Для того чтобы
правильно
определить степень окисления. второго элемента необходимо познакомится
с таблицей возможных степеней окисления некоторых элементов:
Таблица.1 Степени окисления некоторых элементов
|
Элемент |
Возможные степени окисления |
| N (азот) | -3, 0, +1, +2, +3, +4,+5. |
| P (фосфор) | -3, 0, +3, +5. |
| S (сера) | -2, 0, +4, +6. |
| C (углерод) | -4, 0, +2, +4. |
Степень окисления «0» —
ноль имеют:
1. Простые вещества: Н2,
Са, О2 …
2. Сложные в-ва (в сумме): Са+2О-2 (+2 – 2 =0)
Степень окисления со знаком +
характерна для элементов которые отдают свои электроны в соединениях
другим атомам или от которых оттянуты общие электронные пары, т.е.атомы
менее электроотрицательных элементов. например металлы
всегда имеют положительную степени окисления.
Подсказка: Узнать степени окисления для металлов
можно в таблице «растворимости…«.
В ней представлены заряды ионов металлов они обычно совпадают со
степенью окисления.
С неметаллами кислород образует оксид, если только этот неметалл менее
электроотрицательный, чем сам кислород см. таблицу
электроотрицательности.
рис.2

окисления.
элементов в бинарных соединениях равны по модулю, то индексы в формуле
не ставятся: Сa+2О-2.
Составим формулу
оксида натрия:
По
таблице растворимости заряд иона натрия +,
соответственно степень окисления натрия имеет значение +1 (Na+1),
с.о. кислорода в оксидах всегда -2.
Натрий
имеет положительный заряд, значит, его ставим первым, а вторым
ставим кислород и по правилу креста получим: Na2+1O-2
или Na2O.
Правило
наименьшего общего кратного
это способ наиболее универсальный для составления формул. Как им
пользоваться рассмотрим на примере.
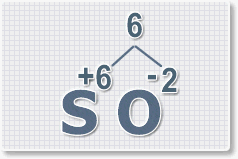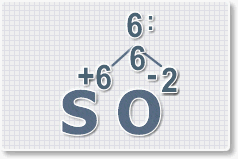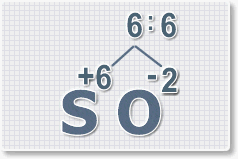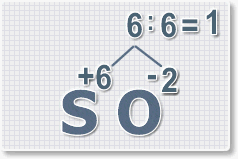
Составить формулу
оксида серы (VI).
1.
У кислорода с.о. -2 следовательно в формуле он ставиться вторым, а
первым элементом будет сера ее с.о. указана в названии оксида VI, т. е
+6. S+6O-2.
2.
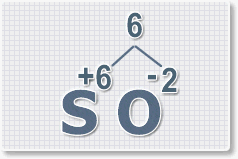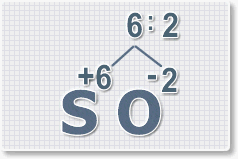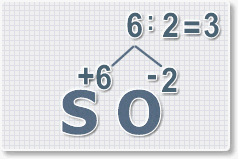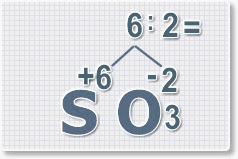
Найдем наименьшее общее кратное. Для чисел 2 и 6 это будет 6.
3.
Находим индексы и расставляем для каждого элемента. См. рисунки ниже.
6 : 6 = 1 это индекс для серы.
Индексы со значением 1 в формулах не ставятся.
Рис.3
6 : 2 = 3
это индекс для кислорода
Рис.4
В результате получим
формулу оксида серы (VI):
* * *
Формулы оксидов
Общая формула оксидов
Общая формула оксидов: ЭхОу
Кислород имеет второе по величине значение электроотрицательности (после фтора), поэтому большинство соединений химических элементов с кисло родом являются оксидами.
Классификация оксидов
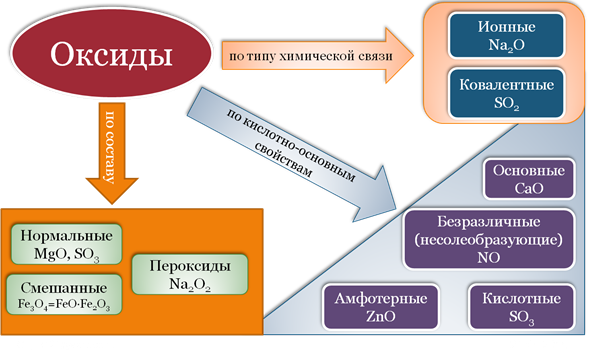
К солеобразующим оксидам относят те оксиды, которые способны взаимодействовать с кислотами или с основаниями с образованием соответствующей соли и воды. К солеобразующим оксидам относятся:
- основные оксиды, которые обычно образуют металлы со степенью окисления +1, +2. Реагируют с кислотами, с кислотными оксидами, с амфотерными оксидами, с водой (только оксиды щелочных и щелочно-земельных металлов). Элемент основного оксида становится катионом в образующейся соли. Na₂O, CaO, MgO, CuO.
- кислотные оксиды – оксиды неметаллов, а также металлов в степени окисления от +5 до +7. Реагируют с водой, со щелочами, с основными оксидами, с амфотерными оксидами. Элемент кислотного оксида входит в состав аниона образующейся соли. Mn2O7, CrO3, SO3, N2O5.
- амфотерные оксиды , которые образуют металлы со степенью окисления от +3 до +5 (к амфотерным оксидам относятся также BeO, ZnO, PbO, SnO). Реагируют с кислотами, щелочами, кислотными и основными оксидами.
Несолеобразующие оксиды не взаимодействуют ни с кислотами, ни с основаниями, соответственно, солей не образуют. N2O, NO, CO, SiO.
Согласно номенклатуре ИЮПАК названия оксидов составляются из слова оксид и названия второго химического элемента (с меньшей электроотрицательностью) в родительном падеже:
Оксид кальция – CaO.
Если элемент способен образовывать несколько оксидов, то в их названиях следует указать степень окисления элемента (римской цифрой в скобках после названия):
Fe2O3 – оксид железа (III);
MnO2 – оксид марганца (IV).
Допускается использовать латинские приставки для указания количества атомов элементов, входящих в молекулу оксида:
Na2O –оксид динатрия;
CO – монооксид углерода;
СО2 – диоксид углерода.
Часто используются также тривиальные названия некоторых оксидов:
|
Формула оксида |
Систематическое название |
Тривиальное название |
|---|---|---|
|
CO |
Оксид углерода (II) |
Угарный газ |
|
CO2 |
Оксид углерода (IV) |
Углекислый газ |
|
MgO |
Оксид магния |
Жженая магнезия |
|
CaO |
Оксид кальция |
Негашеная известь |
|
FeO |
Оксид железа(II) |
Закись железа |
|
Fe2O3 |
Оксид железа(III) |
Окись железа |
|
P2O5 |
Оксид фосфора(V) |
Фосфорный ангидрид |
Примеры решения задач по теме «формулы оксидов»
| Понравился сайт? Расскажи друзьям! | |