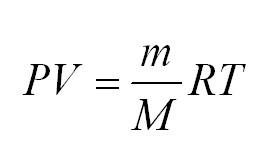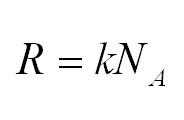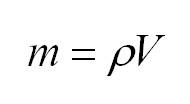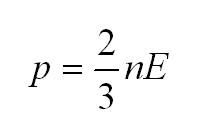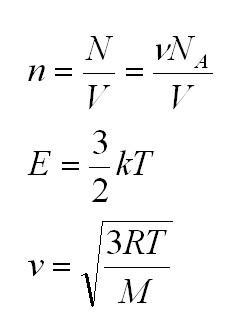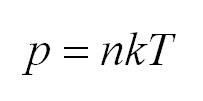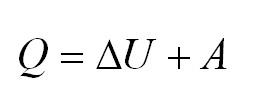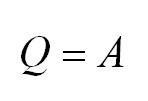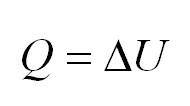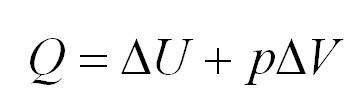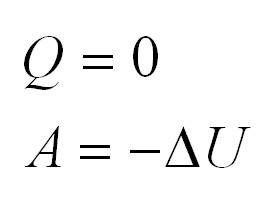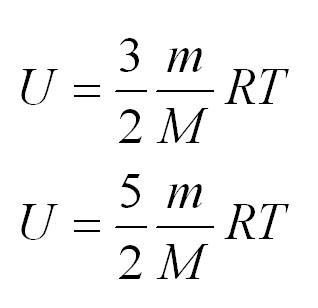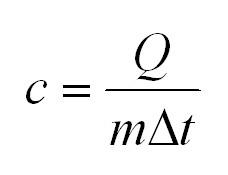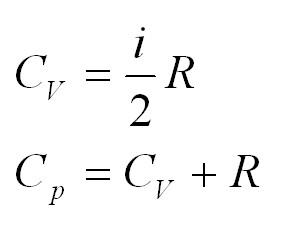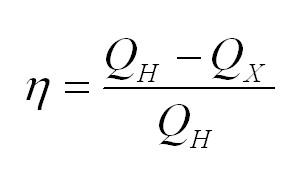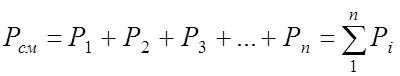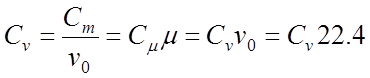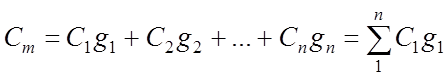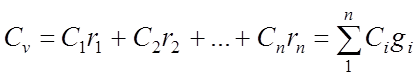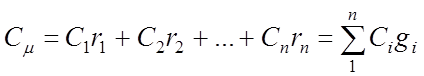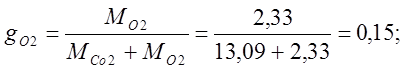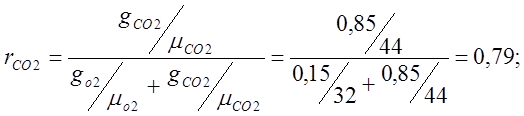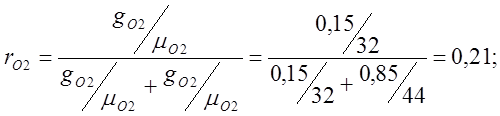Основные формулы термодинамики и молекулярной физики, которые вам пригодятся. Еще один отличный день для практических занятий по физике. Сегодня мы соберем вместе формулы, которые чаще всего используются при решении задач в термодинамике и молекулярной физике.
Ежедневная рассылка с полезной информацией для студентов всех направлений – на нашем телеграм-канале.
Итак, поехали. Попытаемся изложить законы и формулы термодинамики кратко.
Идеальный газ
Идеальный газ – это идеализация, как и материальная точка. Молекулы такого газа являются материальными точками, а соударения молекул – абсолютно упругие. Взаимодействием же молекул на расстоянии пренебрегаем. В задачах по термодинамике реальные газы часто принимаются за идеальные. Так гораздо легче жить, и не нужно иметь дела с массой новых членов в уравнениях.
Итак, что происходит с молекулами идеального газа? Да, они движутся! И резонно спросить, с какой скоростью? Конечно, помимо скорости молекул нас интересует еще и общее состояние нашего газа. Какое давление P он оказывает на стенки сосуда, какой объем V занимает, какая у него температура T.
Для того, чтобы узнать все это, есть уравнение состояния идеального газа, или уравнение Клапейрона-Менделеева
Здесь m – масса газа, M – его молекулярная масса (находим по таблице Менделеева), R – универсальная газовая постоянная, равная 8,3144598(48) Дж/(моль*кг).
Универсальная газовая постоянная может быть выражена через другие константы (постоянная Больцмана и число Авогадро)
Массу, в свою очередь, можно вычислить, как произведение плотности и объема.
Основное уравнение молекулярно-кинетической теории (МКТ)
Как мы уже говорили, молекулы газа движутся, причем, чем выше температура – тем быстрее. Существует связь между давлением газа и средней кинетической энергией E его частиц. Эта связь называется основным уравнением молекулярно-кинетической теории и имеет вид:
Здесь n – концентрация молекул (отношение их количества к объему), E – средняя кинетическая энергия. Найти их, а также среднюю квадратичную скорость молекул можно, соответственно, по формулам:
Подставим энергию в первое уравнение, и получим еще один вид основного уравнения МКТ
Первое начало термодинамики. Формулы для изопроцессов
Напомним Вам, что первый закон термодинамики гласит: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа U и на совершение газом работы A. Формула первого закона термодинамики записывается так:
Как известно, с газом что-то происходит, мы можем сжать его, можем нагреть. В данном случае нас интересуют такие процессы, которые протекают при одном постоянном параметре. Рассмотрим, как выглядит первое начало термодинамики в каждом из них.
Кстати! Для всех наших читателей сейчас действует скидка 10% на любой вид работы.
Изотермический процесс протекает при постоянной температуре. Тут работает закон Бойля-Мариотта: в изотермическом процессе давление газа обратно пропорционально его объёму. В изотермическом процессе:
Изохорный процесс протекает при постоянном объеме. Для этого процесса характерен закон Шарля: При постоянном объеме давление прямо пропорционально температуре. В изохорном процессе все тепло, подведенное к газу, идет на изменение его внутренней энергии.
Изобарный процесс идет при постоянном давлении. Закон Гей-Люссака гласит, что при постоянном давлении газа его объём прямо пропорционален температуре. При изобарном процессе тепло идет как на изменение внутренней энергии, так и на совершение газом работы.
Адиабатный процесс. Адиабатный процесс – это такой процесс, который проходит без теплообмена с окружающей средой. Это значит, что формула первого закона термодинамики для адиабатного процесса выглядит так:
Внутренняя энергия одноатомного и двухатомного идеального газа
Теплоемкость
Удельная теплоемкость равна количеству теплоты, которое необходимо для нагревания одного килограмма вещества на один градус Цельсия.
Помимо удельной теплоемкости, есть молярная теплоемкость (количество теплоты, необходимое для нагревания одного моля вещества на один градус) при постоянном объеме, и молярная теплоемкость при постоянном давлении. В формулах ниже, i – число степеней свободы молекул газа. Для одноатомного газа i=3, для двухатомного – 5.
Тепловые машины. Формула КПД в термодинамике
Тепловая машина, в простейшем случае, состоит из нагревателя, холодильника и рабочего тела. Нагреватель сообщает тепло рабочему телу, оно совершает работу, затем охлаждается холодильником, и все повторяется вновь. Типичным примером тепловой машины является двигатель внутреннего сгорания.
Коэффициент полезного действия тепловой машины вычисляется по формуле
Вот мы и собрали основные формулы термодинамики, которые пригодятся в решении задач. Конечно, это не все все формулы из темы термодинамика, но их знание действительно может сослужить хорошую службу. А если возникнут вопросы – помните о студенческом сервисе, специалисты которого готовы в любой момент прийти на выручку.
Теплоемкость, энтальпия, смеси идеальных газов, внутренняя энергия, работа, термодинамические процессы
Страницы работы
Содержание работы
Практическая работа № 2
Тема: Теплоемкость, энтальпия, смеси идеальных газов,
внутренняя энергия, работа, термодинамические процессы.
Цель работы: Закрепление знаний,
полученных при теоретическом обучении, приобретение навыков в осуществлении
теплотехнических расчетов.
I.
Основные определения, формулы и уравнения
1. Смеси
идеальных газов
Газовой
смесью называется механическая смесь нескольких газов, химически не
взаимодействующих между собой. Каждый из газов, входящих в смесь, называется
газовым компонентом; ведет себя так, как если бы других газов в смеси не было,
т.е. равномерно распределяется по всему объему смеси. Давление, которое
оказывает каждый газ смеси на стенки сосуда, называюется парциальным. Основным
законом для смесей идеальных газов является закон Дальтона, согласно которому
давление смеси равно сумме парциальных давлений газов, образующих смесь:
2. Внутренняя энергия
Внутренняя энергия тела представляет собой совокупность
кинетической энергии движения микрочастиц, составляющих тело, и потенциальной
энергии их. взаимодействия, определяемой. силами взаимного притяжения или
отталкивания. Абсолютную величину внутренней энергии определить не
возможно, поэтому в термодинамических расчетах вычесляется не абсолютная
величина внутренней энергии, а ее изменение, т.е.
или
где U1 и U2 — внутренняя энергия начального и конечного состояния рабочего
тела (газа);
u1 и и2
— уд. внутренняя энергия начального и конечного состояния рабочего тела.
Отсюда вытекает,
что изменение внутренней энергии не зависит от характера и пути процесса, а
определяется состоянием рабочего тела в начале и конце процесса изменения.
Особенностью идеального газа является отсутствие в нем сил
молекулярных взаимодействий, а значит и отсутсвие внутренней потенциальной
энергии, т.е. Un=0 и и„ = 0. Следовательно, внутренняя энергия идеального газа:
U=Uk=f(T) unu u=uk=f(T).
З.Работа газа.
В термодинамике всякое изменение состояния рабочего тела в
результате обмена энергией с окружающей средой называется процессом. При этом
изменяются основные параметры рабочего тела:
P, v
и Т.
Преобразования теплоты в механическую работу связано с
процессом изменения состояния рабочего тела. Процессы изменения состояния газа
могут быть процессами расширения и сжатия. Для произвольной массы газа М (кг)
работа равна:
L = М l = Мр (v2— v1) =
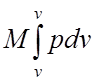
где l = р (v2-v1) Дж/кг — работа 1 кг газа или удельная работа.
4.
Энтальпия газа,
Энтальпия — это параметр, характеризующий потенциальную
энергию связи рабочего тела (газа) с окружающей средой. Энтальпия и удельная
энтальпия:
I = U + pV, Дж и ii= и +pv , Дж/кг.
5.
Теплоемкость.
Удельной теплоемкостью называется количество тепла, которое
нужно подвести к 1 кг газа, чтобы нагреть его на 1°С в данном интервале
температур.
Удельная
теплоемкость бывает массовой, объeмной и киломольной. Между массовой С
, объемной C и киломольной С теплоемкостями существует связь:
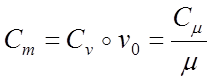
где Vo 22,4 м3/кмоль
— уд. объем газа при нормальных условиях.
Массовая уд.
теплоемкость газовой смеси:
Объемная удельная теплоемкость газовой смеси:
Киломольная удельная теплоемкость газовой смеси:
6.Уравнение для
определения количества тепла
Количество тепла, отдаваемое или воспринимаемоен рабочим
телом (газом) можно определить по уравнению:
Q = M Cm(t2-t1),
Дж или Q = VC
(t-t), Дж , где М и V — весовое или объемное количество газа, кг или м3
;
t u
t — температура газа в конце и а начале процесса ° С;
С и С — массовая и объемная средняя уд. теплоемкость газа
При tcp=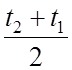
7. Первый закон
термодинамики
Этот закон рассматривает взаимопревращения тепла и
механической работы. По этому закону тепло превращается в механическую работу и
наоборот, механическая работа в тепло в строго эквивалентных количествах.
Уравнение эквивалентности тепла и работы имеет вид:
Q =L; q=l,
С учетом принципа
эквивалентности тепла и работы, уравнение теплового баланса для произвольной
массы газа:
Q
= U + L
и q =и+l= u –u
+l
Решение задач II
Задача
№1 (№1)
Атмосферный сухой
воздух имеет следующий примерный массовый состав: g02=23,2%, gN2=76,8%.
Определить объемный состав воздуха,
его газовую постоянную, кажущуюся молекулярную массу, парциальное давление
кислорода и азота, если воздуха по барометру Р=101325 Па.
Определяю объемный состав воздуха:
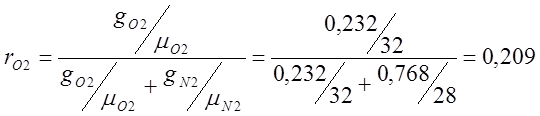
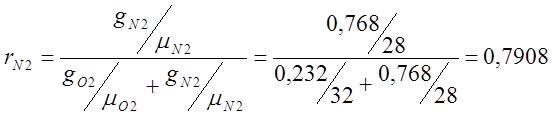
где r – массовая доля;
m — относительная молекулярная масса;
g – объемная доля.
Определяю кажущуюся молекулярную массу
воздуха:
mвозд.=mO2rO2 +mN2rN2 = 32·0,209 + 28·0,7908=6,688+22,14=28,83;
Определяю индивидуальную газовую постоянную
для воздуха (R):
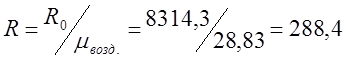
где R0 – газовая постоянная.
Определяю парциальные давления различных
газов:
PO2=Pсм· rО2 =101325·0,209=21176,9 (Па);
PN2=Pсм· rN2 =101325·0,7908 = 80127,81
(Па);
где PO2, PN2 – парциальное давление;
Pсм – давление смеси.
Задача
№2 (№2)
Сосуд разделен перегородкой на 2 части, объемы
которых V1=1,5 м3 и V2=1,0 м3. В первой части объемом V1 содержится
СО2 при Р1=0,5 Мпа и t1=30°С; во второй части объемом V2 содержится О2
при Р2=0,2 Мпа и t2=57°С. Определить массовые и объемные доли СО2 и О2,
кажущуюся молекулярную массу смеси и ее газовую постоянную после того, как
перегородка будет убрана и процесс смешения закончится.
Определяю индивидуальные газовые
постоянные:
Для этого определяю относительную молекулярную
массу: m(СО2) =32+12=44; m(О2)=32;
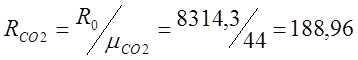
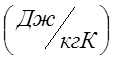
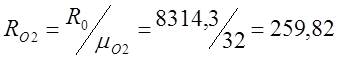
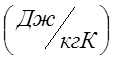
Согласно характеристическому уравнению
Клайперона, определяю массы газов:
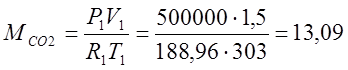
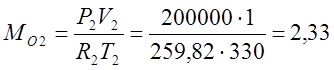
Определяю массовые доли:
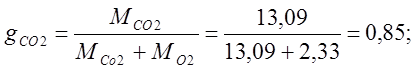
Определяю объемные доли:
Определяю кажущуюся молекулярную массу
воздуха:
mвозд.=mО2rO2 +mСО2rСО2 = 32·0,21 + 44·0,79=6,72+34,74=41,48;
Определяю индивидуальную газовую постоянную
для воздуха (R):
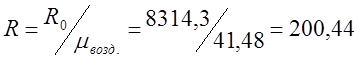
Задача
№3 (№6)
В сосуде объемом
300л находится кислород при давлении Р1=0,2 Мпа и t1=200С.
Какое количество теплоты нужно подвести, чтобы температура кислорода повысилась
до t2=3000С ? Какое давление установится при этом в сосуде ? Для
расчета принять среднюю объемную удельную теплоемкость кислорода при н.у. С02
=0,935
По закону Шарля определяю конечное давление
процесса:
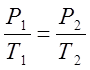
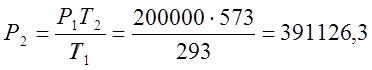
где Р,Т – параметры газа.
Определяю индивидуальную газовую постоянную
для кислорода (R):
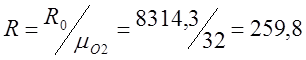
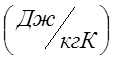
Так как процесс изохорный то
определяю количество теплоты которое нужно подвести по соответствующей
формуле: Qv=M·Сcv·(T2-T1) для этого согласно характеристическому
уравнению Клайперона, определяю массу газа
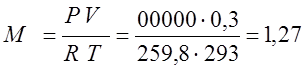
Задача
№4 (№7)
Какое
количество теплоты
необходимо затратить, чтобы нагреть 2м3 воздуха при постоянном
избыточном давлении Ризб.=0,2 МПа от температуры 1000С до
температуры 5000С. Какую работу при этом совершит воздух? Для
расчета принять: давление атмосферы Рат.=0,1 Мпа, среднюю
массовую изобарную теплоемкость воздуха Сpm=1,022 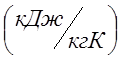
имея ввиду, что кажущаяся молекулярная масса воздуха Мвозд.=29.
Определяю индивидуальную газовую
постоянную для воздуха:
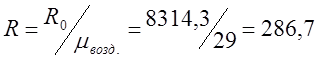
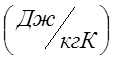
Абсолютное давление равно сумме избыточного и
атмосферного Р=Ризб.+Рат.=0,1+0,2=0,3 МПа
Согласно характеристическому уравнению
Клайперона, определяю массу газа:
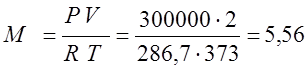
Так как процесс изобарный то определяю Q и L по соответствующим формулам:
по закону Гей-Люссака определяю конечный
объем:
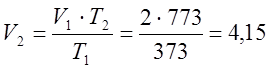
Q=M·Cpm·(T2-T1)=
5,56·1022·400=2272928 (Дж);
L=P·(V2-V1)=300000·2,15=645000 (Дж).
Задача
№5 (№8)
В цилиндре находится воздух при
давлении Р=0,5 Мпа и температуре t1=4000C. От воздуха отнимается теплота при Р=const так, что в конце процесса устанавливается температура t2=00C. Объем цилиндра, в котором находится воздух V1=400л.
Определить количество отнятой
теплоты, конечный объем, изменеие внутренней энегии и совершенную работу сжатия
Cpm=1,028 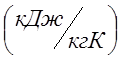
Так как процесс изобарный то по закону
Гей-Люссака определяю конечный объем:
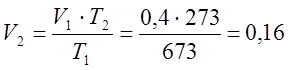
Согласно характеристическому уравнению
Клайперона, определяю массу газа:
Из предыдущей задачи R=286,7 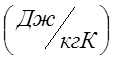
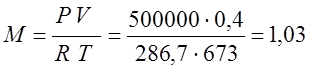
Определяю количество теплоты которое
выделяется:
Q=M·Cpm·(T2-T1)=1,03·1028·(273-673)=-423536
(Дж);
Определяю количество затраченной работы:
L=P·(V2-V1)= 500000·(0,16-0,4)=-120000 (Дж);
Из уравнения, по которому определяется полное
количество, определяю изменение количества внутренней энергии:
;
(Дж)
Задача
№6 (№9)
Воздух, имеющий обьем V1=0,02 м3 при давлении Р1=1,1МПа и t1=25с расширяется
в цилиндре с подвижным поршнем до давления Р2=0,11Мпа. Найти
конечный обьем V2, конечную
температуру t2, работу, произведенную воздухом, и подведенную
теплоту, если расширение в цилиндре происходит:
а) изотермически
б) адиабатно с показателем адиабаты
к=1,4
в) политропно с показателем
политропы n=1,3
Изотермический процес:
T1=T2=298k
P1/P2=V2/V1
V2=0,02·1,1/0,11=0,2M3
Q=L=RMT1Ln(V2/V1)=P1V1Ln(V2/V1)=1,1·106·0,02Ln(0,2/0,02)=22000Дж
Адиабатный процес:
PVk-const
V1/V2=(P2/P1)1/k
V2=V1/(P2/P1)1/k=0,02/(0,11/1,1)1/1,4=0,1036M3
T2/T1=(P2/P1)k-1/k
T2=(P2/P1)k-1/k·T1=(0,11/1,1)1,4-1/1,4·298=20,32k
Q=0
Rвоз=286,7
Сv=727,4Дж/кг·k
L=1/k-1(P1V1-P2V2)
=(1/1,4-1)· (1,1·106·0,02 -0,11·106·0,1)=2,0275·106Дж
Политропный процес:
V1/V2=(P2/P1)1/n
V2=V1/(P2/P1)1/n=0,02/(0,11/1,1)1/1,3=0,118M3
T2/T1=(P2/P1)n-1/n
T2=(P2/P1)n-1/n·T1=(0,11/1,1)1,3-1/1,3·298=175k
L= 1/n-1(P1V1-P2V2)=
(1/(1,3-1))· (1,1·106·0,02 -0,11·106·0,118)=30000Дж
l=L/M
Q=(k-n/k-1)·l·M=((1,4-1,3)/(1,4-1))·30000=7500Дж
Литература:
1. «Энергия», Москва,
1975.
2. Литвин А.М. «Теоретические основы теплотехники», издательство
«Энергия», Москва,1969.
3. Тугунов П.И., Самсонов А.А., «Основы теплотехники, тепловые двигатели и
паросиловое хозяйство», издательство «Недра», Москва, 1970.
4. Крутов В.И., «Теплотехника», издательство «Машиностроение», Москва,
1986.
Похожие материалы
- Определение характеристик изобретательской деятельности
- Расчет резьбы и стержня винта
- Визначення характеристик винахідницької діяльності
Информация о работе
Тип:
Отчеты по лабораторным работам
Роман Алексеевич Лалетин
Эксперт по предмету «Физика»
Задать вопрос автору статьи
В термодинамике изучают самые общие законы и физические процессы преобразований внутренней энергии. При этом считается, что любое материальное тело имеет тепловую энергию $U$, которая зависит от его температур.
Перед тем, как рассмотреть основные термодинамические формулы необходимо дать определение термодинамике.
Определение 1
Термодинамика — это обширный раздел физики, который исследует и описывает процессы, происходящие в системах, а также их состояния.
Указанное научное направление опирается на обобщенные факты, которые были получены опытным путем. Происходящие в термодинамических концепциях явления описываются посредством использования макроскопических величин.
В их список входят такие параметры, как:
Сдай на права пока
учишься в ВУЗе
Вся теория в удобном приложении. Выбери инструктора и начни заниматься!
Получить скидку 3 000 ₽
- давление;
- температура;
- концентрация;
- энергия;
- объем.
К отдельным молекулам данные параметры неприменимы, а сводятся к детальному описанию системы в общем ее виде. Много решений, которые основаны на термодинамических законах, можно встретить в сфере электроэнергетики и тепловой техники. Что и свидетельствует о понимании фазовых переходов, химических процессов и явлений переноса. В некотором роде термодинамика тесно “сотрудничает” с квантовой динамикой.
Уравнение идеального газа в термодинамике
Рисунок 1. Работа в термодинамике. Автор24 — интернет-биржа студенческих работ
Определение 2
Идеальный газ – это некая идеализация, такая же, как и материальная точка.
«Основные формулы термодинамики» 👇
Молекулы такого элемента являются материальными точками, а соударения частиц – абсолютно упругие и постоянные. В задачах по термодинамике реальные газы зачастую принимаются за идеальные. Так гораздо легче составлять формулы, и не нужно иметь дела с огромным количеством новых величин в уравнениях.
Итак, молекулы идеального газа движутся, а вот чтобы узнать с какой скоростью и массой, необходимо использовать уравнение состояния идеального газа, или формулу Клапейрона-Менделеева: $PV = frac{m}{M}RT$. Здесь $m$ – масса исследуемого газа, $M$ – его изначальная молекулярная масса, $R$ – универсальная постоянная, равная 8,3144598 Дж/(моль*кг).
В этом аспекте массу идеального газа также можно вычислить, как произведение объема и плотности $m = pV$. Существует некая связь между средней кинетической энергией $E$ и давлением газа. Эта взаимосвязь называется в физике основным уравнением молекулярно-кинетической теории и имеет вид: $p = frac{2}{3}nE$, где $n$ – концентрация движущихся молекул по отношению к общему объему, $E$ – коэффициент средней кинетической энергии.
Первое начало термодинамики. Формулы для изопроцессов
Рисунок 2. Уравнение состояния идеального газа. Автор24 — интернет-биржа студенческих работ
Первый термодинамический закон гласит: количество внутренней теплоты, переданное газу, идёт только на изменение общей энергии газа $U$ и на совершение веществом работы $A$. Формула первого начала термодинамики записывается так: $Q = ΔU + A$.
как известно, с газом в системе всегда что-то происходит, ведь его можно сжать или нагреть. В данном случае необходимо рассмотреть такие процессы, которые протекают при одном стабильном параметре. Первое начало термодинамики в изотермическом случае, который протекает при постоянной температуре, задействует закон Бойля-Мариотта.
В результате изотермического процесса давление газа обратно пропорционально его изначальному объёму: $Q = A.$
Изохорный – наблюдается при постоянном объеме. Для этого явление применим закон Шарля, согласно которому, давление прямо пропорционально общей температуре. В изохорном процессе все подведенное к газу тепло идет на изменение его внутренней энергии и записывается в таком виде: $Q = ΔA.$
Изобарный процесс – происходит при постоянном давлении. Закон Гей-Люссака предполагает, что при неизменном давлении идеального газа его начальный объём прямо пропорционален итоговой температуре. При изобарном процессе тепло идет на совершение газом работы и на изменение внутреннего энергетического потенциала: $Q = Delta U+pDelta V.$
Формула теплоемкости и главная формула КПД в термодинамике
Рисунок 3. Количество теплоты. Автор24 — интернет-биржа студенческих работ
Замечание 1
Удельная теплоемкость в термодинамической системе всегда равна количеству теплоты, которое выделяется для нагревания одного килограмма действующего вещества на один градус Цельсия.
Уравнение теплоемкости записывается таким образом: $c = frac{Q}{mDelta t}$. Помимо указанного параметра, существует и молярная теплоемкость, которая работает при постоянном объеме и давлении.
Ее действия видно в следующей формуле: $C_v = frac {i}{2}R$ где $i$ – количество степеней свободы молекул газа.
Тепловая машина, в самом простейшем случае, состоит из холодильника, нагревателя и рабочего материального тела. Нагреватель изначально сообщает тепло физическому веществу и совершает определенную работу, а затем постепенно охлаждается холодильником, и все повторяется по кругу. Типичным примером тепловой машины выступает двигатель внутреннего сгорания.
Коэффициент полезного действия теплового устройства вычисляется по формуле: $n = frac {Q_h-Q_x }{Q_h }.$
При изучении основ и уравнений термодинамики следует понять, что на сегодняшний день существует два метода описания физических процессов, происходящих в макроскопических материальных телах: статистический и термодинамический.
Методы термодинамики и ее формулы позволяет раскрыть и описать смысл экспериментальных закономерностей в виде закона Менделеева-Клапейрона. Важно понять, что в термодинамических концепциях, в отличие от систем молекулярной физики, не изучаются конкретные взаимодействия, происходящие с определенными молекулами или атомами, а рассматривается постоянные взаимопревращения и связь разнообразных видов теплоты, энергии и работы.
Уравнение состояния и его функции
Рисунок 4. Термодинамические уравнения состояния. Автор24 — интернет-биржа студенческих работ
При исследовании макросостояний применяются функции состояния, которые предполагают показатель, демонстрирующий определённые состояния термодинамического равновесия, независящий от предыстории концепции и метода её перехода в абсолютное состояние.
Основными функциями состояния при грамотном построении термодинамики являются:
- внутренняя энергия;
- энтропия;
- температура;
- термодинамические потенциалы.
Однако функции состояния в термодинамики не являются полностью независимыми, и для однородной системы любой термодинамический принцип может быть записан как выражение двух самостоятельных переменных. Такие функциональные взаимосвязи называются уравнениями общего состояния.
На сегодняшний день различают такие виды уравнений:
- термическое уравнение состояние — определяющее связь между давлением, температурой и объёмом;
- калорическое уравнение — выражающее внутренний энергетический потенциал, как функцию от объёма и температуры;
- каноническое уравнение состояние — записываемое в качестве термодинамического потенциала в соответствующих переменных.
Знание уравнения состояния очень важно для использования на практике общих принципов термодинамики. Для каждой конкретной термодинамической концепции такие выражения определяются из опыта или способами статистической механики, и в пределах термодинамики оно считается заданным при изначальном определении системы.
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Физическая дисциплина «Термодинамика», имеющая дословный перевод с греческого как θέρμη — «тепло», δύναμις — «сила», занимается изучением общих характеристик макросистем и обращения энергии внутри них. Эту науку относят к феноменологическому типу, хотя опирается она на факты, полученные опытным путем.
Термодинамическая система, рассматриваемая в данном ракурсе, имеет конкретные характеристики, не применимые к единичным атомам и молекулам. К ним относят температуру, энергию, объем, концентрацию растворов, давление.
Определение таких параметров происходит по формулам термодинамики.
Основные формулы термодинамики
Особенностью термодинамики является то, что ее постулаты не касаются взаимодействия отдельных единиц (атомов, молекул), как в молекулярной физике. Предметом изучения предстают общие взаимопревращения энергии, образование теплоты, теплопередача и совершение работы.
Исходя из этого, выделяют основные формулы термодинамики, к которым относятся:
- Уравнение Менделеева-Клайперона: (PV=(m/M)*RT). Его смысл — в изменениях трех входящих величин, которые направлены на характеристику состояния идеального газа.
- Количество вещества, обозначаемое буквой (ν). (nu=N/NA=m/mu)
Величина, выражающая, сколько одинаковых структурных компонентов (единиц) находится в веществе.
- Закон Дальтона: давление смеси газов на стенку сосуда равно сумме давлений каждого входящего в смесь элемента: (p=p1+p2+…pn.)
- Главное уравнение МКТ (молекулярно-кинетической теории): (p=2n/3<varepsilon>n=N/V). Выражает математическое соотношение таких параметров, как давление газа и микропараметров: массы молекул, их скорости движения, концентрации.
- Средняя кинетическая энергия поступательного движения молекулы газа. Для обозначения применяется (E_k), выражается через формулу: (E_k=E_{моля}/NA=3/2ast RT/NA). Ее мерой является абсолютная температура идеального газа, поскольку потенциальная энергия (вследствие взаимодействия молекул друг с другом) равна нулю. Зная, что R/NA=k, получается формула: (E_k=3/2ast kT).
- Давление идеального газа прямо пропорционально концентрации и его температуре: (P=nkT.)
- Скорость молекул определяется по формулам:
(V=surd(2kT/m_o)=surd(2RT/mu)) — наиболее вероятная;
(<V>=surd(8kT/pi m_o)=surd(8RT/pimu)) — среднеарифметическая;
(<Vкв>surd(3kT/m_o)=surd(3RT/mu)) — средняя квадратичная. - Сумма кинетических энергий всех молекул определяет внутреннюю энергию всего идеального газа. Математически выражение выглядит так: (U=i/2ast(m/mu)ast RT.)
- Формула для определения работы, которую совершает идеальный газ при расширении:( A=P(V_2-V_1).)
- Формула первого закона термодинамики: (Q=Delta U+A.)
- Для определения удельной теплоемкости вещества применяется математическое выражение: (С=Delta Q/mdT.)
- Кроме удельной теплоемкости, существует понятие молярной теплоемкости. Для ее определения применяется формула: (C=cmu). Для изохорного процесса правильная формула принимает вид: (C_v=1/2ast R), для изобарного: (C_p=((i+2)/2)ast R).
Первое начало термодинамики
Согласно первому закону термодинамики, (Q) (количество внутренней теплоты), которое получил газ извне, расходуется на совершение работы (А) и изменение внутренней энергии (U). Формула закона: (Q=Delta U+A).
На практике газ может быть нагрет либо охлажден. Однако в данном случае рассматривается изотермический процесс, в котором один из характеризующих параметров остается неизменным.
Если процесс изотермичен, в химии включается закон Бойля-Мариота. В нем говорится, что давление газа соотносится к изначальному объему, при стабильной температуре, обратно пропорционально.
(Q=A)
Когда процесс происходит при неизменном объеме, говорят об изохорности. Здесь вступает в действие закон Шарля. В обозначенных условиях то тепло, которое поступило к газу, расходуется на изменение внутренней энергии. Другими словами, (P) пропорционально (T).
(Q=Delta U)
Протекание процессов в идеальном газе при неизменном давлении носит характер изобарного. Здесь действует закон Гей-Люссака, который выражается уравнением:
(Q=Delta U=pDelta V)
Полная формулировка закона гласит: полученное тепло при изобарном процессе расходуется на совершение работы газом, а также изменяет его внутреннюю энергию.
Часть процессов происходят изолированно от внешней среды. Газ не получает дополнительной энергии. Такая ситуация носит название адиабатной и математически записывается: (Q=0). Работа (А) в таком случае выражается: (A=-Delta U.)
Уравнение идеального газа в термодинамике
Молекулы идеального газа постоянно движутся. От того насколько велика скорость их движения, зависит общее состояние газа, а также величина его воздействия, например, на стенки сосуда. Поэтому одним из основных уравнений термодинамики является Клайперона-Менделеева:
(PV=(m/M)ast RT)
В уравнении (m) — единица массы газа, (M) — его молекулярная масса, (R) — универсальная величина, называемая газовой постоянной. Ее значение = 8,3144598. Измеряется в Дж/(моль*кг).
В основе термодинамики лежат и другие газовые постоянные, например, число Авогадро, постоянная Больцмана. Таким образом, (R=kNA.)
Из уравнения Клайперона-Менделеева можно также вычислить массу. Она будет равна произведению плотности на объем: (m=rho V).
Основное уравнение молекулярно-кинетической теории (МКТ)
Решение части задач зависит от знания особенностей взаимосвязи между давлением газа и характеристикой кинетической энергии его молекул. Математическое выражение такой зависимости носит название основного уравнения МКТ:
(p=2/3ast nE)
В данном выражении кинетическая энергия обозначена буквой (Е), а концентрация молекул — (n). Каждую из этих величин физики можно найти исходя из соответствующих формул, после чего уравнение для молекулярно-кинетической теории (МКТ) приобретает вид:
(p=nkT)
Формула теплоемкости и главная формула КПД в термодинамике
Когда теплообмен проявляется передачей телу определенного количества теплоты, его энергия, как и температура, меняются.
То количество теплоты, обозначаемое (Q), которое понадобится для того, чтобы 1 кг определенного вещества нагреется на 1 К, носит определение теплоемкости вещества и обозначается с.
Математическое выражение относительно переданного количества теплоты выглядит формулой:
(Q=cm(t_2-t_1)=cmDelta t)
Измеряется величина в Дж/(кг∙К).
При t2⟩t1, количество теплоты со знаком плюс, следовательно, вещество нагревается. Если наоборот, то Q — со знаком минус, и вещество остывает.
В физике, характеризуя свойства вещества, говорят о его теплоемкости. Это имеет значение, например, при выборе стройматериалов или сырья для изготовления нагревательных приборов. Теплоемкость равна произведению массы на удельную теплоемкость данного тела:
(C=cm)
Учитывая, что в величине теплоемкости уже отражена масса, то сокращенная формула для определения (Q) выглядит так:
(Q=C(t_2-t_1))
С другой стороны, то количество теплоты, которое отдает источник, можно высчитать по формуле:
(Q=Pt.)
В выражении буквой (P) обозначается мощность нагревателя, а (t) — время их контакта.
Конструкция, состоящая из нагревателя, тела-реципиента теплоты и охладителя, носит название тепловой машины. В качестве примера рассматривается двигатель внутреннего сгорания. Как и любой механизм, она имеет такую характеристику, как КПД — коэффициент полезного действия. Для его расчета применяется формула:
(eta=(Q_н-Q_x)/Q_н)
Внутренняя энергия одноатомного и двухатомного идеального газа
Характерной особенностью идеального газа является отсутствие у его составляющих частей потенциальной энергии. Вся внутренняя энергия — это сумма кинетических энергий всех молекул. Она является величиной, прямо пропорциональной температуре идеального газа:
(mw2/2=alpha T)
В этом уравнении:
(alpha T=3Rmu/2Nmu)
Исходя из приведенных формул, величина кинетической энергии поступательного движения идеального газа должна определяться исходя из выражения:
(mv2/2=(3Rmu/2Nmu)ast T)
Поступательное движение характеризуется тремя степенями свободы. На каждую из них приходится одна треть общей кинетической энергии.
Двух- и более атомные молекулы газа характеризуются степенями свободы, касающимися вращательного движения.
Если обозначить число молекул в одном киломоле за (Nμ), то внутренняя энергия идеального газа будет измеряться по формуле:
(Umu=1/2(Rmu Ti))
В формуле (i) — число степеней свобод.
Если газ одноатомный, (i=3), двуатомный — 5, трех- и более — 6.
Задачи на термодинамику характеризуют распространенные физические процессы, поэтому часть включаются в программы экзаменов. Если для их решения не хватает времени, можно обратиться за помощью в Феникс.Хелп. На профильном сайте вам помогут справиться с любой, даже запутанной задачей, экономя ваши время и силы.