Energy levels and orbitals help describe the electronic structure of an atom. They designate how electrons are arranged within atoms, and the description of such energies is derived from quantum theory.
Quantum Theory
Quantum theory postulates that atoms can only exist in certain energy states. If an atom, or an electron by correlation, changes state, it absorbs or emits an amount of energy equal to the energy difference between the states.
The energy emitted or absorbed is quantized; it is energy characterized by definite amounts. These allowed energy states can be described by sets of numbers called quantum numbers.
Quantum Numbers
An electron’s arrangement in an atom can be described by four quantum numbers: n, l, m_l_ and ms. These relate to energy level, electron subshells, orbital direction and spin, respectively.
First Quantum Number: Energy Level
The first quantum number is designated by n and is the principal energy level.
The principal energy level definition tells the observer the size of the orbital and determines energy. An increase in n is an increase in energy, and this also means the electron is farther away from the nucleus.
The first quantum number can only take integral values, beginning with 1; n = 1, 2, 3, 4 … Each energy level corresponds to a letter as well: n = 1 (K), 2 (L), 3 (M), 4 (N) …
First Quantum Number: Orbital and Electron Calculations
To calculate the amount of orbitals from the principal quantum number, use n2. There are n2 orbitals for each energy level. For n = 1, there is 12 or one orbital. For n = 2, there are 22 or four orbitals. For n = 3 there are nine orbitals, for n = 4 there are 16 orbitals, for n = 5 there are 52 = 25 orbitals, and so on.
To calculate the maximum number of electrons in each energy level, the formula 2n2 can be used, where n is the principal energy level (first quantum number). For example, energy level 1, 2(1)2 calculates to two possible electrons that will fit into the first energy level.
Second Quantum Number: Electron Subshells
The second quantum number denotes sublevels and is designated by the letter l. This quantum number denotes electron subshells and the general shape of the electron cloud.
The first two quantum numbers are related. For any given n, l can take on any integral starting with 0 to a maximum of (n – 1); l = 0, 1, 2, 3 …
The quantum levels, l = 0, 1, 2, 3 correspond to the electron subshells s, p, d, f, respectively. The shape of s is spherical, p is figure-eight shaped, and the d and f orbitals have a more intricate design, mostly involving clover-shaped orbitals.
Each electron subshell can contain a certain amount of electrons, s = 2, p = 6, d = 10 and f = 14.
Third Quantum Number: Orbital Direction
The third quantum number m_l_, denotes how the electron cloud is directed in space.
This quantum number can have any integral value, including 0, between l and –l (the second quantum number), or, m_l = _l … 2, 1, 0, -1, -2 … —l
For l = 0, there is only 1 m_l value, also 0. This contains only one orbital. For a p orbital, ml_ = 1, 0, -1. This corresponds to the three p orbitals in three different directions, px, py, pz, corresponding to the three-dimensional x,y and z axis.
Fourth Quantum Number: Electron Spin
The fourth quantum number designates clockwise or counterclockwise spin.
An electron is a charged particle spinning on an axis and therefore has magnetic properties. This quantum number is not related to n, l, ml, and can have only two possible values: +1/2 or -1/2.
The addition of the fourth quantum number allows electrons to fill into orbitals without breaking the Pauli exclusion principle. This states that no two electrons can have the same set of four quantum numbers.
Using Quantum Numbers to Calculate Orbitals
Recall that finding the amount of orbitals in an energy level can be derived by the formula n2. For the energy level 3, n = (3)2 or nine orbitals.
A more completed calculation can be made using the information from the quantum numbers above. For n = 3, the values of l can be added. For l = 0, there is only one orbital, ml = 0. For l = 1, there are three values (ml = −1, 0 or +1). For l = 2, there are five possible values (ml = −2, −1, 0, +1 or +2). So adding the possibilities gives 1 + 3 + 5 = 9 orbitals in total.

2. ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМОВ. ХИМИЧЕСКАЯ СВЯЗЬ
Любое устойчивое состояние электрона в атоме характеризуется определенными значениями квантовых чисел: n, l, ml, ms, называемых соответственно: главное, орбитальное, магнитное и спиновое.
Состояние электрона в атоме, отвечающее определенным значениям квантовых чисел n, ℓ, ml, называется атомной орбиталью (а.о.). Иначе, атомная орбиталь – это пространство, где наиболее вероятно пребывание электрона.
В зависимости от значения орбитального квантового числа принято следующее обозначение энергетических подуровней:
|
ℓ = 0 |
– s подуровень (п/у) |
|
|
ℓ = 1 |
– p |
-*- |
ℓ= 2 – d -*- ℓ= 3 – f -*-
Каждому типу атомной орбитали соответствует своя форма электронного облака. S – орбиталь сферической формы, р – орбиталь гантелеобразная, d – орбиталь имеет вид розетки, f – орбиталь еще более сложной формы.
Число орбиталей каждого типа определяется числом способов ориентации их в пространстве, т.е. количеством значений магнитного квантового числа – ml . Магнитное квантовое число имеет (2ℓ + 1) значений
(табл. 2.1).
Расчет числа атомных орбиталей на подуровнях |
Таблица 2.1 |
||||
|
Обозначение |
Кол-во знач. |
Кол-во |
|||
|
подуровня |
ml |
а.о. |
|||
|
0 |
s |
0 |
1 |
1 |
|
|
1 |
p |
-1;0; + 1 |
3 |
3 |
|
|
2 |
d |
-2;-1;0; + 1; + 2 |
5 |
5 |
|
|
3 |
f |
-3;-2;-1;0; + 1;+2;+3 |
7 |
7 |
Графически атомная орбиталь изображается 
Согласно принципу Паули в атоме не может быть двух электронов, характеризующихся одинаковым набором квантовых чисел. Из этого следует, что каждая атомная орбиталь может быть занята не более чем двумя электронами, причем их спиновые квантовые числа должны быть различными, что обозначается ↑↓.
15
Таким образом, общее число электронов на энергетическом уровне определяется по формуле ze = 2n2. Количество электронов на подуровне определяется формулой 2(2ℓ + 1). Расчет числа электронов и структуру уровней можно представить в виде табл. 2.2.
Зная структуру каждого подуровня и уровня, можно составить электронные формулы элементов.
Устойчивому (невозбужденному) состоянию многоэлектронного атома отвечает такое распределение электронов по атомным орбиталям, при котором энергия атома минимальна. Поэтому атомные орбитали заполняются в порядке последовательного возрастания их энергий. Порядок заполнения электронами атомных орбиталей определяется правилами Клечковского, которые учитывают зависимость энергии орбитали от значений как главного (n), так и орбитального (ℓ) квантовых чисел. Согласно этим правилам атомные орбитали заполняются электронами в порядке последовательного увеличения суммы (n+1) (первое правило Клечковского), а при одинаковых значениях этой суммы – в порядке последовательного возрастания главного числа n (второе правило Клечковского).
Размещение электронов по атомным орбиталям в пределах одного энергетического подуровня определяется правилом Гунда, согласно которому минимальной энергии атома соответствует такое распределение электронов по атомным орбиталям данного подуровня, при котором абсолютное значение суммарного спина атома максимально; при любом другом размещении электронов атом будет находиться в возбужденном состоянии, т.е. будет характеризоваться более высокой энергией.
Задачи и упражнения
2.1. Как обозначается состояние электрона: а) с n=4, ℓ=2; б) с n=5, ℓ=3.
Р е ш е н и е: При записи энергетического состояния цифрой указывают номер подуровня (n), а буквой – характер подуровня (s, p, d, f). При n=4 и ℓ=2 записываем 4d; при n=5 и ℓ=3 записываем 5f.
Таблица 2.2
Расчет числа электронов
|
n |
ℓ |
Обозначение |
Ze = 2(2ℓ + 1) |
Ze = 2n2 |
Структура |
|||
|
подуровня |
уровня |
|||||||
|
1 |
0 |
(s) |
2(2·0 + 1) = |
2 |
2·12 |
= 2 |
s2 |
|
|
2 |
0 |
(s) |
2(2·0 + 1) = |
2 |
2·22 |
= 8 |
s2p6 |
|
|
1 |
(p) |
2(2·1 + 1) = |
6 |
|||||
16
Окончание табл. 2.2
|
n |
ℓ |
Обозначение |
Ze = 2(2ℓ + 1) |
Ze = 2n2 |
Структура |
|||||||
|
подуровня |
уровня |
|||||||||||
|
0 |
(s) |
2(2·0 + 1) = |
2 |
|||||||||
|
3 |
1 |
(p) |
2(2·1 + 1) = |
6 |
2·3 |
3 |
= 18 |
2 |
6 |
d |
10 |
|
|
2 |
(d) |
2(2·2 + 1) = 10 |
s |
p |
||||||||
|
0 |
(s) |
2(2·0 + 1) |
= |
2 |
||||||||
|
4 |
1 |
(p) |
2(2·1 + 1) |
= |
6 |
2·42 = 32 |
s2p6d10f14 |
|||||
|
2 |
(d) |
2(2·2 + 1) |
= 10 |
|||||||||
|
3 |
(f) |
2(2·3 + 1) |
= 14 |
|||||||||
2.2. Сколько всего орбиталей соответствует третьему энергетическому уровню? Сколько электронов на этом уровне? На сколько подуровней расщепляется этот уровень?
Р е ш е н и е: Для третьего энергетического уровня n = 3, количество атомных орбиталей 9 (32); это количество орбиталей является суммой 1(s) + 3(p) + 5(d) = 9. По принципу Паули количество электронов на этом уровне 18. Третий энергетический уровень расщепляется на три подуровня: s, p, d (количество подуровней совпадает с числом значений главного квантового числа).
Все химические элементы можно классифицировать в зависимости от характера заполняемых подуровней на 4 типа:
s- элементы – заполняют электронами ns – подуровень; p- элементы – заполняют электронами np – подуровень; d- элементы – заполняют электронами (n-1)d – подуровень; f- элементы – заполняют электронами (n-2)f – подуровень.
Для написания электронной формулы элемента необходимо: арабской цифрой указать номер энергетического уровня, написать буквенное значение подуровня, количество электронов записать в виде показателя степени.
Например: 26 FeIV 1s22s22p63s23p64s23d6.
Электронная формула составлена с учетом конкуренции подуровней, т.е. правила минимума энергии. Без учета последнего электронная
формула будет записываться: 26 Fe1V 1s22s22p63s23p63d64s2. Максимальная валентность элемента определяется количеством валентных орбиталей и зависит от электронного типа элемента и номера периода.
Электронная структура элементов по периодам и максимальная валентность представлены в табл. 2.3.
17
Таблица 2.3 Электронная структура и максимальная валентность элементов
|
Пери- |
Валентные |
Валент- |
Элект- |
|||||||||||||
|
Структура |
ронный |
|||||||||||||||
|
од |
орбитали |
ность |
тип |
|||||||||||||
|
I |
1s1-2 |
1 |
s |
|||||||||||||
|
1s |
||||||||||||||||
|
П |
1s22s1-22p1-6 |
2p |
4 |
s, p |
||||||||||||
|
2s |
||||||||||||||||
|
1s22s22p63s1-2 |
3d ) |
|||||||||||||||
|
Ш |
3р |
6 |
s, p |
|||||||||||||
|
3p1-6 |
||||||||||||||||
|
3s |
||||||||||||||||
|
4d ) |
||||||||||||||||
|
1s22s22p63s23p6 |
4p |
6 |
s, p |
|||||||||||||
|
4s |
||||||||||||||||
|
IV |
4s1-23d1-104p1-6 |
|||||||||||||||
|
4p |
9 |
d |
||||||||||||||
|
3d |
||||||||||||||||
|
4s |
||||||||||||||||
|
5d ) |
8 |
s, p |
||||||||||||||
|
1s22s22p63s23p6 |
5p |
|||||||||||||||
|
5s |
||||||||||||||||
|
V |
4s23d104p65s1-2 |
|||||||||||||||
|
4d1-105p1-6 |
5p |
9 |
d |
|||||||||||||
|
4d |
||||||||||||||||
|
5s |
||||||||||||||||
|
6f ) |
||||||||||||||||
|
1s22s22p63s23p6 |
6d ) |
8 |
s, p |
|||||||||||||
|
4s23d104p65s2 |
6p |
|||||||||||||||
|
VI |
4d105p66s1-10 |
|||||||||||||||
|
6s |
||||||||||||||||
|
5d14f1-145d2-10 |
||||||||||||||||
|
6p1-6 |
6p |
9 |
d |
|||||||||||||
|
5d |
||||||||||||||||
|
6s |
||||||||||||||||
|
18 |
2.3.Какой подуровень заполняется в атоме электронами после заполнения подуровня: а) 4р; б) 4s?
Ре ш е н и е: а) Подуровню 4р отвечает сумма (n + l), равная 4+1 = 5. Такой же суммой n+l характеризуются подуровни 3d (3+2 = 5)
и5s (5+0 = 5). Однако состоянию 3d отвечает меньшее значение n (n = 3), чем состоянию 4р, поэтому подуровень 3d будет заполняться раньше, чем подуровень 4р. Следовательно, после заполнения подуровня 4р будет заполняться подуровень 5s, которому отвечает на единицу большее значение n (n=5).
б) подуровню 4s соответствует сумма n+l = 4+0 = 4. Такой же суммой n+l характеризуется подуровень 3р, но заполнение этого подуровня предшествует заполнению подуровня 4s, т.к. последнему отвечает большее значение главного квантового числа. Следовательно, после подуровня 4s будет заполняться подуровень с суммой (n+l) = 5, причем, из всех возможных комбинаций n+ℓ , соответствующих этой сумме (n=3, ℓ=2; n=4, ℓ=1; n=5, ℓ=0), первой будет реализовываться комбинация с наименьшим значением главного квантового числа, т.е. вслед за подуровнем 4s будет заполняться подуровень 3d.
Вывод: Таким образом, заполнение подуровня d отстает на один квантовый уровень, заполнение подуровня f отстает на два квантовых уровня.
2.4.Электронная структура атома описывается формулой 1s22s22p63s23d74s2. Какой это элемент?
Ре ш е н и е: Этот элемент принадлежит к электронному типу
d-элементов 1У периода, т.к. происходит застройка электронами 3d подуровня; число электронов 3d7 свидетельствует о том, что это седьмой элемент по порядку. Общее число электронов 27, значит порядковый номер 27. Этот элемент – кобальт.
2.5.На каком основании фосфор и ванадий располагают в одной группе периодической системы? Почему их помещают в разных подгруппах?
Ре ш е н и е: Электронные конфигурации атомов Р 1s22s22p33s23p3; V 1s22s22p63s23p64s23d3. В них подчеркнуты валентные электроны.
Валентных электронов у этих элементов одинаковое количество – 5. Поэтому Р и V расположены в одной 5 группе. В то же время эти элементы не являются электронными аналогами, т.к. застраивают разные подуровни, значит не должны размещаться в одной подгруппе.
Химическая связь – это результат квантово-механического взаимодействия электронов.
19
По характеру распределения электронной плотности между атомами химические связи подразделяются на ковалентные неполярные, полярные и ионные (металлическая связь, реализуемая в металлах, здесь не рассматривается). Если смещение пары электронов отсутствует, то связь приближается к ковалентной неполярной. Ковалентная полярная связь осуществляется общей парой электронов, смещенной (поляризованной) к ядру одного из атомов-партнеров. Ионная связь рассматривается как предельно поляризованная ковалентная связь. Для оценки способности атома данного элемента оттягивать к себе общую электронную пару пользуются значением относительной электроотрицательности (χ) (табл. 5). Чем больше разность электроотрицательностей (Δχ), тем больше поляризация связи (тем выше ионность связи). Считают, что, если Δχ > 1,9 , то связь ионная.
2.6. Вычислите разность относительных электроотрицательностей атомов для связей Н-О и Э-О в соединениях Э(ОН)2, где Э – элементы Са, Sr, Ba, и определите:
а) какая связь Н-О или Э-О характеризуется в каждой молекуле большей степенью ионности; б) каков характер ионизации этих молекул в водном растворе?
Р е ш е н и е: а) Вычислим Δχ для связи Э-О и Н-О:
Δχ Са-О = 3,5 — 1,04 = 2,46 ΔχSr-O = 3,5 — 0,99 = 2,51 Δχ Ba-O = 3,5 — 0,90 = 2,60 Δχ H-O = 3,5 — 2,1 = 1,4
Из сравнения Δχ видим, что связь Э-О можно считать ионной, связь Н-О – полярной.
б) ионизация в водных растворах будет осуществляться по наиболее ионной связи, т.е. по схеме: Э(ОН)2 ↔ Э2+ + 2ОН— (по типу
оснований).
Прочность химической связи характеризуется энергией (кДж/моль) и
о
длиной (нм илиА) связи. Чем выше энергия связи и меньше ее длина, тем связь прочнее.
Химическая связь, т.е. общая электронная пара, может образоваться двумя способами: по обменному и донорно-акцепторному механизму. Химическая связь характеризуется тремя основными свойствами:
1)имеет определенное направление в пространстве. С этой точки зрения различают σ и π-связи. Угол, образованный направлениями двух σ-связей, называется валентным. Если π-связь объединяет несколько атомов, она называется нелокализованной;
2)стремится к насыщаемости, вследствие чего частицы имеют определенный состав и структуру. Возможны: координационно-
20

ненасыщенное, координационно-насыщенное, валентно-насыщен- ное и валентно-ненасыщенное состояние атомов;
3)может поляризоваться под действием различных факторов (в зависимости от электроотрицательности атомов, а также под действием внешнего электрического или магнитного поля, при действии других полярных молекул).
Для объяснения геометрической структуру молекул используют представление о гибридизации атомных орбиталей центрального атома. Согласно этому представлению, образованию σ-связей предшествует изменение формы и энергии атомных орбиталей. Образуются гибридные орбитали, способные к более глубокому перекрыванию и, следовательно, к образованию более прочных связей. У элементов s и р электронного типа в гибридизации могут принимать участие орбитали, включающие неподеленные электронные пары.
2.7. Покажите образование связи в молекуле BF3 и ионе BF4—. Объясните строение указанных частиц.
Р е ш е н и е: 1. Составим электронные формулы атомов и ио-
нов: B 1s22s22p1; F 1s22s22p5; F— 1s22s22p6.
2. Покажем распределение электронов по валентным орбиталям. При этом учтем степень окисления атома бора в соединении (условно можно считать, что число неспаренных электронов в атоме соответствует степени окисления).
3. Покажем образование всех возможных связей, укажем механизм их образования:
Образовалось 3 σ-связи по обменному механизму Исходя из валентных возможностей атома
бора и его стремления к насыщаемости, покажем образование π-связи по донорноакцепторному механизму. Но, т.к. эта связь объединяет более двух ато-
мов, она будет нелокализованной.
В ионе BF4— образуется 4 σ-связи, из них три по обменному и одна – по донорно-акцепторному механизму.
21
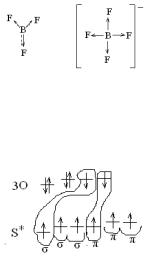
4.Рассчитаем кратность связи как отношение общего числа связей к числу σ-связей. В молекуле BF3 кратность связи 1⅓, в ионе BF4— — кратность связи 1.
5.Определим состояние центрального атома с точки зрения насыщае-
мости. В молекуле BF3 проявлена максимальная валентность за счет σ и π-связей, следовательно, состояние атома бора валентно-насыщенное.
Вионе BF4— проявлена максимальная валентность за счет σ-связей, следовательно, состояние атома бора координационно-насыщенное.
6.Определим характер связи В-F с точки зрения полярности. Т.к. различие в величине электроотрицательности (Δχ) составляет 4,0-2,0 = 2,0, т.е. больше 1,9 связь можно считать ионной.
7.Определим тип гибридизации атомных орбиталей центрального атома и геометрическую форму частиц.
Вмолекуле BF3 в образовании σ-связей участвуют s и 2р-орбитали, следовательно, тип гибридизации sp2. Молекула имеет треугольную
структуру. В ионе BF4— в образовании σ-связей участвуют одна s и три р-орбитали, следовательно, тип гибридизации sp3. Ион имеет тетраэдрическую форму.
8.Изобразим графически строение частиц
2.8. Покажите образование связей в молекуле SO3, объясните строение молекулы.
Р е ш е н и е: Электронные формулы элементов
S 1s22s22p63s23p4 O 1s22s22p4.
Т.к. степень окисления атома серы +6, покажем распределение электронов по валентным орбиталям у возбужденного атома серы.
Атом серы образует по обменному механизму 3 σ-связи (за счет одной s и двух р-атомных орбиталей) и 3 π-связи (за счет одной р- и двух d-атомных орбиталей).
Следовательно, атом валентно-насыщен, координационно-ненасыщен; кратность связи 6/3 = 2. Связь S-O полярная, общие электронные пары смещены к кислороду (Δχ = 0,5). Тип гибридизации sp2. Молекула имеет строение треугольника.
22

3. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Комплексные соединения играют важную роль в жизнедеятельности живых организмов. Ионы Na, K, Ca, Mg, выполняющие в организме важные физиологические функции, находятся в крови, лимфе, тканевых жидкостях в виде комплексных соединений. Ионы Fe, Zn, Mn, Cu образуют комплексные соединения с белками и входят в состав ферментов, витаминов. Железо входит в состав гемоглобина. Гемоглобин представляет соединение между белком-глобином и комплексомгемом. В геме центральным ионом является Fe2+.
Комплексными соединениями называют молекулярные соединения, сочетание компонентов которых приводит к образованию сложных ионов, способных к свободному существованию как в кристалле, так и в растворе. В молекулах комплексных соединений различают внутреннюю и внешнюю сферы. Внутренняя сфера заключается в квадратные скобки и состоит из центрального атома или иона, называемого комплексообразователем, и скоординированных вокруг него атомов, ионов или молекул, называемых лигандами.
Количество лигандов, скоординированных вокруг комплексообразователя, определяют его координационное число (к.ч.). Последнее показывает количество σ-связей, возникающих между к.о. и лигандами.
|
Связь между к.ч. |
к.о. и его степенью окисления |
||
|
Степень окисления |
К.ч. к.о. |
Примеры |
|
|
+1 |
2 |
[Ag(NH3)2]Cl |
|
|
+2 |
4 |
[Cu(H2O)4]Cl2 |
|
|
+3 |
6 |
K3[Fe(CN)6] |
|
|
+4 |
6 |
H2[PtCl6] |
Молекула к.с. электронейтральна. Заряд внутренней сферы равен заряду внешней с обратным знаком. Заряд комплексного иона равен алгебраической сумме зарядов к.о. и лигандов.
23
Классификация комплексных соединений
1.По характеру заряда комплексного иона
—катионные: образуются за счет координации вокруг положительно заряженного к.о. нейтральных молекул лигандов
[Zn(NH3)4]Cl2 ; [Al(H2O)6]Cl3;
—анионные: комплексообразователь – положительные ионы, ли-
ганды – анионы K2[BeF4]; Na2[SiF6];
—нейтральные: образуются при координации вокруг нейтрального к.о. нейтральных лигандов [Fe(CO)5]o или при одновременной координации вокруг положительно заряженного к.о.
отрицательно заряженных и нейтральных лигандов
[Co(NH3)3Cl3]o.
2.По природе лигандов
— гидраты или аквакомплексы [Cr(H2O)6]Cl3;
—аммиакаты [Cu(NH3)4]SO4;
—ацидокомплексы K2[HgI4];
—гидроксокомплексы Na[Al(OH)4].
3.По количеству к.о.
—моноядерные [Pt(NH3)4]Cl2;
—полиядерные [(NH3)4 Co/OHOH / Co(NH3)4 ]Cl4 .
Правила составления названий комплексных соединений
1)название к.с. начинают с катиона;
2)в названии комплексного иона сначала указывают лиганды, затем центральный атом. К названиям анионных лигандов добавляют окончание «о», молекулярные лиганды называют как
соответствующие свободные молекулы. Исключение: NH3 – аммин; Н2О – аква; СО – карбонил;
3)комплексообразователь в катионных и нейтральных к.с. называют русским названием элемента, в анионных – латинским названием с добавлением окончания «ат»;
4)степень окисления к.о. обозначают арабской цифрой и ставят в
скобках после его названия. K3[Co(NO2)6] – калий гексанитритокобальтат (+3); [Cr(H2O)6]Cl3 – гексааквахрома (+3) хлорид; [Fe(CJ)5]o – пентакарбонил железа (0).
Поведение комплексных соединений в растворе
В растворах к.с. ведет себя как сильный электролит и диссоциирует нацело на комплексный ион и ионы внешней сферы:
[Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl—
Комплексные ионы ионизируют обратимо и ступенчато: [Ag(NH3)2]+ ↔ [Ag(NH3)2]+ + NH3
24
[Ag(NH3)2]+ ↔ Ag+ + NH3 или суммарно: [Ag(NH3)2]+ ↔ Ag+ + 2NH3
Константа равновесия ионизации комплексного иона называется константой нестойкости
|
Кнест. = |
[Ag+ ][NH3]2 |
|
[[Ag(NH3)2 ]+ ] |
Она зависит только от природы соединения и температуры; приводится в справочниках (см. табл. 6).
25

4. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Химическим равновесием называют состояние, которому соответствует равенство скоростей прямой и обратной реакций:
V = V
При этом изменение энергии Гиббса равно нулю
Go = O; ΔΗο = T So
Состояние химического равновесия остается неизменным при постоянстве внешних условий. При изменении этих условий (температуры, давления, концентраций) равновесие нарушается с тем, чтобы восстановиться вновь, но уже при новых условиях.
Смещение равновесия подчиняется принципу Ле-Шателье: если в равновесной системе изменить одно из условий, определяющих положение равновесия, то равновесие смещается в направлении того процесса, который ослабляет эффект воздействия. Так, с увеличением концентрации реагентов равновесие смещается в сторону процесса, который вызовет расход этих реагентов. Причина такого поведения равновесной системы заключается в росте числа столкновений частиц указанных реагентов, что вызывает ускорение прямой или обратной реакции.
В газовых системах увеличение концентраций реагентов происходит при возрастании давления или уменьшении объема системы. Поэтому с увеличением общего давления в системе быстрей пойдет та из двух обратимых реакций, которая происходит с участием большего числа молей газа, т.е. равновесие смещается в сторону образования меньшего числа молей.
При повышении температуры растет скорость и прямой, и обратной реакции, но в большей степени возрастает скорость эндотермической
реакции, т.к. она характеризуется более высоким температурным коэффициентом.
Задачи и упражнения
4.1. Покажите направление смещения равновесия при уменьшении концентрации Н2 в равновесной системе:
СО + Н2О↔ СО2 + Н2 Р е ш е н и е: С уменьшением СН2 , согласно принципу Ле-
Шателье, должна преобладать прямая реакция, т.к. при этом будет расти количество Н2, и равновесие снова восстановится.
4.2. В каком направлении сместится равновесие РС15 ↔ РС13 + С12— 31 кДж·моль-1 при повышении температуры и давления?
Р е ш е н и е: С ростом температуры равновесие сместится вправо, т.к. прямая реакция идет с поглощением тепла, т.е. является
26

эндотермической. При увеличении давления число столкновений молекул РС13 и С12 будет больше, чем РС15, поэтому равновесие будет смещаться влево.
4.3. При каких условиях в равновесной системе
N2 г + 3Н2 г ↔ 2NH3 г + 22 кДж·моль-1 можно максимально увеличить выход NH3?
Р е ш е н и е: Чтобы увеличить выход NH3, т.е. сместить равновесие вправо, необходимо:
1)повысить давление смеси газов, т.к. в этом случае возрастает скорость прямой реакции, ибо в ней участвует большее число молей;
2)увеличить концентрацию N2 и Н2 и уменьшить концентрацию NH3, выводя его из сферы реакции;
3)понизить температуру реакционной смеси, т.к. реакция об-
разования NH3 является экзотермической.
Количественной характеристикой состояния химического равновесия служит константа равновесия, которая отражает закон действующих масс.
Константа равновесия связана с энергией Гиббса соотношением RTlnK
=-∆Gо. Для процесса аА + bВ ↔ сС + dD концентрационная константа
равновесия имеет вид: Кс = [C]c[D]d , где [A], [B], [C], [D] – равновес- [A]a[B]b
ные концентрации в моль/л; а, b, c, d – стехиометрические коэффициенты.
|
P |
c P |
d |
|||||
|
Для газовых систем записывают константу K |
p |
= |
C |
D |
, где Р – |
||
|
P |
a P |
b |
|||||
|
A |
B |
парциальные давления газов и смеси.
Константы Кс и Кр характеризуют равновесные процессы в разбавленных растворах электролитов и неэлектролитов и в газовых системах при давлениях, близких к 101,3 кРа (идеальные газы).
Для концентрированных растворов и неидеальных газов следует пользоваться величинами активностей:
Ka = aCc aDd aAa aBb
Константа равновесия зависит от природы реагентов и температуры, но не зависит от концентраций компонентов равновесной системы.
В гетерогенных системах концентрация твердой фазы входит в величину константы равновесия, т.к. является величиной постоянной.
27
Если реакции протекают в водных растворах с участием воды, то концентрация воды велика и постоянна и практически не будет влиять на состояние равновесия.
Запишем константы равновесия процессов: 4НС1г + О2 г ↔ 2Н2Ог + 2С12 г
|
K |
= |
[H |
2 |
O]2 |
[Cl |
2 |
]2 |
; |
K |
= |
PН2 |
О |
PС21 |
||
|
c |
P |
2 |
2 |
||||||||||||
|
[HCl]4 [O |
2 |
] |
P4 |
P |
|||||||||||
|
НС1 |
O2 |
C6H12O6 p-p ↔ 2C2H5OHp-p + 2CO2 г
|
Kc = |
[C2H5OH]2 [CO2 ]2 |
||||
|
[C6H12O6 ] |
|||||
|
CuSO4 p-p + Fekp ↔ Cukp + FeSO4 p-p |
|||||
|
KC |
= |
[FeSO4 ] |
|||
|
[CuSO4 ] |
|||||
При решении задач следует четко определить агрегатное состояние реагирующих веществ, а также отличать исходные концентрации веществ от равновесных.
Сравновесная = Сисходная — Сизрасходованная
4.4. В сосуде емкостью 1 л при 410оС смешали 1 моль Н2 и 1 моль I2. Вычислите, при каких концентрациях устанавливается химическое равновесие, если константа равновесия равна 48?
Р е ш е н и е: H2 + I2 ↔ 2HI
Примем, что в реакции израсходовано по Х молей Н2 и I2. Тогда образовалось 2Х молей HI, т.е. HI = 2 моль/л. В этом случае [H2] = [I2] =
|
= 1 — X. Запишем: Кс = |
[HI]2 |
= |
(2x)2 |
= 48 |
|
|
[H2 ][I2 ] |
(1−x)2 |
||||
Получим уравнение: 44Х2 – 96Х + 48 = 0 Решая его, получим Х = 0,776. Рассчитаем равновесные концентрации: HI = 2X = 2·0,776 = 1,552 моль/л
[H2] = [I2] = 1 — X = 0,222 моль/л.
4.5. В обратимой реакции СО + С12 ↔ СОС12 установились следующие равновесные концентрации (моль/л): [CO] = 0,1; [Cl2] = 0,4; [COCl2] = 4. Вычислите Кравн. и исходные концентрации С12 и СО.
|
Р е ш е н и е: K = |
[COCl2 ] |
= |
4 |
=100 |
|
|
[CO][Cl2 ] |
0,10,4 |
||||
28

Находим исходные концентрации: Сисх. = Сравн. + Сизрасх.. Для образования 4 моль СОС12, согласно уравнению реакции, израсходовано по 4
моль СО и С12. Отсюда исходные концентрации равны: ССО = 0,1 + 4 = = 4,1 моль/л; СС12 = 0,4 + 4 = 4,4 моль/л.
4.6. Определите объемный состав смеси в момент равновесия для реакции Сграфит + О2 г ↔ СО2 г, если при 1300оС Кравн. = 0,289.
Ре ш е н и е: Кр = РРСО2
О2
Обозначим через Х содержание СО2 в объемных долях (процентах). Тогда содержание О2 составит (100-Х). Подставим в уравнение:
К = 0,289 = (100Х−Х) ; Х = 22,42 об.%. Содержание О2 составит
77,58 %.
29

5. ХИМИЧЕСКАЯ КИНЕТИКА
Химическая кинетика изучает скорость и механизм протекания химических реакций, а также влияние различных факторов на скорость. Среднюю скорость химической реакции измеряют изменением концентрации реагирующих веществ в единицу времени:
V = ± C2 −C1 ,
τ2 −τ1
где С2 и С1 – концентрации веществ (моль/л), соответствующие времени τ2 и τ1 ( в с или мин). Для гетерогенных систем скорость измеряют
изменением концентрации на единицу поверхности твердой фазы (1 см2 или 1 м2).
Скорость химической реакции зависит от следующих основных факторов:
—природы и состояния реагирующих веществ;
—характера среды, в которой протекает реакция;
—катализатора;
—концентрации реагирующих веществ, а для газов и давления;
—температуры.
Химическая активность веществ зависит от строения атомов или молекул, характера внутримолекулярных и межмолекулярных связей. Наибольшей активностью обладают радикалы, несколько она ниже у ионов и молекул. Немаловажное значение имеют также и агрегатное состояние реагентов, степень дисперсности.
Практически всегда вещества реагируют со средой (растворителем), образуя сольваты (гидраты). Кроме того, растворитель может оказывать каталитическое действие.
Катализаторы, как правило, ускоряют химические реакции за счет изменения их пути. При этом новому пути реакции соответствует более низкая энергия активации. Энергией активации (Еа) называют минимальную энергию, которой должны обладать частицы реагирующих веществ для осуществления взаимодействия. Величина Еа определяется химической природой веществ.
Влияние концентрации, давления и температуры на скорость химической реакции поддается количественной оценке.
Закон действующих масс выражает зависимость скорости химической реакции от концентрации реагирующих веществ: скорость реакции прямо пропорциональна концентрациям реагирующих веществ, возведенным в степени их стехиометрических коэффициентов. Для реакции
аА + вВ → С V = KCAaCBb ,
30

где СА и СВ – молярные концентрации реагентов А и В;
аи b – стехиометрические коэффициенты при А и В;
К– константа скорости данной реакции, отражающая влияние природы веществ. Она зависит от температуры, но не зависит от концентрации веществ.
Для газовых систем вместо концентраций можно пользоваться величи-
нами парциальных давлений: V = KPAaPBb .
В гетерогенных системах концентрации кристаллических веществ являются величинами постоянными и входят в константу скорости. Причину роста скорости реакции при увеличении концентраций реагирующих веществ можно объяснить увеличением общего числа столкновений частиц, а значит и увеличением числа активных столкновений. Запишем выражения для скорости следующих реакций:
а) 2Н2 г + О2 г = 2Н2Ог
|
V = KC |
2C |
O2 |
или |
V = KP |
2P |
|
|
H2 |
H2 |
O2 |
||||
|
б) СаОкр + СО2 г = СаСО3 кр |
||||||
|
V = KCCO2 |
или |
V = KPCO2 |
||||
|
в) FeCl3 р-р + 3KSCN p-p = Fe(SCN)3 p-p |
V = KCFeCl3 C3KSCN |
|||||
|
г) 2AgCO3 кр |
to |
V = K |
||||
|
→2Ag кр + 2CO2 г + O2 г |
Закон действующих масс справедлив только для простых реакций с небольшим порядком и молекулярностью.
Под порядком реакции понимают сумму показателей степеней при концентрациях в выражении закона действующих масс. Молекулярность реакции определяется минимальным числом молекул, участвующих в акте взаимодействия. По признаку молекулярности реакции делят на одномолекулярные (мономолекулярные), двухмолекулярные (бимолекулярные) и трехмолекулярные (тримолекулярные). Реакции более высокой молекулярности встречаются редко, т.к. такие реакции идут в несколько стадий.
К одномолекулярным реакциям относят реакции разложения и внутримолекулярных перегруппировок, для них V = K·C. К двухмолекулярным реакциям относят реакции, в которых взаимодействие происходит при столкновении двух молекул, для них V = K·C1·C2; для трехмолекулярных реакций V = K·C1·C2·C3 . По признаку порядка реакции бывают первого, второго и третьего порядка, а также нулевого и дробного.
|
Для реакции: |
|
|
первого порядка |
V = K·C; |
|
второго порядка |
V = K·C2, V = K·C1·C2; |
31
третьего порядка V = K·C3, V = K·C12·C2 , V = K·C1·C22.
Реакции имеют нулевой порядок, если во все время процесса концентрация вещества не изменяется и скорость – постоянная величина. Это возможно в гетерогенных системах, где кристаллическое вещество взаимодействует с поверхности, и концентрация остается постоянной величиной. Для реакции нулевого порядка V = K·Co. Реакция имеет дробный порядок, если процесс происходит в несколько стадий, каждая из которых имеет незначительную скорость.
Задачи и упражнения
5.1. Определите молекулярность и порядок реакции:
С12 г + 2NO г = 2NOCl г
Р е ш е н и е: В реакцию вступают 1 моль С12 и 2 моля NO, следовательно, указанная реакция — тримолекулярная. Порядок опреде-
ляем по уравнению: V = KCCl2 C2NO . Реакция – третьего порядка.
5.2. Рассчитайте скорость растворения гидроксида железа (II) в 0,02 М H2SO4 при К = 40. Определите молекулярность и порядок реакции.
Р е ш е н и е: Реакция пойдет согласно уравнению:
Fe(OH)2 кр + H2SO4 p-p = FeSO4 p-p + 2H2O ж
V = KCH2SO4 , т.к. Fe(OH)2 находится в кристаллической фазе. Молекулярность реакции равна 2, порядок 1. Рассчитаем скорость реакции:
V= 40·0,02 = 0,8 моль/мин·л.
5.3.В растворе, содержащем 1 моль SnCl2 и 2 моля FeCl3, протекает реакция по уравнению:
SnCl2 p + 2FeCl3 p ↔ SnCl4 p + 2FeCl2 p
Во сколько раз уменьшится скорость реакции после того, как прореаги-
рует 0,65 моль SnCl2?
Р е ш е н и е: Рассчитаем скорость реакции в начальный
|
момент: |
|
|
Vo = К CSnCl2 CFeCl2 |
3 = K·1·22 = 4K |
После того, как прореагировало 0,65 моль SnCl2, концентрации будут
иметь следующие значения: СSnCl2 = 1 — 0,65 = 0,35 моль/л; СFeCl3 = = 2 — 1,3 = 0,7 моль/л. При этом скорость реакции будет равна:
V1 = K·0,35·0,72 = 0,17 K.
|
Отношение скоростей |
Vo |
= |
4K |
= 23 раза. |
|
|
V |
0,17K |
||||
|
1 |
5.4. Как изменится скорость реакции СО г + С12 г = СОС12 г, если объем газовой смеси уменьшить вдвое?
32
Р е ш е н и е: Начальная скорость реакции будет равна:
Vo = K·CCO· СС12 . С уменьшением объема в два раза концентрации всех
компонентов увеличатся вдвое и скорость можно рассчитать так: V1 = K 2CCO 2CCl2 = 4KCCO CCl2
Совершенно очевидно, что с уменьшением объема в 2 раза скорость реакции возрастает в 4 раза.
Влияние температуры на скорость химической реакции также оценивают количественно. С ростом температуры скорость любых реакций увеличивается, что объясняется увеличением числа активных частиц, энергия которых достигает или превышает энергию активации Еа. Зависимость константы скорости реакции от температуры выражается
|
уравнением Аррениуса: 2 ,303 lg |
K 1 |
= |
E a |
( |
1 |
− |
1 |
) . |
|
K 2 |
R |
|||||||
|
T1 |
T 2 |
|||||||
|
Здесь К1 и К2 |
– константы скорости данной реакции для абсолютных |
|||||||
|
температур Т1 и Т2; |
||||||||
|
Еа |
– энергия активации; |
|||||||
|
R |
– газовая постоянная. |
На практике для расчетов пользуются правилом Вант-Гоффа, согласно которому при повышении температуры на 10о скорость или константа скорости реакции возрастает в 2-4 раза.
|
Vt2 |
Kt2 |
t 2 −t1 |
||||||
|
= |
= γ 10 , |
|||||||
|
V |
K |
t1 |
||||||
|
t1 |
||||||||
|
где Vt1 и Vt2 |
– скорости реакции при температурах t1 и t2; |
|||||||
|
Kt1, Kt2 |
– константы скорости; |
γ– температурный коэффициент.
Правило Вант-Гоффа дает менее точные результаты, чем уравнение Аррениуса, т.к. γ можно считать постоянным только в небольшом температурном интервале. Для неорганических реакций γ = 2-4, для ферментативных γ = 7-8.
5.5. Температурный коэффициент скорости разложения HI в области температур 356-376оС равен 2. Вычислите константу скорости этой реакции при 376оС, если при 356оС она равна 8,09·10-5.
|
Р е ш е н и е: |
Запишем математическое выражение правила |
||||||
|
Вант-Гоффа: |
|||||||
|
V376 |
K376 |
376−356 |
|||||
|
= |
= γ 10 |
||||||
|
V |
K |
356 |
|||||
|
356 |
Откуда К376 = γ20/10·К356 = 22·8,09·10-5 = 3,24·10-4.
33

5.6. Во сколько раз уменьшится скорость химической реакции при уменьшении температуры на 40оС, если температурный коэффициент равен 4?
40
Р е ш е н и е: Vt+40 = γ10 = 44 = 256 Vto
Таким образом, с ростом температуры на 40оС скорость реакции возрастает в 256 раз, а при снижении температуры уменьшается в то же число раз.
5.7. Ядохимикат разлагается в воде при 25оС в течение 10 суток. При какой температуре нужно выдержать отравленную воду, чтобы она через 1 час стала безвредной, если температурный коэффициент реакции разложения химиката равен 3?
Р е ш е н и е: Будем считать условную скорость величиной,
|
обратной времени разложения: |
V |
= |
1 |
и |
V |
= |
1 |
. |
|||||||||||||
|
t1 |
τ |
t2 |
τ |
2 |
|||||||||||||||||
|
1 |
|||||||||||||||||||||
|
Считая температуру t2 |
неизвестной, можно записать: |
||||||||||||||||||||
|
Vt |
τ |
t2 −t1 |
|||||||||||||||||||
|
2 |
|||||||||||||||||||||
|
= |
1 |
= γ |
10 |
||||||||||||||||||
|
V |
τ |
2 |
|||||||||||||||||||
|
t1 |
|||||||||||||||||||||
|
Подставим все известные величины: |
|||||||||||||||||||||
|
240 |
t2 −25 |
= 35 ; |
t2 −25 |
t2 = 75oC . |
|||||||||||||||||
|
= 3 10 |
= 5 ; |
||||||||||||||||||||
|
1 |
|||||||||||||||||||||
|
10 |
34
Соседние файлы в предмете Химия
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Орбитали и то, сколько электронов имеет каждый из них, являются центральными для процесса химической связи, и с точки зрения физики орбитали тесно связаны с энергетическими уровнями электронов в рассматриваемом атоме. Если вас попросили найти орбитали для определенного энергетического уровня, понимание того, как эти два связаны, углубит ваше понимание темы и даст вам ответ, который вы ищете.
TL; DR (слишком долго; не читал)
Главное квантовое число n определяет уровень энергии электрона в атоме. Есть n 2 орбиталей для каждого уровня энергии. Таким образом, для n = 3 существует девять орбиталей, а для n = 4 — 16 орбиталей.
Понимание квантовых чисел
При обсуждении электронных конфигураций широко используются «квантовые числа». Это числа, которые определяют конкретное состояние, в котором находится электрон для его «орбиты» вокруг ядра атома. Основное квантовое число, которое вам понадобится для определения количества орбиталей для каждого энергетического уровня, является основным квантовым числом, которому присвоен символ n . Это говорит вам об уровне энергии электрона, а большее главное квантовое число означает, что электрон находится дальше от ядра.
Два других квантовых числа, которые объясняют орбитали и подуровни, являются квантовым числом углового момента ( l ) и магнитным квантовым числом ( m l ). Как и обычный угловой момент, квантовое число углового импульса говорит вам, как быстро электрон движется по орбите, и определяет форму орбитали. Магнитное квантовое число указывает одну орбиту из доступных.
Главное квантовое число n принимает целые числа (целые числа), такие как 1, 2, 3, 4 и так далее. Квантовое число углового момента l принимает значения целых чисел, начиная с 0 и до n — 1, поэтому для n = 3 l может принимать значения 0, 1 или 2 (если n = 3, то n — 1 = 2). Наконец, магнитное квантовое число m l принимает значения целых чисел от — l до + l , поэтому для l = 2 оно может быть равно -2, -1, 0, +1 или +2.
подсказки
-
В химии, в частности, каждому из цифр присваивается буква. Таким образом, s используется для l = 0, p используется для l = 1, d используется для l = 2 и f используется для l = 3. Начиная с этого момента, буквы увеличиваются в алфавитном порядке. Таким образом, электрон в оболочке 2_p_ имеет n = 2 и l = 1. Это обозначение часто используется для указания конфигураций электронов. Например, 2_p_ 2 будет означать, что этот подоболочек занимает два электрона.
Сколько орбиталей на каждом энергетическом уровне? Простой метод
Самый простой способ определить количество орбиталей на каждом энергетическом уровне — использовать приведенную выше информацию и просто подсчитать орбитали и подуровни. Уровень энергии определяется n , поэтому вам нужно учитывать только одно фиксированное значение для n . Используя в качестве примера n = 3, мы знаем из вышесказанного, что l может быть любым числом от 0 до n — 1. Это означает, что l может быть 0, 1 или 2. И для каждого значения l , m l может быть любым из — от л до + л . Каждая комбинация l и m l является определенной орбитой, поэтому вы можете решить ее, пройдя через опции и посчитав их.
Для n = 3 вы можете по очереди работать со значениями l . Для l = 0 существует только одна возможность, m l = 0. Для l = 1 существует три значения ( m l = −1, 0 или +1). Для l = 2 существует пять возможных значений ( m l = -2, -1, 0, +1 или +2). Таким образом, добавление возможностей дает 1 + 3 + 5 = 9 орбиталей.
Для n = 4 вы можете пройти тот же процесс, но в этом случае l увеличивается до 3 вместо двух. Таким образом, у вас будет девять орбиталей ранее, и для l = 3, m l = −3, -2, -1, 0, +1, +2 или +3. Это дает семь дополнительных орбиталей, поэтому для n = 4 есть 9 + 7 = 16 орбиталей. Это немного трудоемкий способ определения количества орбиталей, но он надежный и простой.
Сколько орбиталей на каждом энергетическом уровне? Более быстрый метод
Если вам удобно брать квадрат числа, есть гораздо более быстрый способ найти орбитали для уровня энергии. Вы, возможно, заметили выше, что примеры следуют формуле число орбиталей = n 2. Для n = 3 их было девять, а для n = 4 — 16. Это оказывается общим правилом, поэтому для n = 2 имеется 2 2 = 4 орбитали, а для n = 5 — 5 2 = 25 орбиталей. Вы можете проверить эти ответы простым методом, если хотите, но в любом случае это сработает.
Сколько электронов на каждом энергетическом уровне?
Существует также простой способ выяснить, сколько электронов на каждом уровне энергии. Каждая орбиталь содержит два электрона, потому что у них также есть одно дополнительное квантовое число: m s , квантовое число спина. Это может принимать только два значения для электронов: -1/2 или +1/2. Таким образом, для каждой орбиты существует максимум два электрона. Это означает, что: максимальное количество электронов на энергетическом уровне = 2_n_ 2. В этом выражении n является главным квантовым числом. Обратите внимание, что не все доступные точки будут заполнены в каждом случае, поэтому вы должны объединить это с немного большей информацией, такой как число электронов в рассматриваемом атоме, чтобы найти орбитали, которые будут полностью заняты электронами.
Для описания положения электрона в электронной оболочке используют четыре квантовых числа. Здесь мы не будем углубляться в квантово-механические подробности и опишем только утилитарный смысл данных чисел. Набор, состоящий из четырёх квантовых чисел — это «адрес» электрона в электронной оболочке.
Главное квантовое число `n` — определяет полную энергию электрона на энергетическом уровне и показывает, из скольких энергетических уровней состоит электронная оболочка атома. Принимает целочисленные положительные значения от `1` до `oo`. В периодической таблице Д. И. Менделеева `n` равно номеру периода.
Орбитальное квантовое число `l` показывает, сколько энергетических подуровней составляют данный уровень и характеризует форму орбиталей. Принимает значения от `0` до `(n-1)`.
При `n=1`, `l` принимает только одно значение `0` (этому числовому значению соответствует буквенное `s`), следовательно, на первом энергетическом уровне только один подуровень — `s`. Орбиталь `s`-подуровня имеет сферическую форму (рис. 1).
При `n=2`, `l` принимает два значения: `0` `(s)` и `1` `(p)`. Энергетический уровень состоит из двух подуровней — `s` и `p`. Форма `p`-орбитали похожа на объёмную восьмёрку (рис. 1).
При `n=3`, `l` принимает уже три значения: `0` `(s)`; `1` `(p)` и `2` `(d)`. Таким образом, на третьем уровне три подуровня. Орбитали `d`-подуровня имеют форму двух перекрещённых объёмных восьмёрок либо объёмной восьмерки с перемычкой (рис. 1).
При `n=4`, значений `l` уже четыре, следовательно, и подуровней на четвёртом уровне четыре. К перечисленным выше добавляется `3` `(f)`. Орбитали `f`-подуровня имеют более сложную, объёмную, форму.
Магнитное квантовое число `ml` определяет число орбиталей на каждом подуровне и характеризует их взаимное расположение.
Принимает значения `-l` до `+l`, включая `0`.
При `l=0`, `m_l` принимает только одно значение — `0`. Следовательно, орбиталь, находящаяся на данном подуровне (`s`-подуровне), только одна. Мы уже знаем, что она имеет форму сферы с центром в начале координат.
При `l=1`, `m_l` принимает три значения: `−1`; `0`; `+1`. Значит, орбиталей на данном подуровне (`p`-подуровне) три. Так как `p`-орбитали представляют из себя объёмные восьмёрки (то есть линейной структуры), располагаются они в пространстве по осям координат, перпендикулярно друг другу (`p_x`, `p_y`, `p_z`).
При `l=2`, `m_l` принимает уже пять значений: `−2`; `−1`; `0`; `+1`; `+2`. То есть на `d`-подуровне располагаются пять орбиталей. Это плоскостные структуры, в пространстве занимают пять положений.
При `l=3`, то есть на `f`-подуровне, орбиталей становится семь, так как `m_l` — принимает семь значений (от `−3` до `+3` через `0`). Орбитали являются более сложными объёмными структурами, и взаимное их расположение еще более сложно.
Спиновое квантовое число `m_s` характеризует собственный момент количества движения электрона и принимает только два значения: `+1//2` и `-1//2`.
Электронная ёмкость подуровня (максимальное количество электронов на подуровне) может быть рассчитана по формуле `2(2l+1)`, а уровня — по формуле `2n^2`.
Всё вышесказанное можно обобщить в Таблице 2.
Таблица 2. Квантовые числа, атомные орбитали и число электронов на подуровнях (для `n<=4`)
|
`n` |
`l` |
Обозначение орбитали |
`ml` |
Число орбиталей |
Число электронов на подуровне |
|
`1` |
`0` |
`1s` |
`0` |
`1` |
`2` |
|
`2` |
`0` `1` |
`2s` `2p` |
`0` `−1`; `0`; `+1` |
`1` `3` |
`2` `6` |
|
`3` |
`0` `1` `2` |
`3s` `3p` `3d` |
`0` `−1`; `0`; `+1` `−2`; `−1`; `0`; `+1`; `+2` |
`1` `3` `5` |
`2` `6` `10` |
|
`4` |
`0` `1` `2` `3` |
`4s` `4p` `4d` `4f` |
`0` `−1`; `0`; `+1` `−2`; `−1`; `0`; `+1`; `+2` `−3`; `−2`; `−1`; `0`; `+1`; `+2`; `+3` |
`1` `3` `5` `7` |
`2` `6` `10` `14` |
Химические свойства элементов и их соединений определяются электронным строением валентного уровня их атомов. Именно с участием электронов валентного уровня возникают химические связи между атомами и образуется соединение (вещество). Поэтому важно понимать правила заполнения электронных оболочек, строение валентного уровня и составлять электронную конфигурацию атомов элементов.
Электронная конфигурация атома
В 1927 год немецкий физик
Вейнер Гейзенберг сформулировал принцип неопределенности: невозможно
как-либо установить местонахождение электрона в атоме, и строго определенная
орбита для электрона никогда не может стать физической реальностью.
В ходе развития истории
изучения атома и элементарных частиц, входящих в его состав, был принят новый квантово-механический
подход к строению атома.
Основные постулаты
квантово-механического подхода к строению атома:
1.
Электрон можно одновременно рассматривать и как частицу, и как
волну (корпускулярно-волновой дуализм)
2.
Электрон может находится на любом расстоянии от ядра, однако
вероятность его пребывания в разных областях атома – различна.
Электрон может
находится в любой точки пространства. Определенной траектории, линии движения
по орбите – нет. Поэтому квантовая механика вводит понятие электронного облака.
Орбиталь (или электронное облако) –
это область пространства, где максимально вероятно расположение электрона
Электронную орбиталь,
то есть расположение электрона описывают с помощью набора чисел – квантовых.
Орбиталь = электронное облако – обозначается
квадратиком
Электрон – стрелочка в квадратике
Квантовые числа
Прежде всего нужно
усвоить, что: наиболее вероятное место нахождения электрона – это орбиталь
(обозначается квадратиком). Орбитали выстраиваются в подуровни, а
подуровни выстраиваются в энергетические уровни (электронные слои). При
этом орбиталь имеет примерную форму.
Аналогия с домом:
каждый электрон занимает определенную комнату, из комнат формируются квартиры,
а из квартир этажи. Количество «комнат, квартир и этажей» четко устанавливается
законами квантовой механики.
Для описания
расположения электрона, то есть его орбитали – используют квантовые числа: их
всего 4 штуки.
1. ГЛАВНОЕ
КВАНТОВОЕ ЧИСЛО – n
|
Что характеризует? |
• энергию • удаленность Закономерность: чем |
|
Значения: |
В На В базовом курсе, мы берем: 1, 2, 3, 4 |
|
Что показывает значение |
Количество |
|
Как найти значение? |
Посмотреть на номер периода в таблице Менделеева |
Все орбитали с
одинаковым значением n имеют одинаковую энергию и в совокупности образуют энергетический
уровень (электронный слой)
«это этаж в доме»
2. ПОБОЧНОЕ
(ОРБИТАЛЬНОЕ) КВАНТОВОЕ ЧИСЛО – ℓ
|
Что характеризует? |
• форму электронной орбитали |
|
Значения: |
0 1 |
|
Что показывает значение |
Форму То есть какой формы (s, |
|
Как найти значение? |
От 0 до (n-1=Вычесть из значения главного квантового числа единицу = Номер |
Орбитали с одинаковыми
значениями главного и орбитального квантовых чисел образуют – энергетические
подуровни
«это квартиры на этаже»
Для 1 энергетического уровня, n=1 ℓ = от 0 до n-1 значит ℓ= 0
0 соответствует s
орбитали, следовательно на первом энергетическом уровне может находится только
одна s-орбиталь
Образуется только 1 подуровень — 1s подуровень
Для 2 энергетического уровня,
n=2 ℓ = от 0 до n-1 значит ℓ = 0, 1
0 соответствует s
орбитали, 1 – p орбитали – следовательно на втором энергетическом уровне может
находится одна s-орбиталь и одна p-орбиталь
Значит на 2 энергетическом уровне образуется 2 подуровня –
2s подуровень и 2p подуровень
Для 3 энергетического уровня,
n=3 ℓ = от 0 до n-1 значит ℓ = 0, 1, 2
0 соответствует s
орбитали, 1 – p орбитали, 2 – d орбитали – следовательно на третьем
энергетическом уровне может находится одна sорбиталь, одна p-орбиталь и одна
d-орбиталь
Значит на 3
энергетическом уровне образуется 3 подуровня – 3s подуровень, 3p подуровень
и 3d подуровень
Для 4 энергетического уровня,
n=4 ℓ = от 0 до n-1 значит ℓ = 0, 1, 2, 3
0 соответствует s
орбитали, 1 – p орбитали, 2 – d орбитали, 3 – f орбитали – следовательно на
четвертом энергетическом уровне может находится одна sорбиталь, одна
p-орбиталь, одна d-орбиталь и одна f-орбиталь
Значит на 4 энергетическом уровне образуется 4 подуровня –
4s подуровень, 4p подуровень,
4d подуровень и 4f подуровень
Получается следующий
ряд в порядке следования уровней
1s 2s 2p 3s 3p 3d 4s 4p 4d 4f и так далее
3. МАГНИТНОЕ КВАНТОВОЕ ЧИСЛО – mℓ
|
Что характеризует? |
• положение • количество |
|
Значения: |
mℓ = От -ℓ через 0 до +ℓ |
|
Что показывает значение |
Сколько конкретно может быть s, p, f и d |
|
Как найти значение? |
От Считаем не сами значения, а их количество |
Пояснение
Берем s-орбиталь. Данной форме
соответствует численное значение 0 mℓ = 0 (не бывает минус и
плюс ноль, поэтому просто ноль)
Следовательно магнитное
квантовое число может принимать только одно значение
Значит s-орбиталь может иметь только одно положение – и она
одна.
Рисуем только 1 квардратик для s-орбитали ⧠
Берем p-орбиталь. Данной форме
соответствует численное значение 1 mℓ = -1, 0, +1 (то есть от
минус один через ноль до плюс один)
Следовательно магнитное
квантовое число может принимать уже три разных значения
Значит есть три разных расположения
p-орбиталей – их количество три. Рисуем 3 квадратика для p-орбиталей ⧠⧠⧠
Берем d-орбиталь. Данной форме
соответствует численное значение 2 mℓ = -2, -1, 0, +1, +2 (то
есть от минус двух через ноль до плюс двух)
Следовательно магнитное
квантовое число может принимать уже пять разных значений
Значит есть пять разных
расположений d-орбиталей – их количество пять
Рисуем 5 квадратиков для d-орбиталей ⧠⧠⧠⧠⧠
Берем f-орбиталь. Данной форме соответствует
численное значение 3
mℓ = -3, -2, -1, 0, +1, +2, +3
Следовательно магнитное
квантовое число может принимать уже семь разных значений
Значит семь разных положений f-орбиталей – количество семь.
Рисуем 7 квадратиков для f-орбиталей ⧠⧠⧠⧠⧠⧠⧠
Расчеты
показывают откуда берется количество орбиталей
(квадратиков) – дальше просто запоминается
Эти орбитали – «это комнаты в квартире на этаже»

4. СПИНОВОЕ КВАНТОВОЕ ЧИСЛО – ms
|
Что характеризует? |
• спин электрона (эффект от |
|
Значения: |
ms = +1/2 и -1/2 |
|
Что показывает значение |
Как вращается электрон Графически выражается в |
Электрон схематически изображается стрелочкой в квадратике
Как понять какое
количество электронов может располагаться на энергетическом уровне?
Электроны располагаются
на энергетических уровнях в определенном количестве. Максимальное число
электронов, которое может разместиться на определенном уровне находят по формуле
N=2n2
То есть
На 1 энергетическом уровне может располагаться N=2*1=2
электрона
На 2 энергетическом уровне может располагаться N=2*4=8
электронов
На 3 энергетическом уровне может располагаться N=2*9=18
электронов
На 4 энергетическом уровне может располагаться N=2*18=32
электрона
Это тоже не считается
каждый раз, а запоминается – при необходимости всегда можно посчитать
Таким образом, расписав
все электроны – мы получаем представление об электронной оболочке атома.
Электронная оболочка атома – это совокупность всех
его электронов.
Правила составления электронных конфигураций
Распределение
электронов по энергетическим уровням, подуровням и орбиталям подчиняется
определенным принципам и правилам.
Их 3 основных: Принцип Паули, Принцип минимума энергии,
Принцип
Гунда (Хунда)
1. Принцип Паули
• В атоме не может быть двух
электронов, имеющих одинаковый набор всех четырех квантовых чисел
Что это значит?
На одной орбитале может
находится только 2 электрона, причем с разными спинами
То есть в одном
квадратике рисуем максимум две стрелки и обязательно они повернуты в разные
стороны
2. Принцип минимума энергии
• Энергетические
уровни, подуровни и орбитали атома заполняются электронами в порядке
возрастания их энергии
Об энергии электронных
уровней судят по значению главного квантового числа n: чем больше число,
тем больше энергия.
То есть. первую очередь
электроны будут заполнять уровни с минимальным количеством энергии, то есть с
минимальным значением n.
Что это значит? Заполнение
электронов идет последовательно по уровням/слоям – начиная с первого и так
далее
С энергией подуровня – чуть
посложнее. Энергию подуровня одного электронного подуровня оценивают с помощью правила
М.В. Клечковского • Энергия подуровней одного
электронного уровня возрастает с увеличением суммы главного и орбитального
квантовых чисел (n+l)
• Если
несколько подуровней характеризуются одинаковой суммой (n+l), то подуровень с
меньшим значением главного квантового числа имеет меньшую энергию
Итак, зачем нам это правило
Если мы запишем ряд, по
которому происходит заполнение электронами в порядке следования уровней мы
получим следующее:
1s 2s 2p 3s 3p 3d 4s 4p 4d 4f и так далее
Оценим энергию
каждого подуровня
Для этого мы складываем значение n и l
|
1s |
2s |
2p |
3s |
3p |
3d |
4s |
4p |
4d |
4f |
|
1 |
2 |
3 |
3 |
4 |
5 |
4 |
5 |
6 |
7 |
Для этого мы складываем значение n и l
Что мы наблюдаем: что энергия 4s подуровня меньше, чем
энергия 3d
Значит по принципу минимума энергии – 4s
подуровень будет заполняться электронами первее
|
1s |
2s |
2p |
3s |
3p |
3d |
4s |
4p |
4d |
4f |
|
1 |
2 |
3 |
3 |
4 |
5 |
4 |
5 |
6 |
7 |
Значит, что электроны
будут заполнять ряд в порядке возрастания энергий Получаем следующий
ряд, последовательность необходимо запомнить
1s 2s 2p 3s 3p 4s 3d 4p и так далее*
* данный ряд достаточен для первых
четырех периодов, при желании – его можно продолжить
3. Правило Гунда (Хунда)
• Суммарное спиновое квантовое
число электронов данного подуровня должно быть максимальным

«Правило Троллейбуса» — сначала занимаем свободные места,
только потом подсаживаемся к другим
Особые
элементы!
Существует несколько
атомов, в электронных оболочках которых наблюдается явление «провала или
проскока» электрона
При заполнении
электронных оболочек – электрон «проваливается» с 4s подуровня, где он
должен находиться в нормальном положении, на 3d подуровень.
Это объясняется более
выгодным положением с энергетической точки зрения именно для данных атомов.
В первых четырех периодах – это:
− 24 элемент – Медь Cu
− 29 элемент – Хром Cr
Алгоритм
составления электронных конфигураций
1.
Записать символ элемента с указанием заряда его ядра – это
число показывает количество протонов и является равным количеству электронов.
Заряд ядра – это порядковый номер элемента.
2.
Изобразить количество энергетических уровней – это можно
узнать по номеру периода, в котором расположен элемент.
3.
Определить к какой подгруппе относится элемент – главной (А)
или побочной (B)
а) Если элемент
находится в главной подгруппе (А):
− Сначала распределить электроны
по уровням
Электроны распределяются по уровням с учетом максимального
количества электронов на каждом уровне (2, 8, 18, 32)
Учитывается также что
на последнем уровне количество электронов должно быть равно номеру группы (для
элементов побочных подгрупп – это правило НЕ работает)
− Изобразить графическую формулу
электронов
− Записать электронную формулу
б) Если элемент
находится в побочной подгруппе (B)
− Сначала изобразить графическую
формулу электронов
− Записать электронную формулу
− Распределить электроны по
уровням
! Помним, что электроны заполняют
подуровни в порядке возрастания энергии с учетом принципов Паули и правила
Хунда
1s 2s 2p 3s 3p 4s 3d 4p и так далее*
Примеры
I. Составление электронной
конфигурации для атомов главных подгрупп
1.
Записать символ элемента с указанием заряда его ядра – это число
показывает количество протонов и является равным количеству электронов.
Заряд ядра – это порядковый номер элемента.

2.
Изобразить количество энергетических уровней – это можно узнать
по номеру периода, в котором расположен элемент.

3.
Элемент находится в главной подгруппе (А), поэтому:
− Сначала распределить электроны
по уровням

Электроны
распределяются по уровням с учетом того, что на последнем уровне количество
электронов должно быть равно номеру группы.
У фтора номер группы – 7, на последнем уровне – 7
электронов.
− Изобразить графическую формулу
электронов

− Записать электронную формулу

II. Составление электронной
конфигурации для атомов главных подгрупп
1.
Записать символ элемента с указанием заряда его ядра – это число
показывает количество протонов и является равным количеству электронов.
Заряд ядра – это порядковый номер элемента.

2.
Изобразить количество энергетических уровней – это можно узнать
по номеру периода, в котором расположен элемент.

3.
Элемент находится в побочной подгруппе (B), поэтому:
− Сначала изобразить графическую
формулу электронов

− Записать электронную формулу

− Распределить электроны по
уровням



