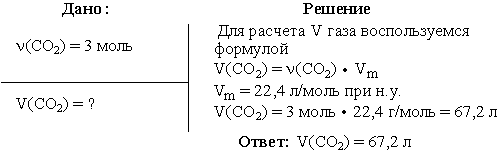Как вычислить массу газа
Довольно часто встает вопрос: как можно вычислить массу какого-либо газа, содержащегося в определенном объеме при определенных условиях (давлении, температуре)? Произвести эти вычисления несложно, надо лишь знать несколько правил.

Инструкция
Предположим, перед вами поставлена задача: надо определить массу углекислого газа, занимающего при нормальном давлении и комнатной температуре объем в 0,18 м^3. Прежде всего вспомните универсальное правило, согласно которому 1 моль любого газа при нормальных условиях занимает объем, равный 22,4 литра. (Точнее – 22, 414 литра, но для упрощения расчетов эту величину можно округлить).
Потом переведите данный вам объем в литры. 0,18м^3 – это 180 литров. Соответственно, в нем содержится 180/22,4 = 8,036 молей углекислого газа.
А теперь остается последний шаг. Формула углекислого газа — СО2. Его молярная масса: 12 + 16*2 = 44 грамма/моль. То есть в одном моле углекислого газа содержится примерно 44 грамма этого вещества. Сколько же его в 8,036 молях? Произведите умножение: 44*8,036 = 353, 58 грамма или округленно 353,6 грамма. Задача решена.
Если вам надо найти массу того же углекислого газа, но находящегося при условиях весьма отличающихся от нормальных? Например, какое-то количество этого газа поместили в герметичный сосуд объемом V, нагрели до температуры Т, измерили его давление, оказавшееся равным P. Вопрос: какая масса углекислого газа содержится в сосуде при таких условиях?
И эта задача также очень простая. Для ее решения надо всего лишь вспомнить про уравнение Менделеева-Клапейрона, названное в честь двух выдающихся ученых. Оно было выведено ими для описания состояний так называемого «идеального газа». Его формула такова: PV = MRT/m. Или в слегка видоизмененной форме: PVm = МRT, где З – давление в паскалях, V – объем в кубических метрах, m – молярная масса газа, M – его фактическая масса, T – температура в градусах Кельвина, R – универсальная газовая постоянная, примерно равная 8,31.
Легко можно видеть, что фактическая масса газа М вычисляется по формуле: М = PVm / RT. Подставив в эту формулу все известные данные, и помня, что молярная масса углекислого газа m равна 44 грамма/моль, вы легко получите ответ.
Конечно же, ни углекислый газ, ни какой-либо другой не является идеальным газом. Поэтому, уравнение Менделеева-Клапейрона не вполне точно описывает его состояние. Но, если условия не очень сильно отличаются от нормальных, погрешности вычислений малы, и ими можно пренебречь.
Источники:
- формула углекислого газа
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Вычисление массы и объема газов
Если в условиях задачи указаны вещества в газообразном состоянии, то при вычислениях необходимо использовать газовые законы, связывающие количества и массы веществ с их объемами.
Задача 1. Вычислить объем диоксида углерода при н.у., взятого количеством
вещества 3 моль.
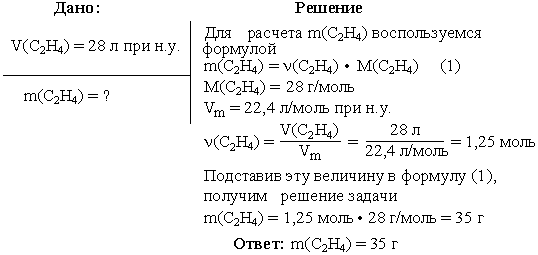
Задача 2. Вычислить массу этилена (C2H4), занимающего при н.у. объем 28 л.
Задача 3. Вычислить объемную долю метана в смеси, состоящей из 30 л
метана, 5 л этана и 2 л водорода. Объемы газов измерены при одинаковых
условиях.
Часто допускается ошибка, когда при проведении расчётов отождествляются величины массовых и объёмных долей вещества.
Чтобы показать ошибочность таких представлений, рассмотрим решение задачи, в которой расчёт объемов газов связан с вычислениями их масс.
Задача 4. Имеется газовая смесь, массовые доли газа в которой равны (%): метана – 65, водорода – 35. Определите объемные доли газов в этой смеси.
Таким образом, числовые значения массовых и объемных долей не совпадают.
Как найти массу газа в баллоне?
#37026
2020-03-24 14:18 GMT
Есть баллон с метаном, объемом 210 литров, с давлением 24,5 МПа! Какая масса газа уместиться в такой баллон? Желательно с формулами и пояснениями к ним
#37028
2020-03-24 15:34 GMT
#37026
РоманУфа :Есть баллон с метаном, объемом 210 литров, с давлением 24,5 МПа! Какая масса газа уместиться в такой баллон? Желательно с формулами и пояснениями к ним
Вот вам формула с пояснениями:

Отсюда (m=frac{PVM}{RT}).
Для метана (M=0.016;frac{кг}{моль} ).
Как видите, нужно ещё знать температуру. Чем больше температура, тем меньше масса газа.
Подставляете числа в формулу и считаете.
#37029
2020-03-24 16:56 GMT
#37028
zam :#37026
РоманУфа :Есть баллон с метаном, объемом 210 литров, с давлением 24,5 МПа! Какая масса газа уместиться в такой баллон? Желательно с формулами и пояснениями к ним
Вот вам формула с пояснениями:

Отсюда (m=frac{PVM}{RT}).
Для метана (M=0.016;frac{кг}{моль} ).
Как видите, нужно ещё знать температуру. Чем больше температура, тем меньше масса газа.
Подставляете числа в формулу и считаете.
А в каких единицах измерения подставлять значения???
#37031
2020-03-24 17:32 GMT
#37029
РоманУфа :А в каких единицах измерения подставлять значения???
Главное, что бы все в одной системе. Наиболее популярная — Си.
Тогда (P = 24.5; МПа = 2.45 cdot 10^7 ; Па),
(V=0.21; м^3)
,
(T=293;K)
(нормальная комнатная температура).
#37032
2020-03-24 18:26 GMT
#37031
zam :#37029
РоманУфа :А в каких единицах измерения подставлять значения???
Главное, что бы все в одной системе. Наиболее популярная — Си.
Тогда (P = 24.5; МПа = 2.45 cdot 10^7 ; Па),
(V=0.21; м^3)
,(T=293;K)
(нормальная комнатная температура).Огромное спасибо за помощь
#37041
2020-03-25 09:37 GMT
zam, тут давление больно высокое.
245 атмосфер.
У Метан Tk=190,65 К Pk=45,8 атмосферы
Плохо помню какие есть методы исследовани я веществ в критическом состоянии и как они себя видут, но думается там уже будет жидкость, а не пар.
Относительный удельный вес жидкого метана 0,555
210 Л *0,555= 116,55 кг.

#37047
2020-03-25 12:31 GMT
#37041
Очепятка :но думается там уже будет жидкость, а не пар.
В задании сказано: «Какая масса газа…».
Так что, условия там такие, что метан в газообразном состоянии.
#37053
2020-03-25 13:49 GMT
#37047
zam :#37041
Очепятка :но думается там уже будет жидкость, а не пар.
В задании сказано: «Какая масса газа…».
Так что, условия там такие, что метан в газообразном состоянии.
Так Вы фразу целиком читайте. «Какая масса газа уместиться в такой баллон?»
Это не значит, что газ в болоне, это значит что закачиваем мы газ. А балон такой что сжимает газ до жидкого состояния.
Довольно часто встает вопрос: как можно вычислить массу какого-либо газа, содержащегося в определенном объеме при определенных условиях (давлении, температуре)? Произвести эти вычисления несложно, надо лишь знать несколько правил.
Предположим, перед вами поставлена задача: надо определить массу углекислого газа, занимающего при нормальном давлении и комнатной температуре объем в 0,18 м^3. Прежде всего вспомните универсальное правило, согласно которому 1 моль любого газа при нормальных условиях занимает объем, равный 22,4 литра. (Точнее – 22, 414 литра, но для упрощения расчетов эту величину можно округлить).
Потом переведите данный вам объем в литры. 0,18м^3 – это 180 литров. Соответственно, в нем содержится 180/22,4 = 8,036 молей углекислого газа.
А теперь остается последний шаг. Формула углекислого газа — СО2. Его молярная масса: 12 + 16*2 = 44 грамма/моль. То есть в одном моле углекислого газасодержится примерно 44 грамма этого вещества. Сколько же его в 8,036 молях? Произведите умножение: 44*8,036 = 353, 58 грамма или округленно 353,6 грамма. Задача решена.
Если вам надо найти массу того же углекислого газа, но находящегося при условиях весьма отличающихся от нормальных? Например, какое-то количество этого газа поместили в герметичный сосуд объемом V, нагрели до температуры Т, измерили его давление, оказавшееся равным P. Вопрос: какая масса углекислого газа содержится в сосуде при таких условиях?
И эта задача также очень простая. Для ее решения надо всего лишь вспомнить про уравнение Менделеева-Клапейрона, названное в честь двух выдающихся ученых. Оно было выведено ими для описания состояний так называемого «идеального газа». Его формула такова: PV = MRT/m. Или в слегка видоизмененной форме: PVm = МRT, где З – давление в паскалях, V – объем в кубических метрах, m – молярная масса газа, M – его фактическая масса, T – температура в градусах Кельвина, R – универсальная газовая постоянная, примерно равная 8,31.
Легко можно видеть, что фактическая масса газа М вычисляется по формуле: М = PVm / RT. Подставив в эту формулу все известные данные, и помня, что молярная масса углекислого газа m равна 44 грамма/моль, вы легко получите ответ.
Конечно же, ни углекислый газ, ни какой-либо другой не является идеальным газом. Поэтому, уравнение Менделеева-Клапейрона не вполне точно описывает его состояние. Но, если условия не очень сильно отличаются от нормальных, погрешности вычислений малы, и ими можно пренебречь.
Как найти массу вещества если известен его объём?
При нормальных условиях молярный объём газа равен 22,4 л/моль.
…
Массу вещества можно найти несколькими способами:
- Умножив количество вещества на молярную массу: m (г) = n (моль)×M (г/моль).
- Произведением объёма раствора и его плотности: m = V (л) ×ρ (г/л).
- Перемножив массовую долю с массой раствора: m = m(р—ра) × ω.
Как найти массу если есть объём?
Вес можно рассчитать по формуле: m=V*p, где р – плотность, V – объем материала. Например, 10 м3 речного песка весят 13 тонн. Если известна масса материала, то объем можно узнать по формуле: V = m/ p.
Как найти объём газа в химии зная массу?
Единица измерения молярного объёма газа : л/моль. При нормальных условиях Vм = 22,4 л/моль. Из определения для Vм следует, что Vв = Vм *nв = Vм *mв Mв. Это выражение позволяет рассчитывать по массе газа его объём.
Как найти количество вещества Если дан объём?
Выразим из формулы молярного объёма n : n ( X ) = V ( X ) V m — химическое количество газа можно вычислить, если его объём разделить на молярный объём.
Как найти массу вещества в реакции?
И наоборот, массу вещества определяют как произведение молярной массы на количество вещества: m = n . M. Так, масса 0,1 моля Na составляет 0,1 моль×23 г/моль = 2,3 Молярная масса численно всегда совпадает с молекулярной массой (или атомной массой — если вещество состоит не из молекул, а из атомов).
Как можно найти массу вещества?
m ( X ) = n ( X ) ⋅ M ( X ) — масса вещества равна произведению его количества на молярную массу.
Как найти массу?
Масса тела выражается через плотность и объем следующей формулой: Масса тела — есть произведение плотности вещества из которого состоит тело на его объем. … m — масса тела, (килограмм), ρ — плотность вещества, (кг/м³).
Как найти массу растворенного вещества?
Массу растворённого вещества вычислим по формуле: m ( в − ва ) = w ( в − ва ) ⋅ m ( р − ра ) ; m ( H 2 SO 4 ) = w ( H 2 SO 4 ) ⋅ m ( р − ра ) = 0,64 ⋅ 200 = 128
Что такое 22 4 в химии?
Итак, 22,4 л – МОЛЯРНЫЙ ОБЪЕМ ГАЗОВ при нормальных условиях. Это очень важная величина, которую следует запомнить. … Остается выяснить, как была определена постоянная Авогадро – число молекул газа в 22,4 л газа и в 1 моле любого вещества.
Как найти массу газа?
Расчет массы газа.
Расчет массы газа проводится также с помощью уравнения состояния идеального газа. mг=(V⋅P⋅M)/(T⋅R), где P — давление газа в сосуде, M — молярная масса газа, T — температура газа в сосуде, R — универсальная газовая постоянная.
Как найти количество вещества через концентрацию?
Количество растворенного вещества : = c•V, где c – молярная концентрация растворенного вещества в моль/л, V – объем раствора в л.
Как найти объем с помощью количества вещества?
Объем твердого вещества определяется по формуле V = m/плотность. Объем газа вычисляется по формуле V = n*Vm , где молярное количество n = m/M.
Как вычислить объём кислорода?
V = RTM/mP. Как видите, если у вас имеются необходимые для расчетов данные (температура, масса и давление кислорода), вычислить его объем очень просто. Поскольку значения R (8,31) и m (32) вам и так известны.