: 29 сен 2014 , Мой НГУ , том 57/58,
№3/4
Вирус под микроскопом: от визуализации к манипуляции
Вирусы являются чрезвычайно малыми объектами, имеющими размер от нескольких десятков до нескольких сотен нанометров. Первым и на несколько десятилетий единственным методом их визуализации стала электронная микроскопия, позволившая не только подробно изучить строение самих вирусных частиц, называемых вирионами, но и исследовать процессы, происходящие в зараженной клетке – репликацию вируса. «Монополия» электронной микроскопии была нарушена появлением в начале 1980-х годов принципиально нового класса приборов – сканирующих зондовых микроскопов.
Относящийся к данному классу атомно-силовой микроскоп оказался инструментом, подходящим для исследования биологических объектов и позволил не только визуализировать наноразмерные структуры, но и манипулировать ими. В частности, принципиально возможной оказалась манипуляция одиночными вирионами и прямое измерение сил, возникающих при их контакте с поверхностью клетки. Такие эксперименты позволяют получать подробные данные о самом первом и во многих случаях еще недостаточно исследованном этапе заражения клетки – адгезии вируса к ее поверхности. Данные исследования представляют и значительный практический интерес, т.к. могут дать ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
В известной песне Владимира Высоцкого поется: «не поймаешь нейтрино за бороду и не посадишь в пробирку…». Конечно, вирус – это не нейтрино, не атом и даже не молекула, но все же объект настолько малый, что его невозможно увидеть не только глазом, но и в обычный световой микроскоп. Однако электронная микроскопия, в сотни тысяч раз увеличившая возможности нашего зрения, позволила не только увидеть эти удивительные объекты, но и рассмотреть их до мельчайших подробностей. А атомно-силовая микроскопия, в такой же степени обострившая наше осязание, позволила осуществить прямую механическую манипуляцию вирусными частицами
Вирусы являются чрезвычайно малыми объектами – их размеры лежат в диапазоне от нескольких десятков до нескольких сотен нанометров. Первым и на долгое время единственным методом прямой визуализации наноразмерных частиц стала электронная микроскопия (ЭМ), которая начала развиваться в 1930-е гг. Метод, оказавшийся очень информативным, позволил не только детально охарактеризовать структуру различных вирусов, но и исследовать процессы, происходящие в зараженной клетке.
Оказалось, что форма вирусных частиц отличается большим разнообразием: от правильных сфер до сложных структур, напоминающих кирпичи, обклеенные трубочками (вирус натуральной оспы), или щетинистых червей (вирус геморрагической лихорадки Эбола).
Еще большее разнообразие было обнаружено для стратегии репликации (размножения) вирусов. Единственным фундаментальным свойством, общим для всех без исключения вирусов, оказался их статус облигатного внутриклеточного паразита. Это означает, что для размножения вируса его генетический материал должен в обязательном порядке проникнуть в живую клетку и «захватить» ее ферментативный аппарат, переключив последний на производство копий вируса.
Вне клетки любой вирус является всего лишь молекулярным контейнером с генетическим материалом (ДНК или РНК) и вряд ли может считаться полноценным живым организмом, хотя по этому вопросу в научной среде до сих пор нет окончательной терминологической определенности.
Спецификой электронной микроскопии является изучение фиксированных, т. е. подготовленных специальным образом, объектов – по сути, она работает только с «мертвой» материей *. Имея дело только с «застывшими мгновениями», исследователь может лишь строить гипотезы о динамике изучаемых процессов, поскольку не имеет возможности наблюдать их течение в реальном времени.
Так, исследование репликации вируса методом просвечивающей электронной микроскопии на ультратонких срезах выглядит следующим образом: зараженные клетки обрабатывают фиксирующим раствором, обезвоживают спиртом и заливают специальной смолой. После отвердевания смолы с помощью специального прибора – ультратома – делают ультратонкие (≈ 50 нм) срезы, которые затем наносят на специальную сетку и обрабатывают растворами солей тяжелых металлов. Во время самого микроскопического исследования образец находится в вакуумной камере и подвергается действию пучка электронов с энергией в несколько десятков кэВ. Очевидно, что прижизненная визуализация в данном случае принципиально невозможна.
В течение почти полувека электронная микроскопия оставалась единственным методом визуализации наноразмерных объектов. Однако в начале 1980-х гг. эта монополия была нарушена появлением сканирующей зондовой микроскопии (СЗМ). Основным принципом СЗМ является сканирование – прецизионное (с высокой точностью) перемещение зонда вблизи исследуемой поверхности, сопряженное с отслеживанием определенного параметра, характеризующего взаимодействие между зондом и образцом. Результатом такого сканирования является топографическая карта рельефа поверхности образца.
Первым прибором СЗМ стал сканирующий туннельный микроскоп (СТМ), который мог лишь весьма ограниченно использоваться для визуализации биологических объектов, так как для его работы требовалась высокая электрическая проводимость исследуемой поверхности.
В 1986 г. швейцарский физик Г. Бинниг и его коллеги создали новый прибор семейства СЗМ – атомно-силовой микроскоп (АСМ). В основе его работы лежит силовое (Ван-дер-Ваальсово) взаимодействие атомов зонда и поверхности. АСМ не требуется электрическая проводимость поверхности образца, и он может осуществлять съемку в жидкой среде. Поэтому этот прибор оказался удобным инструментом для исследования биологических объектов.

С момента появления атомно-силового микроскопа было опубликовано огромное число работ, посвященных АСМ-визуализации самых разнообразных биологических образцов. Следует все же признать, что в большинстве случаев в плане визуализации АСМ не дает ничего принципиально нового в сравнении с обычной электронной микроскопией, поэтому зачастую данный метод воспринимается биологами как техническая экзотика, а не как полноценный исследовательский инструмент.
Однако важнейшим, пусть и почти единственным преимуществом визуализации биологических объектов при помощи АСМ по сравнению с электронной микроскопией является возможность выполнения исследований нативных, природных образцов без какой-либо фиксации и специальной пробоподготовки, при физиологических параметрах среды.
Помимо визуализации рельефа поверхности с субнанометровым разрешением АСМ позволяет осуществлять прямое измерение сил, возникающих при взаимо¬действии одиночных наноразмерных объектов.
Проводятся такие измерения следующим образом: один объект закрепляется на острие зонда АСМ, а второй фиксируется на подложке, после чего зонд подводится к поверхности подложки до достижения механического контакта, а затем возвращается обратно. В ходе этого перемещения отслеживается деформация упругой консоли (кантилевера). Зависимость этого параметра от расстояния между зондом и подложкой называется силовой кривой. С ее помощью можно определить величину силы, действующей между исследуемыми объектами. Этот метод, названный атомно-силовой спектроскопией (АСС), может использоваться для исследования силовых характеристик взаимодействия самых разнообразных малых объектов: от неорганических наночастиц до вирусов и живых клеток.
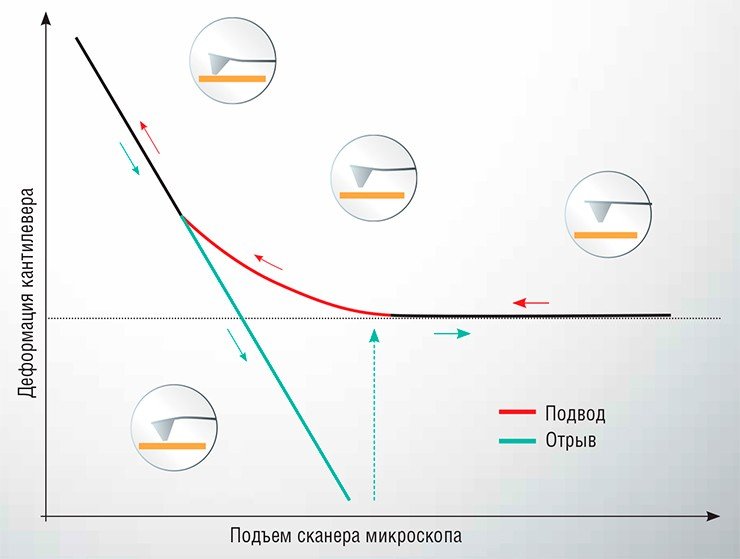
Начальным этапом заражения клетки вирусом является адгезия (прилипание) вирусной частицы (вириона) к клеточной поверхности с последующим проникновением генетического материала вируса внутрь клетки. Этот процесс, определяемый взаимодействием белковых рецепторов, расположенных на поверхности клетки, с поверхностными белками вириона, является критически важным для размножения вируса. И, надо отметить, в большинстве случаев изучен недостаточно.
Поистине захватывающие перспективы исследований в этом направлении открывает АСС. Зафиксировав одиночную вирусную частицу на острие зонда АСМ, можно осуществить измерение силы, возникающей при контакте вирусной частицы с поверхностью клетки, исследовать кинетические характеристики данного взаимодействия и даже «вдавить» вирион внутрь клетки, одновременно ведя наблюдение при помощи мощного светового микроскопа. В таком эксперименте исследователь из пассивного наблюдателя превращается в активного участника процесса, осуществляя механическую манипуляцию исследуемым наноразмерным объектом – такую возможность не может предоставить ни один из других видов микроскопии.

Однако фиксация одиночной вирусной частицы на острие зонда атомно-силового микроскопа является весьма непростой задачей. Для успешного проведения эксперимента требуется большая подготовительная работа:
- получить как можно более чистый и концентрированный препарат вируса;
- подготовить на острие зонда площадку подходящего размера для посадки вириона;
- химически активировать поверхность зонда для образования ковалентных связей при контакте с белками вируса;
- убедиться в том, что на зонде закрепился действительно вирион, а не молекулы свободного белка или мелкие фрагменты клеток, всегда присутствующие в препаратах вирусов.
Оценка концентрации и степени чистоты препарата вируса обычно проводится методом просвечивающей электронной микроскопии. Площадку на острие АСМ-зонда, которое обычно изготавливают из кремния или его нитрида, формируют путем длительного сканирования кремниевой или сапфировой подложки при больших значениях развертки и силы прижатия зонда к поверхности. Наиболее наглядной иллюстрацией для этого процесса служит изменение формы острия карандаша в ходе интенсивного рисования.
Главный вопрос, на который необходимо ответить при интерпретации любых результатов атомно-силовой спектроскопии, можно сформулировать следующим образом: «Силы между какими объектами были измерены?»
По меркам микроскопии, клетка высших организмов является относительно крупным (≈ 10 мкм) объектом, поэтому хорошо видна в световом микроскопе, при помощи которого на нее наводится кантилевер атомно-силового микроскопа. Но как быть с самим зондом, на острие которого предполагается наличие вириона? Строго говоря, вместо вириона там может оказаться все, что угодно: монослой белковых молекул, фрагмент клетки или вириона, агрегат из нескольких вирионов, случайное загрязнение и т. д. Кроме того, в процессе измерения вирион может разрушиться или оторваться от зонда. Визуализация же зонда с вирусной частицей методом электронной микроскопии до силовых измерений недопустима, так как под воздействием высушивания, вакуума и пучка электронов вирион приобретет необратимые изменения.
Наиболее эффективным методом решения данной проблемы оказалась визуализация острия зонда АСМ с помощью электронной микроскопии, осуществляемая непосредственно после силовых измерений. Если на острие будет обнаружена вирусная частица, уцелевшая в ходе эксперимента, то все сомнения развеются.
В течение последних пятидесяти лет в результате поистине титанической работы, проделанной электронными микроскопистами всего мира, накоплен огромный багаж знаний в области ультраструктурных аспектов репликации различных вирусов. Создание атомно-силового микроскопа и техники силовой спектроскопии позволило вплотную приблизиться к произвольной механической манипуляции одиночными вирусными частицами. Это выводит изучение взаимодействия вируса с клеткой на принципиально другой уровень – от структурных исследований к функциональным.
При этом атомно-силовая спектроскопия не является конкурентом для электронной микроскопии, а открывает новое самостоятельное направление исследований – наномеханику взаимодействия вирусной частицы с поверхностью клетки. Весьма вероятно, что в самом ближайшем будущем в данном направлении будут совершены фундаментальные открытия, соизмеримые по значимости с достижениями электронной микроскопии в середине прошлого века.
Изучение механизмов связывания вирусных частиц с поверхностью клетки вызывает значительный интерес не только с позиции фундаментальной науки, но и в контексте практических приложений. Более детальное понимание этих механизмов на молекулярном уровне может дать человечеству ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
*Просвечивающая электронная микроскопия с использованием специальной жидкостной ячейки и сканирующая электронная микроскопия при атмосферном давлении позволяют исследовать биологические объекты без фиксации, но из-за ряда технических трудностей и относительно низкого пространственного разрешения эти методы не получили широкого распространения
Литература
Корнеев Д. В., Бессуднова Е. В., Зайцев Б. Н. Изучение взаимодействия наночастиц TiO2 и поверхности эритроцитов человека методом атомно-силовой спектроскопии // УНЖ. 2012. № 4. С. 73—77.
Миронов В. Л. Основы сканирующей зондовой микроскопии. Нижний Новгород: ИФМ РАН, 2004. 182 с.
Alsteens D., Pesavent E., Cheuvart G. et al. Controlled manipulation of bacteriophages using single-virus force spectroscopy // ACSNANO. 2009. V. 3(10). P. 3063—3068.
Alsteens D., Trabelsi H., Soumillion P., Dufrene Y. F., Multiparametric atomic force microscopy imaging of single bacteriophages extruding from living bacteria // Nature Communications. V. 4. Article number: 2926.
Binnig G., Quate C. F., Gerber Ch. Atomic force microscope // Phys. Rev. Lett. 1986. V. 56(9). P. 930—933.
Cappella B., Dietler G. Force-distance curves by atomic force microscopy // Surf. Sci. Rep. 1999. V. 34. P. 1—104.
Malkin A.J., Plomp M., McPherson A. Unraveling the architecture of viruses by high-resolution atomic force microscopy // Methods Mol. Biol. 2005. V. 292. P. 85—108.
В публикации использованы фото автора
: 29 сен 2014 , Мой НГУ , том 57/58,
№3/4
Термин «вирус», virus, происходит от латинского слова «яд». Вирусы — инфекционные агенты, не существующие самостоятельно. Они встраиваются в клетку и воспроизводят в ней свои гены, переключая ее на производство вирусных белков. Поэтому мы говорим, что вирусы — это неклеточная форма жизни, облигатные паразиты, которые функционируют только внутри организма, а в открытой среде рано или поздно погибают.
В 1892 году отец вирусологии Д. И. Ивановский опубликовал труд, посвященный вирусам. Но и сегодня открытия в этой области продолжаются. Вирусы чрезвычайно малы, их размеры колеблются в интервале от 20 до 300 нм. Они не выращиваются, как бактерии, на искусственных средах, что затрудняет исследования.
Вирусные инфекции делятся на три типа в зависимости от того, как долго вирус находится в клетке, и какие с ней при этом происходят изменения.
1. Литическая
(от греч. лизис — разрушение) инфекция — пораженная клетка гибнет, вирусы покидают ее и «нападают» на другие клетки.
2. Персистентная
(стойкая) инфекция — вирусы оставляют клетку постепенно, клетка живет, но ее функционирование изменено.
3. Латентная (скрытая) инфекция — гены вируса встраиваются в хромосомы хозяйской клетки и передаются дочерним клеткам. Вирусы никуда не мигрируют, могут не активизироваться годами. Однако латентная инфекция может перейти в персистентную или литическую при активизации, размножении и выходе вируса из клетки. В связи с этим вирусы переносят гены от одного организма к другому, копируя части генов разных организмов.
Строение вирусов
1. Вирусы — генетические элементы, одетые в белковую оболочку и переходящие из одной клетки в другую.
2. У вирусов два основных вида симметрии, спиральная и кубическая.
3. Вирион
— отдельная вирусная частица с генетическим материалом в виде ДНК или РНК. Имеет симметричное строение.
4. Капсид — главная белковая оболочка, защищающая вирус от ультрафиолета и действия ферментов нуклеаз, которые разрушают нуклеиновые кислоты. Капсиды имеют многие цепи одного или нескольких типов белков. В состав капсида могут входить не только белки, но и гликопротеины — белки, связанные с углеводами.
5. У некоторых вирусов имеется внешняя оболочка — из липидов, заимствованных из плазмалеммы хозяина. Вирус гриппа имеет наружную оболочку кубического типа симметрии, но при этом спиральный вирион.
На чем основана современная классификация вирусов?
1. Вид и форма нуклеиновой кислоты (РНК — ДНК, линейная — кольцевая, одноцепочечная — двуцепочечная).
2. Тип симметрии — кубическая или спиральная.
3. Присутствие или отсутствие наружной оболочки.
Варианты вирусов по наличию ДНК или РНК
|
Вирусы с ДНК |
Вирусы с РНК |
|||
|
Вирусы с двухцепочечной ДНК. |
Вирусы с одноцепочечной ДНК. |
Вирусы с одноцепочечной РНК. |
Вирусы с двухцепочечной РНК. |
Вирусы с двумя идентичными одноцепочечными РНК. |
|
ДНК могут быть кольцевой или линейной формы (двухцепочечные более разнообразные). |
Такие вирусы могут иметь только кольцевую ДНК. |
Вирус табачной мозаики. Вирус гриппа. |
Вирус гепатита В. |
Некоторые онкогенные (опухолеродные) вирусы (капсид у них кубический). |
|
Бактериофаг Т4, вирус оспы имеют двухцепочечную линейную молекулу ДНК. Кстати, вирус оспы самый крупный и содержит 240 генов! Обезьяний вирус SV40 содержит двухцепочечную кольцевую ДНК. |
Пример — фаг М13, паразитирующий в клетках E. coli. |
Онкогенные ретровирусы имеют внешнюю оболочку. Вирус ВИЧ имеет такое же строение. |
Главная задача биологии — это развитие представлений у человека о живых организмах, о многообразии видов, обо всех закономерностях развития живых существ, а также об их взаимодействии с окружающей природой. Предмет основы безопасности жизнедеятельности (ОБЖ) позволяет получить знания и умения, которые помогут сохранить жизнь и здоровье в опасных ситуациях. Эти ситуации всегда возникают неожиданно, но, тем не менее, большинство из них предсказуемы и к ним можно подготовиться заранее. ОБЖ учит нас предвидеть возможные опасности и минимизировать потери от той или иной ситуации. Сегодня мы сталкиваемся с новым видом вирусной опасности COVID-19,о котором поговорим с точки зрения биологии и ОБЖ.
Что такое вирус?
Вирус — это неклеточный инфекционный агент. Сегодня нам известно около 6 тысяч различных вирусов, но их существует несколько миллионов. Вирусы не похожи друг на друга и могут иметь как форму сферы, спирали, так и форму сложного асимметричного сплетения. Размеры вирусов варьируются от 20 нм до 300 нм.
Как устроен вирус?
В центре агента находится генетический материал РНК или ДНК, вокруг которого располагается белковая структура — капсид.
Капсид служит для защиты вируса и помогает при захвате клетки. Некоторые вирусы дополнительно покрыты липидной оболочкой, т.е. жировой структурой, которая защищает их от изменений окружающей среды.
Вирусолог Дэвид Балтимор объединил все вирусы в 8 групп, из которых некоторые группы вирусов содержат 1-2 цепочки ДНК. Другие же содержат 1 цепочку РНК, которая может удваиваться или достраивать на своей матрице ДНК. При этом каждая группа вирусов производит себя в различных органеллах зараженной клетки.
Вирусы имеют определенный диапазон хозяев, т.е. он может быть опасен для одних видов и абсолютно безвреден для других. Например, оспой болеет только человек, а чумкой только некоторые виды плотоядных. Вирус не способен выжить сам по себе, поэтому активируется только в хозяйской клетке, используя ее ресурсы и питательные вещества. Цель вируса — создание множества копий себя, чтобы инфицировать другие клетки!
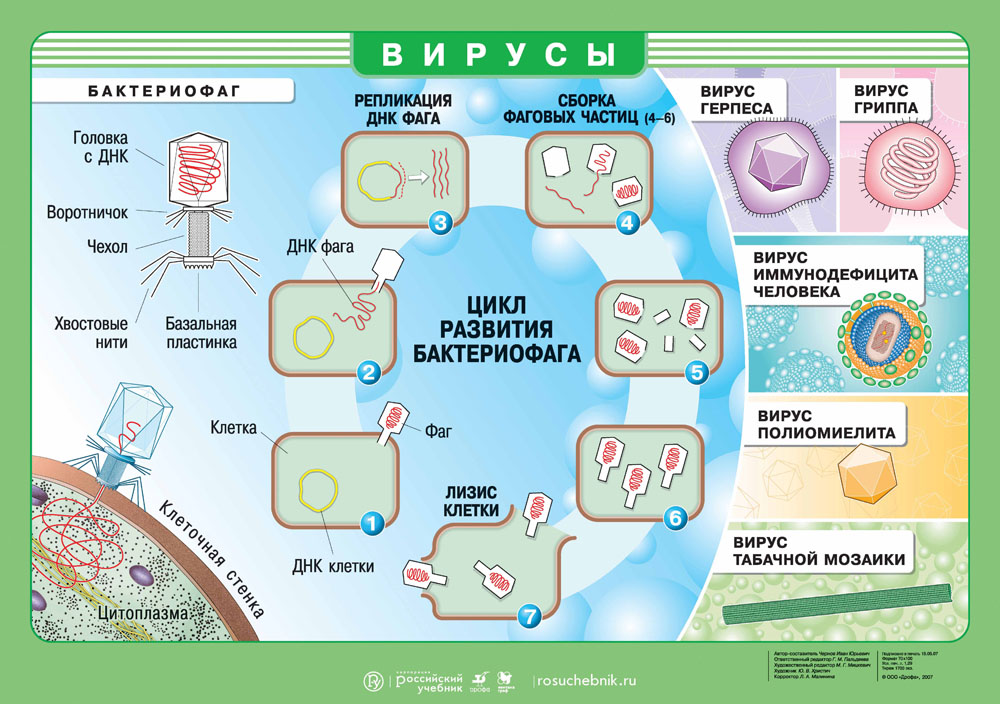
Вирусы. Цикл развития бактериофага. Скачать наглядное пособие в большом разрешении можно здесь.
Как вирус попадает в организм?
Вирусная инфекция начинается тогда, когда он проникает внутрь хозяина, а именно:
- через физические повреждения (например, порезы на коже)
- путём направленного впрыскивания (к примеру, укус комара)
- направленного поражения отдельной поверхности (например, при вдыхании вируса через трахею)
В зависимости от вида вируса, он может быть прикреплен:
- к эпителию слизистых оболочек (это например вирус гриппа)
- к нервной ткани (вирус простого герпеса)
- к иммунным клеткам (вирус иммунодефицита человека)

Биология. Рабочая тетрадь. 9 класс
Тетрадь является приложением к учебнику В. В. Пасечника, А. А. Каменского, Е. А. Криксунова, Г. Г. Швецова «Биология. Введение в общую биологию. 9 класс». Учебник соответствует ФГОС основного общего образования. Задания в тетради соответствуют содержанию разделов учебника и предназначены для самостоятельных работ учащихся с целью лучшего усвоения, систематизации и закрепления знаний, полученных при чтении учебника. В тетрадь включены тестовые задания, которые помогут ученикам подготовиться к успешной сдаче ЕГЭ и ГИА.
Купить
Геном вируса встраивается в одну из органелл или цитоплазму и превращает клетку в настоящий вирусный завод. Естественные процессы в клетке нарушаются, и она начинает заниматься производством и сбором белка вируса. Этот процесс называется репликацией. И его основная цель — это захват территории. Во время репликации генетический материал вируса смешивается с генами клетки хозяина — это приводит к активной мутации самого вируса, а также повышает его выживаемость. Когда процесс репликации налажен, вирусная частица отпочковывается и заражает уже новые клетки, в то время как инфицированная ранее клетка продолжает производство.
«Для проникновения в клетку белки поверхности вируса связываются со специфическими поверхностными белками клетки. Прикрепление, или адсорбция, происходит между вирусной частицей и клеточной мембраной. В мембране образуется дырка, и вирусная частица или только генетический материал попадают внутрь клетки, где будет происходить размножение вируса. Сегодня ученые всего мира сделали важное открытие о том, что заражение коронавирусом людей преклонного возраста объясняется тем, что у пожилых людей накапливается специфический белок, который помогает COVID-19 проникать внутрь клетки эпителия».
Кондратьева Елена
Выход вируса
Вирус создал множество собственных копий, клетка оказывается изнуренной из-за использования ее ресурсов. Больше вирусу клетка не нужна, поэтому клетка часто погибает и новорожденным вирусам приходится искать нового хозяина. Это и есть заключительная стадию жизненного цикла вируса.
Скорость распространения вирусной инфекции
Размножение вирусов протекает с исключительно высокой скоростью: при попадании в верхние дыхательные пути одной вирусной частицы уже через 8 часов количество инфекционного потомства достигает 10³, а концу первых суток − 10²³.
Вирусная латентность
Некоторые вирусы могут «спрятаться» внутри клетки. Это может происходить от того, чтобы уклониться от защитных реакций и иммунной системы хозяина, или просто от того, что продолжение репликации не входит в интересы вируса. Это умение прятаться называется латентностью. В течение определенного времени вирус не даёт начала потомкам и остается неактивным до тех пор, пока внешний стимул — например, свет или стресс, не активирует его.
Как вирус распространяется?
Существуют разные пути распространения вирусной инфекции.
- воздушно-капельный (кашель, чихание)
- с кожи на кожу (при прикосновениях и рукопожатиях)
- с кожи на продукты (при прикосновениях к пище грязными руками вирусы могут попасть в пищеварительную и дыхательную системы)
- через жидкие среды организма (кровь, слюну и другие)
Почему с вирусами так тяжело бороться?
Эволюция вирусов происходит буквально на наших глазах. Идет постоянная гонка между вирусами и живыми организмами. Эпидемии сопровождали человека с древних времён. Миллионы людей на различных континентах погибли от оспы и «испанского гриппа». Эпидемии этих болезней иногда были настолько опустошительными, что в некоторых городах, сёлах и деревнях умирало почти всё население. А когда вирус изобретает новое оружие — возникает пандемия.
Сегодня людям уже удалось победить некоторые вирусы, а некоторые взять под жесткий контроль. Например, Оспа (она же черная оспа). Болезнь вызывается вирусом натуральной оспы, передается от человека к человеку воздушно-капельным путем. Больные покрываются сыпью, переходящей в язвы, как на коже, так и на слизистых внутренних органов. Смертность, в зависимости от штамма вируса, составляет от 10 до 40 (иногда даже 70%), На сегодняшний день вирус полностью истреблен человечеством.
Кроме того, взяты под контроль такие заболевания, как бешенство, корь и полиомиелит. Но помимо этих вирусов существует масса других, которые требуют разработок или открытия новых вакцин.
Коронавирус
Виновником эпидемии, распространяющейся сегодня по миру, стал коронавирус, вирусная частица в 0,1 микрона. Свое название он получил благодаря наростам на своей структуре, своеобразным шипам. Внутри вируса спрятан яд, с помощью которого он подчиняет себе зараженный организм. Этот вирус воздействует не только на человека, но и на птиц, свиней, собак и летучих мышей. В настоящий момент выделяют от 30 до 39 разновидностей коронавирусной инфекции. Но для человека патогенно всего 6. И как любой другой вирус COVID-19 мутирует.

К наиболее распространенным симптомам COVID-19 относятся повышение температуры тела, сухой кашель и утомляемость. К более редким симптомам относятся боли в суставах и мышцах, заложенность носа, головная боль, конъюнктивит, боль в горле, диарея, потеря вкусовых ощущений или обоняния, сыпь и изменение цвета кожи на пальцах рук и ног. Как правило, эти симптомы развиваются постепенно и носят слабо выраженный характер. У некоторых инфицированных лиц болезнь сопровождается очень легкими симптомами.
Данные ВОЗ
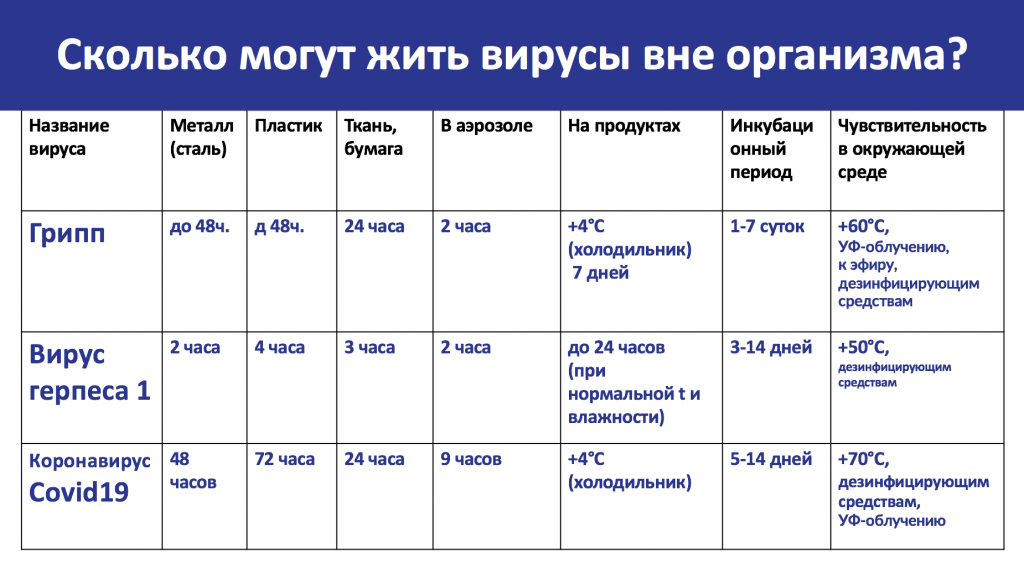
Сколько же может жить этот вирус вне организма? Все зависит от типа вируса и от той поверхности, на которую вирусы попали. В качестве примера было рассмотрено 3 вируса, по которым велись исследования. Изучали время, на которое может задерживаться вирус на различных поверхностях. Данные приведены в таблице.
Поскольку пока не изобретено вакцины от COVID-19, в целях защиты от инфекции самым важным для нас является соблюдение гигиены.
Гигиена — раздел медицины, изучающий влияние жизни и труда на здоровье человека и разрабатывающая меры (санитарные нормы и правила), направленные на предупреждение заболеваний, обеспечение оптимальных условий существования, укрепление здоровья и продление жизни.
Сегодня следует соблюдать определенные правила гигиены:
- Соблюдение режима труда и отдыха, не допускающего развития утомления и переутомления.
- Выполнение условий, обеспечивающих здоровый и полноценный сон (свежий воздух, отсутствие шума, удобная постель, оптимальная продолжительность).
- Правильное здоровое питание в соответствии с потребностями организма.
- Комфортный микроклимат в жилище (температура, влажность и подвижность воздуха, естественная и искусственная освещенность помещений).
- Содержание в чистоте тела и тщательный уход за зубами.
- Спокойное и корректное поведение в конфликтных ситуациях.
Кроме вакцинации не стоит забывать о важных мерах предупреждения инфекционных болезней, таких как обеспечение безопасности воды, продовольственного сырья, продуктов питания, выполнение установленных санитарных требований в местах хранения и приготовления пищи, а также о строгом соблюдении правил личной гигиены (мытье рук, ношении масок и одноразовых перчаток на улице).

«Мы пытались рассказать Вам не только о существующих научных фактах о вирусах, но и показать, что определенные знания помогают нам в нынешней практической ситуации сохранить свое здоровье и здоровье своих близких. Мы понимаем, что сегодня коронавирус может находиться практически везде: на поверхностях любых предметов, в окружающей среде и т.д. Поэтому самоизоляция – это один из важнейших способов защиты от инфекции. Находясь дома, вы защищаете не только свое здоровье, но и помогаете медикам и ученым, которые сражаются с этим вирусов и день и ночь. Ведь, чем меньше шансов у нас с вами заболеть, тем больше шансов появляется у них, чтобы победить коронавирус. Пожалуйста, оставайтесь дома и соблюдайте режим самоизоляции и нормы гигиены».
Кондратьева Елена
Вирус, наверное, самый загадочный микроорганизм биосистемы, чье существование никак не согласовывается с общепризнанными формами жизни на Земле. И, тем не менее, он не только успешно функционирует, но и эволюционирует семимильными шагами, буквально на ходу перестраивая свою генетическую структуру под воздействием внешних угроз.
Как устроены эти организмы, на чем базируется лечение вирусов, читайте на портале MedAboutMe.
Что представляет собой вирус
Вирус — одно из самых неизученных явлений в биологии. Предположительно, возник он примерно в тот же период, что и первая живая клетка, и в развитии своем образовал параллельную ветвь эволюции. Почему параллельную? Потому что и природа его и способ существования кардинально отличаются от клеточных микроорганизмов.
Часть ученых полагает, что вирус — это особая форма жизни, другая часть исследователей считает его совокупностью органических молекул, которые взаимодействуют с живыми организмами, третья группа называет его «организмом, балансирующем на границе живого». Кроме того, исследователи попытались дать ответ на вопрос о неклеточной структуре вируса. Возможно, когда-то давно вирусы были относительно огромными, а значит, содержали в себе гораздо больший объём генетической информации, нежели теперь. Поэтому неклеточная структура — может быть результатом работы природного механизма упрощения от сложного к простому.
Сходство вирусов с живыми существами состоит в наличии набора генов и в умении размножаться. Трудность в определении вируса заключается в том, что он имеет неклеточное строение, а ведь это фундаментальная характеристика всего живого на Земле. У вирусов есть генетический материал, но нет своего обмена веществ, поэтому им жизненно необходима клетка-хозяин, из которой они в буквальном смысле высасывают все соки, активно клонируя себя. Жизнь на Земле зародилась из клетки, которая размножалась делением, и этот принцип остался неизменным даже спустя миллиарды лет. Но вирус самопроизводится иначе: путем так называемой самосборки исключительно в клетке-хозяине (кстати, это его свойство дало толчок к развитию теории о появлении на планете жизни в виде органических молекул с функцией самосборки).
Исходя из вышенаписанного, сделаем вывод: вирус — неклеточный инфекционный агент, который умеет поражать все типы живых организмов от бактерий до людей. Для этого у него есть самые мощные инструменты, преодолевающие любые биологические барьеры, возводимые клеткой-хозяином. Столь широкие возможности, вкупе с умением бесконечно мутировать, наводят на мысль, что вирусы, пожалуй, могли стоять у истоков всего живого, только под воздействием неизвестных условий превратились в машину для уничтожения.
Белки в структуре вируса
Известно, что белки содержат в себе важную и уникальную информацию, которая определяет вид белка. На этом знании строилось исследование биологов из Иллинойского университета, полагающих, что вирусы — живые. Такая гипотеза была основана на изучении белковых молекул вируса.
Белковые структуры — неизменные константы (в отличие от генетического кода с его бесконечной вариативностью), поэтому они могут дать наиболее полную и достоверную картину эволюционного развития вирусов и клеток.
Изучив белки вирусов и клеток, ученые нашли великое множество сходных пунктов, а это указывает на существование общего предка (протовироклетки), от которого произошли эти две ветви эволюции. Скорее всего, у протовироклеток был РНК-геном сегментированного типа, и эти сегменты позаимствовали вирусы, скрыв их под белковой оболочкой.
Белковая оболочка — она же капсид — защищает нуклеиновую кислоту (РНК или ДНК) и сложена из идентичных белковых капсомеров, зашифрованных вирусным геномом. Иногда поверх капсида может быть суперкапсид — липидная оболочка, сгенерированная из мембраны захваченной клетки. Впрочем, у вируса нет никакого аппарата, синтезирующего белок, поэтому он пользуется всеми функциональными и техническими возможностями пораженной им клетки. Такой способ выживания ученые называют облигатным паразитизмом — и подобная жизненная стратегия может быть одним из вариантов развития протоклеток. В самом деле, если могли протоклетки развиваться миллионы лет за счет собственного деления, то могли параллельно эволюционировать за счет чужих ресурсов. Не исключено, что вирусы — всего лишь дегенеративный тип клеток, избравший путь паразитирования.
Лечение вирусов
Известно, что лучшим лекарством против бактериальных инфекций является антибиотик. Возникает вопрос: почему же лечение вирусов ему не под силу? Все дело опять-таки в различии природы вируса и бактерии. Антибиотики — препараты мощные, но спектр их действия ограничен микробами, но не вирусами.
В большинстве случаев, лечение вирусов не требует, да и не имеет специализированного подхода: лучшим препаратом против них служит сам иммунитет. Стандартно заболевшему достаточно несколько дней, чтобы прийти в себя (мы не говорим о сложных случаях, вроде ВИЧ, вируса гепатита и т. д.). Можно использовать жаропонижающие и обезболивающие, если нет медицинских запретов. Это поможет облегчить состояние и перенести вирусное заболевание с минимальным дискомфортом.
Другое дело, что на вирусную инфекцию порой накладывается бактериальная и в этом случае врач должен прописать антибиотикотерапию. Только тогда можно применять антибактериальный препарат. Такая строгость в его использовании продиктована объективными причинами. Нецелевое применение антибиотика ведет к нарастающим темпам резистентности (устойчивости) бактерий к препаратам, а это существенно осложняет схему лечения заболевшего пациента. Приходится комбинировать различные препараты с тем, чтобы ударной дозой погубить микробы в организме. А для иммунной системы такой объём лекарств не так уж безвреден. Еще древние целители говорили, что всякое лекарство в большой дозе является ядом. И антибиотики — не исключение.
Инфекционные болезни и эпидемиология / Покровский В.И., Пак С.Г., Брико Н.И., Данилкин Б.К. – 2007
Вирус Т-клеточного лейкоза человека (HTLV-1) у серонегативных пациентов с лимфомами кожи, классическим лейкозом и бессимптомных носителей в россии / Сырцев А.В., Бавыкин А.С., Огородникова Е.В., Когай Б.И., Трофимов Д.Ю., Сергеев И.В., Николаева Е.В., Лезвинская Е.М., Чуев Ю.В., Сенюта Н.Б., Сельчук В.Ю., Эллерброк Н., Паули Г., Морозов В.А. // Молекулярная медицина – 2009 – №6
This article is a non-technical introduction to the subject. For the main encyclopedia article, see Virus.
A virus is a tiny infectious agent that reproduces inside the cells of living hosts. When infected, the host cell is forced to rapidly produce thousands of identical copies of the original virus. Unlike most living things, viruses do not have cells that divide; new viruses assemble in the infected host cell. But unlike simpler infectious agents like prions, they contain genes, which allow them to mutate and evolve. Over 4,800 species of viruses have been described in detail[1] out of the millions in the environment. Their origin is unclear: some may have evolved from plasmids—pieces of DNA that can move between cells—while others may have evolved from bacteria.
Viruses are made of either two or three parts. All include genes. These genes contain the encoded biological information of the virus and are built from either DNA or RNA. All viruses are also covered with a protein coat to protect the genes. Some viruses may also have an envelope of fat-like substance that covers the protein coat, and makes them vulnerable to soap. A virus with this «viral envelope» uses it—along with specific receptors—to enter a new host cell. Viruses vary in shape from the simple helical and icosahedral to more complex structures. Viruses range in size from 20 to 300 nanometres; it would take 33,000 to 500,000 of them, side by side, to stretch to 1 centimetre (0.4 in).
Viruses spread in many ways. Although many are very specific about which host species or tissue they attack, each species of virus relies on a particular method to copy itself. Plant viruses are often spread from plant to plant by insects and other organisms, known as vectors. Some viruses of humans and other animals are spread by exposure to infected bodily fluids. Viruses such as influenza are spread through the air by droplets of moisture when people cough or sneeze. Viruses such as norovirus are transmitted by the faecal–oral route, which involves the contamination of hands, food and water. Rotavirus is often spread by direct contact with infected children. The human immunodeficiency virus, HIV, is transmitted by bodily fluids transferred during sex. Others, such as the dengue virus, are spread by blood-sucking insects.
Viruses, especially those made of RNA, can mutate rapidly to give rise to new types. Hosts may have little protection against such new forms. Influenza virus, for example, changes often, so a new vaccine is needed each year. Major changes can cause pandemics, as in the 2009 swine influenza that spread to most countries. Often, these mutations take place when the virus has first infected other animal hosts. Some examples of such «zoonotic» diseases include coronavirus in bats, and influenza in pigs and birds, before those viruses were transferred to humans.
Viral infections can cause disease in humans, animals and plants. In healthy humans and animals, infections are usually eliminated by the immune system, which can provide lifetime immunity to the host for that virus. Antibiotics, which work against bacteria, have no impact, but antiviral drugs can treat life-threatening infections. Those vaccines that produce lifelong immunity can prevent some infections.
Discovery[edit]
In 1884, French microbiologist Charles Chamberland invented the Chamberland filter (or Chamberland–Pasteur filter), that contains pores smaller than bacteria. He could then pass a solution containing bacteria through the filter, and completely remove them. In the early 1890s, Russian biologist Dmitri Ivanovsky used this method to study what became known as the tobacco mosaic virus. His experiments showed that extracts from the crushed leaves of infected tobacco plants remain infectious after filtration.[2]
At the same time, several other scientists showed that, although these agents (later called viruses) were different from bacteria and about one hundred times smaller, they could still cause disease. In 1899, Dutch microbiologist Martinus Beijerinck observed that the agent only multiplied when in dividing cells. He called it a «contagious living fluid» (Latin: contagium vivum fluidum)—or a «soluble living germ» because he could not find any germ-like particles.[3] In the early 20th century, English bacteriologist Frederick Twort discovered viruses that infect bacteria,[4] and French-Canadian microbiologist Félix d’Herelle described viruses that, when added to bacteria growing on agar, would lead to the formation of whole areas of dead bacteria. Counting these dead areas allowed him to calculate the number of viruses in the suspension.[5]
The invention of the electron microscope in 1931 brought the first images of viruses.[6] In 1935, American biochemist and virologist Wendell Meredith Stanley examined the tobacco mosaic virus (TMV) and found it to be mainly made from protein.[7] A short time later, this virus was shown to be made from protein and RNA.[8] Rosalind Franklin developed X-ray crystallographic pictures and determined the full structure of TMV in 1955.[9] Franklin confirmed that viral proteins formed a spiral hollow tube, wrapped by RNA, and also showed that viral RNA was a single strand, not a double helix like DNA.[10]
A problem for early scientists was that they did not know how to grow viruses without using live animals. The breakthrough came in 1931, when American pathologists Ernest William Goodpasture and Alice Miles Woodruff grew influenza, and several other viruses, in fertilised chickens’ eggs.[11] Some viruses could not be grown in chickens’ eggs. This problem was solved in 1949, when John Franklin Enders, Thomas Huckle Weller, and Frederick Chapman Robbins grew polio virus in cultures of living animal cells.[12] Over 4,800 species of viruses have been described in detail.[1]
Origins[edit]
Viruses co-exist with life wherever it occurs. They have probably existed since living cells first evolved. Their origin remains unclear because they do not fossilize, so molecular techniques have been the best way to hypothesise about how they arose. These techniques rely on the availability of ancient viral DNA or RNA, but most viruses that have been preserved and stored in laboratories are less than 90 years old.[13][14] Molecular methods have only been successful in tracing the ancestry of viruses that evolved in the 20th century.[15] New groups of viruses might have repeatedly emerged at all stages of the evolution of life.[16] There are three major theories about the origins of viruses:[16][17]
- Regressive theory
- Viruses may have once been small cells that parasitised larger cells. Eventually, the genes they no longer needed for a parasitic way of life were lost. The bacteria Rickettsia and Chlamydia are living cells that, like viruses, can reproduce only inside host cells. This lends credence to this theory, as their dependence on being parasites may have led to the loss of the genes that once allowed them to live on their own.[18]
- Cellular origin theory
- Some viruses may have evolved from bits of DNA or RNA that «escaped» from the genes of a larger organism. The escaped DNA could have come from plasmids—pieces of DNA that can move between cells—while others may have evolved from bacteria.[19]
- Coevolution theory
- Viruses may have evolved from complex molecules of protein and DNA at the same time as cells first appeared on earth, and would have depended on cellular life for many millions of years.[20]
There are problems with all of these theories. The regressive hypothesis does not explain why even the smallest of cellular parasites do not resemble viruses in any way. The escape or the cellular origin hypothesis does not explain the presence of unique structures in viruses that do not appear in cells. The coevolution, or «virus-first» hypothesis, conflicts with the definition of viruses, because viruses depend on host cells.[20][21] Also, viruses are recognised as ancient, and to have origins that pre-date the divergence of life into the three domains.[22] This discovery has led modern virologists to reconsider and re-evaluate these three classical hypotheses.[16][22]
Structure[edit]
Simplified diagram of the structure of a virus
A virus particle, also called a virion, consists of genes made from DNA or RNA which are surrounded by a protective coat of protein called a capsid.[23] The capsid is made of many smaller, identical protein molecules called capsomers. The arrangement of the capsomers can either be icosahedral (20-sided), helical, or more complex. There is an inner shell around the DNA or RNA called the nucleocapsid, made out of proteins. Some viruses are surrounded by a bubble of lipid (fat) called an envelope, which makes them vulnerable to soap and alcohol.[24]
Size[edit]
Virions of some of the most common human viruses with their relative size. The nucleic acids are not to scale.
Viruses are among the smallest infectious agents, and are too small to be seen by light microscopy; most of them can only be seen by electron microscopy. Their sizes range from 20 to 300 nanometres; it would take 30,000 to 500,000 of them, side by side, to stretch to one centimetre (0.4 in).[23] In comparison, bacteria are typically around 1000 nanometres (1 micrometer) in diameter, and host cells of higher organisms are typically a few tens of micrometers. Some viruses such as megaviruses and pandoraviruses are relatively large viruses. At around 1000 nanometres, these viruses, which infect amoebae, were discovered in 2003 and 2013.[25][26] They are around ten times wider (and thus a thousand times larger in volume) than influenza viruses, and the discovery of these «giant» viruses astonished scientists.[27]
Genes[edit]
The genes of viruses are made from DNA (deoxyribonucleic acid) and, in many viruses, RNA (ribonucleic acid). The biological information contained in an organism is encoded in its DNA or RNA. Most organisms use DNA, but many viruses have RNA as their genetic material. The DNA or RNA of viruses consists of either a single strand or a double helix.[28]
Viruses can reproduce rapidly because they have relatively few genes. For example, influenza virus has only eight genes and rotavirus has eleven. In comparison, humans have 20,000–25,000. Some viral genes contain the code to make the structural proteins that form the virus particle. Other genes make non-structural proteins found only in the cells the virus infects.[29][30]
All cells, and many viruses, produce proteins that are enzymes that drive chemical reactions. Some of these enzymes, called DNA polymerase and RNA polymerase, make new copies of DNA and RNA. A virus’s polymerase enzymes are often much more efficient at making DNA and RNA than the equivalent enzymes of the host cells,[31] but viral RNA polymerase enzymes are error-prone, causing RNA viruses to mutate and form new strains.[32]
In some species of RNA virus, the genes are not on a continuous molecule of RNA, but are separated. The influenza virus, for example, has eight separate genes made of RNA. When two different strains of influenza virus infect the same cell, these genes can mix and produce new strains of the virus in a process called reassortment.[33]
Protein synthesis[edit]
Proteins are essential to life. Cells produce new protein molecules from amino acid building blocks based on information coded in DNA. Each type of protein is a specialist that usually only performs one function, so if a cell needs to do something new, it must make a new protein. Viruses force the cell to make new proteins that the cell does not need, but are needed for the virus to reproduce. Protein synthesis consists of two major steps: transcription and translation.[34]
Transcription is the process where information in DNA, called the genetic code, is used to produce RNA copies called messenger RNA (mRNA). These migrate through the cell and carry the code to ribosomes where it is used to make proteins. This is called translation because the protein’s amino acid structure is determined by the mRNA’s code. Information is hence translated from the language of nucleic acids to the language of amino acids.[34]
Some nucleic acids of RNA viruses function directly as mRNA without further modification. For this reason, these viruses are called positive-sense RNA viruses.[35] In other RNA viruses, the RNA is a complementary copy of mRNA and these viruses rely on the cell’s or their own enzyme to make mRNA. These are called negative-sense RNA viruses. In viruses made from DNA, the method of mRNA production is similar to that of the cell. The species of viruses called retroviruses behave completely differently: they have RNA, but inside the host cell a DNA copy of their RNA is made with the help of the enzyme reverse transcriptase. This DNA is then incorporated into the host’s own DNA, and copied into mRNA by the cell’s normal pathways.[36]
Life-cycle[edit]
Life-cycle of a typical virus (left to right); following infection of a cell by a single virus, hundreds of offspring are released.
When a virus infects a cell, the virus forces it to make thousands more viruses. It does this by making the cell copy the virus’s DNA or RNA, making viral proteins, which all assemble to form new virus particles.[37]
There are six basic, overlapping stages in the life cycle of viruses in living cells:[38]
- Attachment is the binding of the virus to specific molecules on the surface of the cell. This specificity restricts the virus to a very limited type of cell. For example, the human immunodeficiency virus (HIV) infects only human T cells, because its surface protein, gp120, can only react with CD4 and other molecules on the T cell’s surface. Plant viruses can only attach to plant cells and cannot infect animals. This mechanism has evolved to favour those viruses that only infect cells in which they are capable of reproducing.
- Penetration follows attachment; viruses penetrate the host cell by endocytosis or by fusion with the cell.
- Uncoating happens inside the cell when the viral capsid is removed and destroyed by viral enzymes or host enzymes, thereby exposing the viral nucleic acid.
- Replication of virus particles is the stage where a cell uses viral messenger RNA in its protein synthesis systems to produce viral proteins. The RNA or DNA synthesis abilities of the cell produce the virus’s DNA or RNA.
- Assembly takes place in the cell when the newly created viral proteins and nucleic acid combine to form hundreds of new virus particles.
- Release occurs when the new viruses escape or are released from the cell. Most viruses achieve this by making the cells burst, a process called lysis. Other viruses such as HIV are released more gently by a process called budding.
Effects on the host cell[edit]
Viruses have an extensive range of structural and biochemical effects on the host cell.[39]These are called cytopathic effects.[40] Most virus infections eventually result in the death of the host cell. The causes of death include cell lysis (bursting), alterations to the cell’s surface membrane and apoptosis (cell «suicide»).[41] Often cell death is caused by cessation of its normal activity due to proteins produced by the virus, not all of which are components of the virus particle.[42]
Some viruses cause no apparent changes to the infected cell. Cells in which the virus is latent (inactive) show few signs of infection and often function normally.[43] This causes persistent infections and the virus is often dormant for many months or years. This is often the case with herpes viruses.[44][45]
Some viruses, such as Epstein–Barr virus, often cause cells to proliferate without causing malignancy;[46] but some other viruses, such as papillomavirus, are an established cause of cancer.[47] When a cell’s DNA is damaged by a virus such that the cell cannot repair itself, this often triggers apoptosis. One of the results of apoptosis is destruction of the damaged DNA by the cell itself. Some viruses have mechanisms to limit apoptosis so that the host cell does not die before progeny viruses have been produced; HIV, for example, does this.[48]
Viruses and diseases[edit]
There are many ways in which viruses spread from host to host but each species of virus uses only one or two. Many viruses that infect plants are carried by organisms; such organisms are called vectors. Some viruses that infect animals, including humans, are also spread by vectors, usually blood-sucking insects, but direct transmission is more common. Some virus infections, such as norovirus and rotavirus, are spread by contaminated food and water, by hands and communal objects, and by intimate contact with another infected person, while others like SARS-CoV-2 and influenza viruses are airborne. Viruses such as HIV, hepatitis B and hepatitis C are often transmitted by unprotected sex or contaminated hypodermic needles. To prevent infections and epidemics, it is important to know how each different kind of virus is spread.[49]
In humans[edit]
Common human diseases caused by viruses include the common cold, influenza, chickenpox and cold sores. Serious diseases such as Ebola and AIDS are also caused by viruses.[50] Many viruses cause little or no disease and are said to be «benign». The more harmful viruses are described as virulent.[51]
Viruses cause different diseases depending on the types of cell that they infect.
Some viruses can cause lifelong or chronic infections where the viruses continue to reproduce in the body despite the host’s defence mechanisms.[52] This is common in hepatitis B virus and hepatitis C virus infections. People chronically infected with a virus are known as carriers. They serve as important reservoirs of the virus.[53][54]
Endemic[edit]
If the proportion of carriers in a given population reaches a given threshold, a disease is said to be endemic.[55] Before the advent of vaccination, infections with viruses were common and outbreaks occurred regularly. In countries with a temperate climate, viral diseases are usually seasonal. Poliomyelitis, caused by poliovirus often occurred in the summer months.[56] By contrast colds, influenza and rotavirus infections are usually a problem during the winter months.[57][58] Other viruses, such as measles virus, caused outbreaks regularly every third year.[59] In developing countries, viruses that cause respiratory and enteric infections are common throughout the year. Viruses carried by insects are a common cause of diseases in these settings. Zika and dengue viruses for example are transmitted by the female Aedes mosquitoes, which bite humans particularly during the mosquitoes’ breeding season.[60]
Pandemic and emergent[edit]
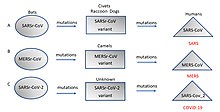
Origin and evolution of (A) SARS-CoV (B) MERS-CoV, and (C) SARS-CoV-2 in different hosts. All the viruses came from bats as coronavirus-related viruses before mutating and adapting to intermediate hosts and then to humans and causing the diseases SARS, MERS and COVID-19.(Adapted from Ashour et al. (2020) [61])
Although viral pandemics are rare events, HIV—which evolved from viruses found in monkeys and chimpanzees—has been pandemic since at least the 1980s.[62] During the 20th century there were four pandemics caused by influenza virus and those that occurred in 1918, 1957 and 1968 were severe.[63] Before its eradication, smallpox was a cause of pandemics for more than 3,000 years.[64] Throughout history, human migration has aided the spread of pandemic infections; first by sea and in modern times also by air.[65]
With the exception of smallpox, most pandemics are caused by newly evolved viruses. These «emergent» viruses are usually mutants of less harmful viruses that have circulated previously either in humans or in other animals.[66]
Severe acute respiratory syndrome (SARS) and Middle East respiratory syndrome (MERS) are caused by new types of coronaviruses. Other coronaviruses are known to cause mild infections in humans,[67] so the virulence and rapid spread of SARS infections—that by July 2003 had caused around 8,000 cases and 800 deaths—was unexpected and most countries were not prepared.[68]
A related coronavirus emerged in Wuhan, China, in November 2019 and spread rapidly around the world. Thought to have originated in bats and subsequently named severe acute respiratory syndrome coronavirus 2, infections with the virus cause a disease called COVID-19, that varies in severity from mild to deadly,[69] and led to a pandemic in 2020.[61][70][71] Restrictions unprecedented in peacetime were placed on international travel,[72] and curfews imposed in several major cities worldwide.[73]
In plants[edit]
Peppers infected by mild mottle virus
There are many types of plant virus, but often they only cause a decrease in yield, and it is not economically viable to try to control them. Plant viruses are frequently spread from plant to plant by organisms called «vectors». These are normally insects, but some fungi, nematode worms and single-celled organisms have also been shown to be vectors. When control of plant virus infections is considered economical (perennial fruits, for example) efforts are concentrated on killing the vectors and removing alternate hosts such as weeds.[74] Plant viruses are harmless to humans and other animals because they can only reproduce in living plant cells.[75]
Bacteriophages[edit]
The structure of a typical bacteriophage
Bacteriophages are viruses that infect bacteria and archaea.[76] They are important in marine ecology: as the infected bacteria burst, carbon compounds are released back into the environment, which stimulates fresh organic growth. Bacteriophages are useful in scientific research because they are harmless to humans and can be studied easily. These viruses can be a problem in industries that produce food and drugs by fermentation and depend on healthy bacteria. Some bacterial infections are becoming difficult to control with antibiotics, so there is a growing interest in the use of bacteriophages to treat infections in humans.[77]
Host resistance[edit]
Innate immunity of animals[edit]
Animals, including humans, have many natural defences against viruses. Some are non-specific and protect against many viruses regardless of the type. This innate immunity is not improved by repeated exposure to viruses and does not retain a «memory» of the infection. The skin of animals, particularly its surface, which is made from dead cells, prevents many types of viruses from infecting the host. The acidity of the contents of the stomach destroys many viruses that have been swallowed. When a virus overcomes these barriers and enters the host, other innate defences prevent the spread of infection in the body. A special hormone called interferon is produced by the body when viruses are present, and this stops the viruses from reproducing by killing the infected cells and their close neighbours. Inside cells, there are enzymes that destroy the RNA of viruses. This is called RNA interference. Some blood cells engulf and destroy other virus-infected cells.[78]
Adaptive immunity of animals[edit]
Two rotavirus particles: the one on the right is coated with antibodies which stop its attaching to cells and infecting them
Specific immunity to viruses develops over time and white blood cells called lymphocytes play a central role. Lymphocytes retain a «memory» of virus infections and produce many special molecules called antibodies. These antibodies attach to viruses and stop the virus from infecting cells. Antibodies are highly selective and attack only one type of virus. The body makes many different antibodies, especially during the initial infection. After the infection subsides, some antibodies remain and continue to be produced, usually giving the host lifelong immunity to the virus.[79]
Plant resistance[edit]
Plants have elaborate and effective defence mechanisms against viruses. One of the most effective is the presence of so-called resistance (R) genes. Each R gene confers resistance to a particular virus by triggering localised areas of cell death around the infected cell, which can often be seen with the unaided eye as large spots. This stops the infection from spreading.[80] RNA interference is also an effective defence in plants.[81] When they are infected, plants often produce natural disinfectants that destroy viruses, such as salicylic acid, nitric oxide and reactive oxygen molecules.[82]
Resistance to bacteriophages[edit]
The major way bacteria defend themselves from bacteriophages is by producing enzymes which destroy foreign DNA. These enzymes, called restriction endonucleases, cut up the viral DNA that bacteriophages inject into bacterial cells.[83]
Prevention and treatment of viral disease[edit]
Vaccines[edit]
The structure of DNA showing the position of the nucleosides and the phosphorus atoms that form the «backbone» of the molecule
Vaccines simulate a natural infection and its associated immune response, but do not cause the disease. Their use has resulted in the eradication of smallpox and a dramatic decline in illness and death caused by infections such as polio, measles, mumps and rubella.[84] Vaccines are available to prevent over fourteen viral infections of humans[85] and more are used to prevent viral infections of animals.[86] Vaccines may consist of either live or killed viruses.[87] Live vaccines contain weakened forms of the virus, but these vaccines can be dangerous when given to people with weak immunity. In these people, the weakened virus can cause the original disease.[88] Biotechnology and genetic engineering techniques are used to produce «designer» vaccines that only have the capsid proteins of the virus. Hepatitis B vaccine is an example of this type of vaccine.[89] These vaccines are safer because they can never cause the disease.[87]
Antiviral drugs[edit]
The structure of the DNA base guanosine and the antiviral drug aciclovir which functions by mimicking it
Since the mid-1980s, the development of antiviral drugs has increased rapidly, mainly driven by the AIDS pandemic. Antiviral drugs are often nucleoside analogues, which masquerade as DNA building blocks (nucleosides). When the replication of virus DNA begins, some of the fake building blocks are used. This prevents DNA replication because the drugs lack the essential features that allow the formation of a DNA chain. When DNA production stops the virus can no longer reproduce.[90] Examples of nucleoside analogues are aciclovir for herpes virus infections and lamivudine for HIV and hepatitis B virus infections. Aciclovir is one of the oldest and most frequently prescribed antiviral drugs.[91]
Other antiviral drugs target different stages of the viral life cycle. HIV is dependent on an enzyme called the HIV-1 protease for the virus to become infectious. There is a class of drugs called protease inhibitors, which bind to this enzyme and stop it from functioning.[92]
Hepatitis C is caused by an RNA virus. In 80% of those infected, the disease becomes chronic, and they remain infectious for the rest of their lives unless they are treated. There are effective treatments that use direct-acting antivirals.[93] Treatments for chronic carriers of the hepatitis B virus have been developed by a similar strategy, using lamivudine and other anti-viral drugs. In both diseases, the drugs stop the virus from reproducing and the interferon kills any remaining infected cells.[94]
HIV infections are usually treated with a combination of antiviral drugs, each targeting a different stage in the virus’s life cycle. There are drugs that prevent the virus from attaching to cells, others that are nucleoside analogues and some poison the virus’s enzymes that it needs to reproduce. The success of these drugs is proof of the importance of knowing how viruses reproduce.[92]
Role in ecology[edit]
Viruses are the most abundant biological entity in aquatic environments;[95] one teaspoon of seawater contains about ten million viruses,[96] and they are essential to the regulation of saltwater and freshwater ecosystems.[97] Most are bacteriophages,[98] which are harmless to plants and animals. They infect and destroy the bacteria in aquatic microbial communities and this is the most important mechanism of recycling carbon in the marine environment. The organic molecules released from the bacterial cells by the viruses stimulate fresh bacterial and algal growth.[99]
Microorganisms constitute more than 90% of the biomass in the sea. It is estimated that viruses kill approximately 20% of this biomass each day and that there are fifteen times as many viruses in the oceans as there are bacteria and archaea. They are mainly responsible for the rapid destruction of harmful algal blooms,[100] which often kill other marine life.[101]
The number of viruses in the oceans decreases further offshore and deeper into the water, where there are fewer host organisms.[102]
Their effects are far-reaching; by increasing the amount of respiration in the oceans, viruses are indirectly responsible for reducing the amount of carbon dioxide in the atmosphere by approximately 3 gigatonnes of carbon per year.[102]
Marine mammals are also susceptible to viral infections. In 1988 and 2002, thousands of harbour seals were killed in Europe by phocine distemper virus.[103] Many other viruses, including caliciviruses, herpesviruses, adenoviruses and parvoviruses, circulate in marine mammal populations.[102]
Viruses can also serve as an alternative food source for microorganisms which engage in virovory, supplying nucleic acids, nitrogen, and phosphorus through their consumption.[104][105]
See also[edit]
References[edit]
Notes[edit]
- ^ a b King AM, Lefkowitz EJ, Mushegian AR, Adams MJ, Dutilh BE, Gorbalenya AE, Harrach B, Harrison RL, Junglen S, Knowles NJ, Kropinski AM, Krupovic M, Kuhn JH, Nibert ML, Rubino L, Sabanadzovic S, Sanfaçon H, Siddell SG, Simmonds P, Varsani A, Zerbini FM, Davison AJ (September 2018). «Changes to taxonomy and the International Code of Virus Classification and Nomenclature ratified by the International Committee Taxonomy of Viruses (2018)» (PDF). Archives of Virology. 163 (9): 2601. doi:10.1007/s00705-018-3847-1. PMID 29754305. S2CID 21670772.
- ^ Shors 2017, p. 6
- ^ Collier, Balows & Sussman 1998, p. 3
- ^ Shors 2017, p. 827
- ^ D’Herelle F (2007). «On an invisible microbe antagonistic toward dysenteric bacilli: brief note by Mr. F. D’Herelle, presented by Mr. Roux. 1917». Research in Microbiology. 158 (7): 553–554. doi:10.1016/j.resmic.2007.07.005. PMID 17855060.
- ^ From Nobel Lectures, Physics 1981–1990, (1993) Editor-in-Charge Tore Frängsmyr, Editor Gösta Ekspång, World Scientific Publishing Co., Singapore
- ^ Stanley WM, Loring HS (1936). «The isolation of crystalline tobacco mosaic virus protein from diseased tomato plants». Science. 83 (2143): 85. Bibcode:1936Sci….83…85S. doi:10.1126/science.83.2143.85. PMID 17756690.
- ^ Stanley WM, Lauffer MA (1939). «Disintegration of tobacco mosaic virus in urea solutions». Science. 89 (2311): 345–347. Bibcode:1939Sci….89..345S. doi:10.1126/science.89.2311.345. PMID 17788438.
- ^ Creager AN, Morgan GJ (June 2008). «After the double helix: Rosalind Franklin’s research on Tobacco mosaic virus». Isis; an International Review Devoted to the History of Science and Its Cultural Influences. 99 (2): 239–272. doi:10.1086/588626. PMID 18702397. S2CID 25741967.
- ^ Johnson, Ben (25 July 2017). «Rosalind Franklin’s contributions to virology». Nature Portfolio Microbiology Community. Retrieved 7 January 2022.
- ^ Goodpasture EW, Woodruff AM, Buddingh GJ (October 1931). «The Cultivation Of Vaccine and other Viruses In The Chorioallantoic Membrane of Chick Embryos». Science. 74 (1919): 371–372. Bibcode:1931Sci….74..371G. doi:10.1126/science.74.1919.371. PMID 17810781.
- ^ Rosen FS (October 2004). «Isolation of poliovirus – John Enders and the Nobel Prize». N. Engl. J. Med. 351 (15): 1481–1483. doi:10.1056/NEJMp048202. PMID 15470207.
- ^ Shors 2017, p. 16
- ^ Collier, Balows & Sussman 1998, pp. 18–19
- ^ Liu Y, Nickle DC, Shriner D, Jensen MA, Learn GH, Mittler JE, Mullins JI (November 2004). «Molecular clock-like evolution of human immunodeficiency virus type 1». Virology. 329 (1): 101–108. doi:10.1016/j.virol.2004.08.014. PMID 15476878.
- ^ a b c Krupovic M, Dooja W, Koonin EV (2019). «Origin of viruses: primordial replicators recruiting capsids from hosts» (PDF). Nature Reviews Microbiology. 17 (7): 449–458. doi:10.1038/s41579-019-0205-6. PMID 31142823. S2CID 169035711.
- ^ Collier, Balows & Sussman 1998, pp. 11–21
- ^ Collier, Balows & Sussman 1998, p. 11
- ^ Collier, Balows & Sussman 1998, pp. 11–12
- ^ a b Wessner DR (2010). «The Origins of Viruses». Nature Education. 3 (9): 37.
- ^ Nasir A, Kim KM, Caetano-Anollés G (2012). «Viral evolution: Primordial cellular origins and late adaptation to parasitism». Mobile Genetic Elements. 2 (5): 247–252. doi:10.4161/mge.22797. PMC 3575434. PMID 23550145.
- ^ a b Mahy WJ, Van Regenmortel MH (2009). Desk Encyclopedia of General Virology. Oxford: Academic Press. p. 28. ISBN 978-0-12-375146-1.
- ^ a b Collier, Balows & Sussman 1998, pp. 33–55
- ^ Rotter ML (August 2001). «Arguments for alcoholic hand disinfection». The Journal of Hospital Infection. 48 (Suppl A): S4–S8. doi:10.1016/s0195-6701(01)90004-0. PMID 11759024.
- ^ Abergel C, Legendre M, Claverie JM (November 2015). «The rapidly expanding universe of giant viruses: Mimivirus, Pandoravirus, Pithovirus and Mollivirus». FEMS Microbiol. Rev. 39 (6): 779–796. doi:10.1093/femsre/fuv037. PMID 26391910.
- ^ Philippe N, Legendre M, Doutre G, Couté Y, Poirot O, Lescot M, Arslan D, Seltzer V, Bertaux L, Bruley C, Garin J, Claverie JM, Abergel C (July 2013). «Pandoraviruses: amoeba viruses with genomes up to 2.5 Mb reaching that of parasitic eukaryotes» (PDF). Science. 341 (6143): 281–286. Bibcode:2013Sci…341..281P. doi:10.1126/science.1239181. PMID 23869018. S2CID 16877147.
- ^ Zimmer C (18 July 2013). «Changing View on Viruses: Not So Small After All». The New York Times. Retrieved 20 December 2014.
- ^ Shors 2017, p. 81
- ^ Shors 2017, p. 129
- ^ International Human, Genome Sequencing Consortium (2004). «Finishing the euchromatic sequence of the human genome». Nature. 431 (7011): 931–945. Bibcode:2004Natur.431..931H. doi:10.1038/nature03001. PMID 15496913. S2CID 186242248.
- ^ Shors 2017, pp. 129–31
- ^ Shors 2017, p. 652
- ^ Shors 2017, p. 654
- ^ a b de Klerk E, ‘t Hoen PA (March 2015). «Alternative mRNA transcription, processing, and translation: insights from RNA sequencing». Trends in Genetics. 31 (3): 128–139. doi:10.1016/j.tig.2015.01.001. PMID 25648499.
- ^ Collier, Balows & Sussman 1998, pp. 75–82
- ^ Shors 2017, p. 698
- ^ Shors 2017, pp. 6–13
- ^ Shors 2017, pp. 121–123
- ^ Oxford, Kellam & Collier 2016, p. 34–36.
- ^ Oxford, Kellam & Collier 2016, p. 34.
- ^ Okamoto T, Suzuki T, Kusakabe S, Tokunaga M, Hirano J, Miyata Y, Matsuura Y (2017). «Regulation of Apoptosis during Flavivirus Infection». Viruses. 9 (9): 243. doi:10.3390/v9090243. PMC 5618009. PMID 28846635.
- ^ Alwine JC (2008). «Modulation of host cell stress responses by human cytomegalovirus». Human Cytomegalovirus. Curr. Top. Microbiol. Immunol. Current Topics in Microbiology and Immunology. Vol. 325. pp. 263–279. doi:10.1007/978-3-540-77349-8_15. ISBN 978-3-540-77348-1. PMID 18637511.
- ^ Sinclair J (March 2008). «Human cytomegalovirus: Latency and reactivation in the myeloid lineage». J. Clin. Virol. 41 (3): 180–185. doi:10.1016/j.jcv.2007.11.014. PMID 18164651.
- ^ Jordan MC, Jordan GW, Stevens JG, Miller G (June 1984). «Latent herpesviruses of humans». Ann. Intern. Med. 100 (6): 866–880. doi:10.7326/0003-4819-100-6-866. PMID 6326635.
- ^ Sissons JG, Bain M, Wills MR (February 2002). «Latency and reactivation of human cytomegalovirus». J. Infect. 44 (2): 73–77. doi:10.1053/jinf.2001.0948. PMID 12076064. S2CID 24879226.
- ^ Barozzi P, Potenza L, Riva G, Vallerini D, Quadrelli C, Bosco R, Forghieri F, Torelli G, Luppi M (December 2007). «B cells and herpesviruses: a model of lymphoproliferation». Autoimmun Rev. 7 (2): 132–136. doi:10.1016/j.autrev.2007.02.018. PMID 18035323.
- ^ Graham SV (2017). «The human papillomavirus replication cycle, and its links to cancer progression: a comprehensive review». Clinical Science. 131 (17): 2201–2221. doi:10.1042/CS20160786. PMID 28798073.
- ^ Roulston A, Marcellus RC, Branton PE (1999). «Viruses and apoptosis». Annu. Rev. Microbiol. 53: 577–628. doi:10.1146/annurev.micro.53.1.577. PMID 10547702.
- ^ Shors 2017, p. 32
- ^ Shors 2017, p. 271
- ^ Berngruber TW, Froissart R, Choisy M, Gandon S (2013). «Evolution of Virulence in Emerging Epidemics». PLOS Pathogens. 9 (3): e1003209. doi:10.1371/journal.ppat.1003209. PMC 3597519. PMID 23516359.
- ^ Shors 2017, p. 464
- ^ Tanaka J, Akita T, Ko K, Miura Y, Satake M (September 2019). «Countermeasures against viral hepatitis B and C in Japan: An epidemiological point of view». Hepatology Research. 49 (9): 990–1002. doi:10.1111/hepr.13417. PMC 6852166. PMID 31364248.
- ^ Lai CC, Liu YH, Wang CY, Wang YH, Hsueh SC, Yen MY, Ko WC, Hsueh PR (March 2020). «Asymptomatic carrier state, acute respiratory disease, and pneumonia due to severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2): Facts and myths». Journal of Microbiology, Immunology, and Infection = Wei Mian Yu Gan Ran Za Zhi. 53 (3): 404–412. doi:10.1016/j.jmii.2020.02.012. PMC 7128959. PMID 32173241.
- ^ Oxford, Kellam & Collier 2016, p. 63.
- ^ Strand LK (July 2018). «The Terrible Summer of 1952 … When Polio Struck Our Family». Seminars in Pediatric Neurology. 26: 39–44. doi:10.1016/j.spen.2017.04.001. PMID 29961515. S2CID 49640682.
- ^ Moorthy M, Castronovo D, Abraham A, Bhattacharyya S, Gradus S, Gorski J, Naumov YN, Fefferman NH, Naumova EN (October 2012). «Deviations in influenza seasonality: odd coincidence or obscure consequence?». Clinical Microbiology and Infection. 18 (10): 955–962. doi:10.1111/j.1469-0691.2012.03959.x. PMC 3442949. PMID 22958213.
- ^ Barril PA, Fumian TM, Prez VE, Gil PI, Martínez LC, Giordano MO, Masachessi G, Isa MB, Ferreyra LJ, Ré VE, Miagostovich M, Pavan JV, Nates SV (April 2015). «Rotavirus seasonality in urban sewage from Argentina: effect of meteorological variables on the viral load and the genetic diversity». Environmental Research. 138: 409–415. Bibcode:2015ER….138..409B. doi:10.1016/j.envres.2015.03.004. PMID 25777068.
- ^ Durrheim DN, Crowcroft NS, Strebel PM (December 2014). «Measles – The epidemiology of elimination». Vaccine. 32 (51): 6880–6883. doi:10.1016/j.vaccine.2014.10.061. PMID 25444814.
- ^ Mbanzulu KM, Mboera LE, Luzolo FK, Wumba R, Misinzo G, Kimera SI (February 2020). «Mosquito-borne viral diseases in the Democratic Republic of the Congo: a review». Parasites & Vectors. 13 (1): 103. doi:10.1186/s13071-020-3985-7. PMC 7045448. PMID 32103776.
- ^ a b Ashour HM, Elkhatib WF, Rahman MM, Elshabrawy HA (March 2020). «Insights into the Recent 2019 Novel Coronavirus (SARS-CoV-2) in Light of Past Human Coronavirus Outbreaks». Pathogens (Basel, Switzerland). 9 (3): 186. doi:10.3390/pathogens9030186. PMC 7157630. PMID 32143502.
- ^ Eisinger RW, Fauci AS (March 2018). «Ending the HIV/AIDS Pandemic1». Emerging Infectious Diseases. 24 (3): 413–416. doi:10.3201/eid2403.171797. PMC 5823353. PMID 29460740.
- ^ Qin Y, Zhao MJ, Tan YY, Li XQ, Zheng JD, Peng ZB, Feng LZ (August 2018). «[History of influenza pandemics in China during the past century]». Zhonghua Liu Xing Bing Xue Za Zhi = Zhonghua Liuxingbingxue Zazhi (in Chinese). 39 (8): 1028–1031. doi:10.3760/cma.j.issn.0254-6450.2018.08.003. PMID 30180422.
- ^ Nishiyama Y, Matsukuma S, Matsumura T, Kanatani Y, Saito T (April 2015). «Preparedness for a smallpox pandemic in Japan: public health perspectives». Disaster Medicine and Public Health Preparedness. 9 (2): 220–223. doi:10.1017/dmp.2014.157. PMID 26060873. S2CID 37149836.
- ^ Houghton F (2019). «Geography, global pandemics & air travel: Faster, fuller, further & more frequent». Journal of Infection and Public Health. 12 (3): 448–449. doi:10.1016/j.jiph.2019.02.020. PMC 7129534. PMID 30878442.
- ^ «Virology Journal». Virology Journal.
- ^ Weiss SR, Leibowitz JL (2011). Coronavirus pathogenesis. Advances in Virus Research. Vol. 81. pp. 85–164. doi:10.1016/B978-0-12-385885-6.00009-2. ISBN 978-0-12-385885-6. PMC 7149603. PMID 22094080.
- ^ Wong AT, Chen H, Liu SH, Hsu EK, Luk KS, Lai CK, Chan RF, Tsang OT, Choi KW, Kwan YW, Tong AY, Cheng VC, Tsang DC (May 2017). «From SARS to Avian Influenza Preparedness in Hong Kong». Clinical Infectious Diseases. 64 (suppl_2): S98–S104. doi:10.1093/cid/cix123. PMID 28475794.
- ^ Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19) (PDF) (Report). World Health Organization (WHO). 16–24 February 2020. Retrieved 21 March 2020.
- ^ Deng SQ, Peng HJ (February 2020). «Characteristics of and Public Health Responses to the Coronavirus Disease 2019 Outbreak in China». Journal of Clinical Medicine. 9 (2): 575. doi:10.3390/jcm9020575. PMC 7074453. PMID 32093211.
- ^ Han Q, Lin Q, Jin S, You L (February 2020). «Coronavirus 2019-nCoV: A brief perspective from the front line». The Journal of Infection. 80 (4): 373–377. doi:10.1016/j.jinf.2020.02.010. PMC 7102581. PMID 32109444.
- ^ Londoño E, Ortiz A (16 March 2020). «Coronavirus Travel Restrictions, Across the Globe» – via NYTimes.com.
- ^ «US takes more big pandemic response steps; Europe COVID-19 cases soar». CIDRAP.
- ^ Shors 2017, p. 822
- ^ Shors 2017, pp. 802–803
- ^ Oxford, Kellam & Collier 2016, p. 19.
- ^ Shors 2017, p. 803
- ^ Shors 2017, pp. 116–117
- ^ Shors 2017, pp. 225–233
- ^ Garcia-Ruiz H (2018). «Susceptibility Genes to Plant Viruses». Viruses. 10 (9): 484. doi:10.3390/v10090484. PMC 6164914. PMID 30201857.
- ^ Shors 2017, p. 812
- ^ Soosaar JL, Burch-Smith TM, Dinesh-Kumar SP (2005). «Mechanisms of plant resistance to viruses». Nature Reviews Microbiology. 3 (10): 789–798. doi:10.1038/nrmicro1239. PMID 16132037. S2CID 27311732.
- ^ Horvath P, Barrangou R (January 2010). «CRISPR/Cas, the immune system of bacteria and archaea» (PDF). Science. 327 (5962): 167–170. Bibcode:2010Sci…327..167H. doi:10.1126/science.1179555. PMID 20056882. S2CID 17960960. Archived from the original (PDF) on 27 March 2020.
- ^ Shors 2017, pp. 237–255
- ^ Small JC, Ertl HC (2011). «Viruses – from pathogens to vaccine carriers». Current Opinion in Virology. 1 (4): 241–245. doi:10.1016/j.coviro.2011.07.009. PMC 3190199. PMID 22003377.
- ^ Burakova Y, Madera R, McVey S, Schlup JR, Shi J (2018). «Adjuvants for Animal Vaccines». Viral Immunology. 31 (1): 11–22. doi:10.1089/vim.2017.0049. PMID 28618246.
- ^ a b Shors 2017, p. 237
- ^ Thomssen R (1975). «Live attenuated versus killed virus vaccines». Monographs in Allergy. 9: 155–176. PMID 1090805.
- ^ Shors 2017, p. 238
- ^ Shors 2017, pp. 514–515
- ^ Shors 2017, p. 514
- ^ a b Shors 2017, p. 568
- ^ Falade-Nwulia O, Suarez-Cuervo C, Nelson DR, Fried MW, Segal JB, Sulkowski MS (May 2017). «Oral Direct-Acting Agent Therapy for Hepatitis C Virus Infection: A Systematic Review». Annals of Internal Medicine. 166 (9): 637–648. doi:10.7326/M16-2575. PMC 5486987. PMID 28319996.
- ^ Paul N, Han SH (June 2011). «Combination Therapy for Chronic Hepatitis B: Current Indications». Curr Hepat Rep. 10 (2): 98–105. doi:10.1007/s11901-011-0095-1. PMC 3085106. PMID 21654909.
- ^ Koonin EV, Senkevich TG, Dolja VV (September 2006). «The ancient Virus World and evolution of cells». Biol. Direct. 1: 29. doi:10.1186/1745-6150-1-29. PMC 1594570. PMID 16984643.
- ^ Dávila-Ramos S, Castelán-Sánchez HG, Martínez-Ávila L, Sánchez-Carbente MD, Peralta R, Hernández-Mendoza A, Dobson AD, Gonzalez RA, Pastor N, Batista-García RA (2019). «A Review on Viral Metagenomics in Extreme Environments». Frontiers in Microbiology. 10: 2403. doi:10.3389/fmicb.2019.02403. PMC 6842933. PMID 31749771.
- ^ Shors 2017, p. 5
- ^ Breitbart M, Bonnain C, Malki K, Sawaya NA (July 2018). «Phage puppet masters of the marine microbial realm». Nature Microbiology. 3 (7): 754–766. doi:10.1038/s41564-018-0166-y. PMID 29867096. S2CID 46927784.
- ^ Shors 2017, pp. 25–26
- ^ Suttle CA (September 2005). «Viruses in the sea». Nature. 437 (7057): 356–361. Bibcode:2005Natur.437..356S. doi:10.1038/nature04160. PMID 16163346. S2CID 4370363.
- ^ «Harmful Algal Blooms: Red Tide: Home | CDC HSB». www.cdc.gov. Retrieved 23 August 2009.
- ^ a b c Suttle CA (October 2007). «Marine viruses – major players in the global ecosystem». Nat. Rev. Microbiol. 5 (10): 801–812. doi:10.1038/nrmicro1750. PMID 17853907. S2CID 4658457.
- ^ Hall A, Jepson P, Goodman S, Harkonen T (2006). «Phocine distemper virus in the North and European Seas – Data and models, nature and nurture». Biological Conservation. 131 (2): 221–229. doi:10.1016/j.biocon.2006.04.008.
- ^ DeLong, John P.; Van Etten, James L.; Al-Ameeli, Zeina; Agarkova, Irina V.; Dunigan, David D. (3 January 2023). «The consumption of viruses returns energy to food chains». Proceedings of the National Academy of Sciences. 120 (1): e2215000120. doi:10.1073/pnas.2215000120. ISSN 0027-8424.
- ^ Irving, Michael (28 December 2022). «First «virovore» discovered: An organism that eats viruses». New Atlas. Archived from the original on 29 December 2022. Retrieved 29 December 2022.
Bibliography[edit]
- Collier L, Balows A, Sussman M, eds. (1998). Topley & Wilson’s Microbiology and Microbial Infections. Vol. 1, Virology (9th ed.). Arnold. ISBN 0-340-66316-2.
- Oxford, John; Kellam, Paul; Collier, Leslie (2016). Human Virology. Oxford: Oxford University Press. ISBN 978-0-19-871468-2. OCLC 968152575.
- Shors T (2017). Understanding Viruses. Jones and Bartlett Publishers. ISBN 978-1284025927.
External links[edit]
- Virus Pathogen Resource – Genomic and other research data about human pathogenic viruses
- Influenza Research Database – Genomic and other research data about influenza viruses