Атомно-молекулярное учение
Мы приступаем к изучению химии — мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными
формулами элементов.
Атом (греч. а — отриц. частица + tomos — отдел, греч. atomos — неделимый) — электронейтральная частица вещества микроскопических
размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos — первый) — положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов
элементов. Нейтрон (лат. neuter — ни тот, ни другой) — нейтральная (0) элементарная частица, присутствующая в ядрах всех
химических элементов, кроме водорода.
Электрон (греч. elektron — янтарь) — стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома —
порядковый номер в таблице Менделеева — равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20)
в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило:
порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим
электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
Состоит из s-подуровня: одной «1s» ячейки, в которой помещаются 2 электрона (заполненный электронами — 1s2)
Состоит из s-подуровня: одной «s» ячейки (2s2) и p-подуровня: трех «p» ячеек (2p6), на которых
помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s2), p-подуровня: трех «p» ячеек (3p6) и d-подуровня:
пяти «d» ячеек (3d10), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s2), p-подуровня: трех «p» ячеек (4p6), d-подуровня:
пяти «d» ячеек (4d10) и f-подуровня: семи «f» ячеек (4f14), на которых помещается 14
электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число
электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а
также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или
атомным орбиталям, движутся электроны, создавая определенный «рисунок».
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь — клеверный лист.

Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной «ячейке») не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются
еще одним электроном с противоположным направлением - Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было
бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и
серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода — 6, у серы — 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.

Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил.
А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся
одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод — 1s22s22p2
- Серы — 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне — это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда
для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод — 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью — способностью атомов образовывать определенное число химических связей.

- Углерод — 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных
электронов. Ниже будет дано наглядное объяснение этой задаче.

Запишем получившиеся электронные конфигурации магния и скандия:
- Магний — 1s22s22p63s2
- Скандий — 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением — провалом электрона, которое только подтверждает общее
правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более
низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим
две электронных конфигурации: первую «неправильную» (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную
с учетом провала электрона.
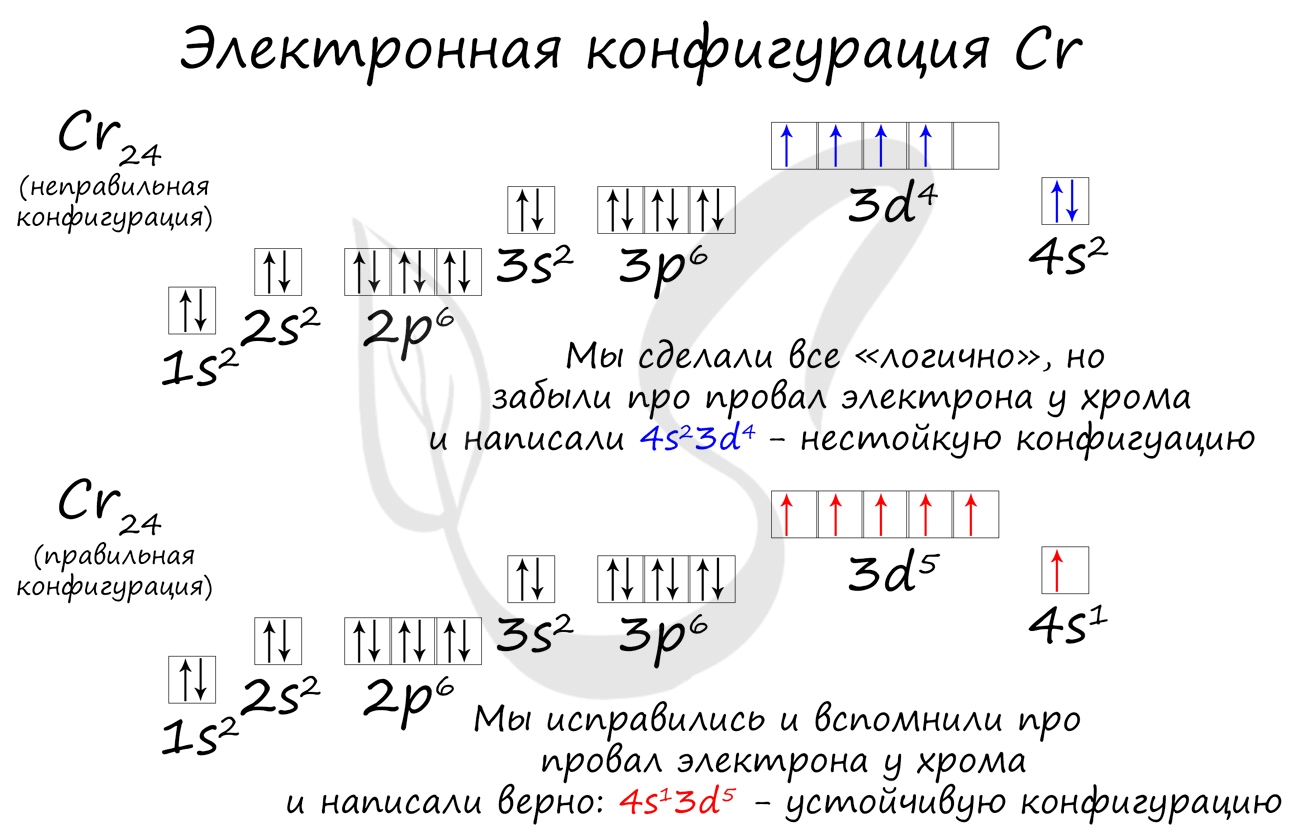
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и
сверьте с представленными ниже.

Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов
относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота,
кислорода , фтора — возбужденное состояние невозможно, так как отсутствуют свободные орбитали («ячейки») — электронам некуда перескакивать, к тому
же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический
уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
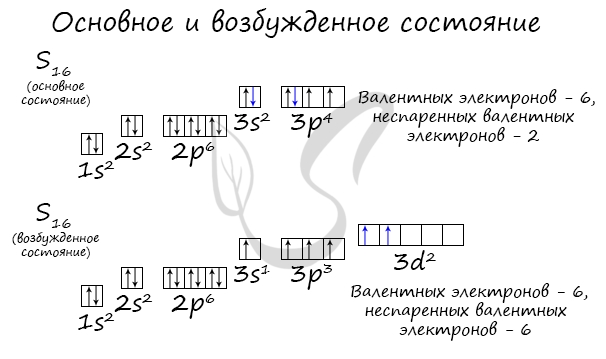
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние
связано с распаривание электронных пар.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Задание №1 ЕГЭ по химии
Описание задания
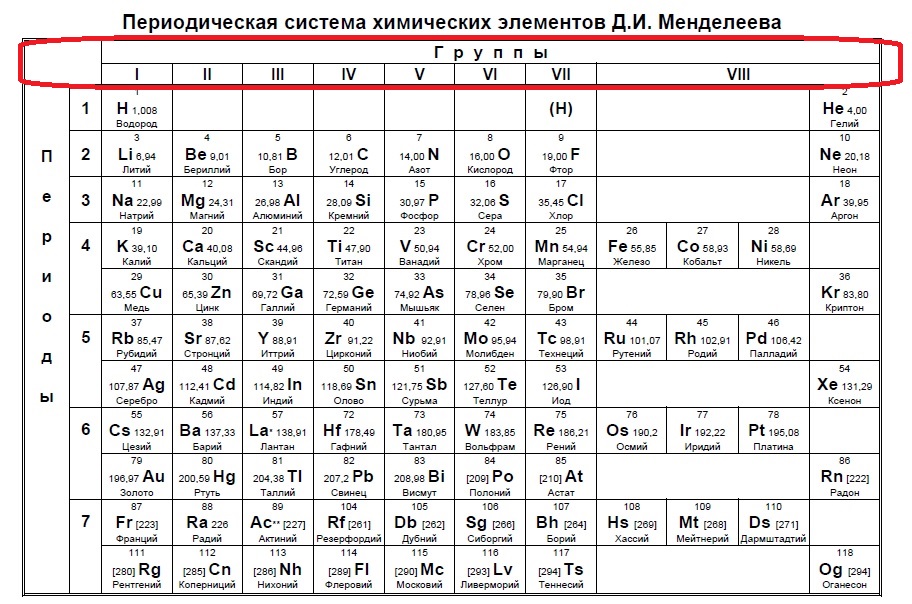
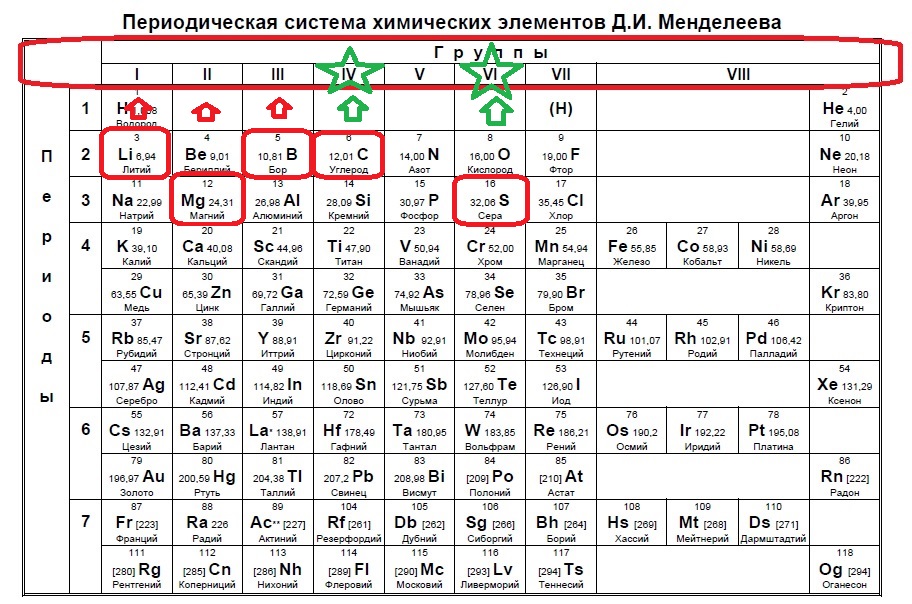
В Задании №1 нам необходимо уметь хорошо пользоваться таблицей Менделеева. Первое задание — это поиск атома или иона с заданной конфигурацией электронов, обычно это количество электронов на внешнем уровне (соответствует номеру группы).
Тематика заданий: электронная конфигурация атомов
Бал: 1
Сложность задания: ♦◊◊
Примерное время выполнения: 1 мин.
Разбор типовых вариантов заданий №1 ЕГЭ по химии
Вариант 1ЕХ1
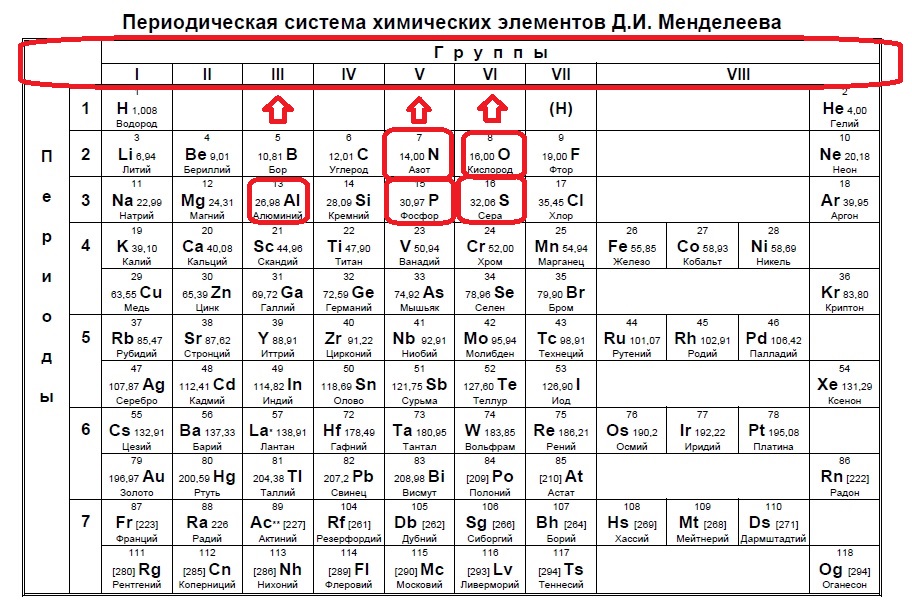
Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне пять электронов.
P
N
S
Al
O
Данный пример — типичный вариант первого задания — необходимо определить количество электронов на внешнем уровне. Вспоминаем, что на количество электронов на внешнем уровне указывает номер ГРУППЫ:
Напомню, что нам важно обращать внимание на то, в главной или побочной группе находится элемент. К сожалению, в таблице, которая дана на ЕГЭ нет деления на главные или побочные группы (какие-то элементы пишут правее, какие-то левее, но это не деление на главные и побочные группы), данная таблица не удобна, однако, по правилам можно пользоваться только ей. Обсуждать недостатки данной таблицы мы не будем, скажем лишь, что в условиях задания представлены всегда элементы главных групп, поэтому данный вопрос отпадает сам собой на экзамене (но нет гарантий, что не могут дать определить количество внешних электронов у кобальта, например, по номеру группы в данной таблице это не определишь).
Итак, находим наши пять элементов из условия:
Определяем номер группы — у алюминия 3 группа, у азота и фосфора — пятая, у кислорода и серы — шестая.
В условии нас спрашивают про пять электронов — значит выбираем элементы из пятой группы — азот и фосфор!
Ответ: 12
Вариант 1ЕХ2
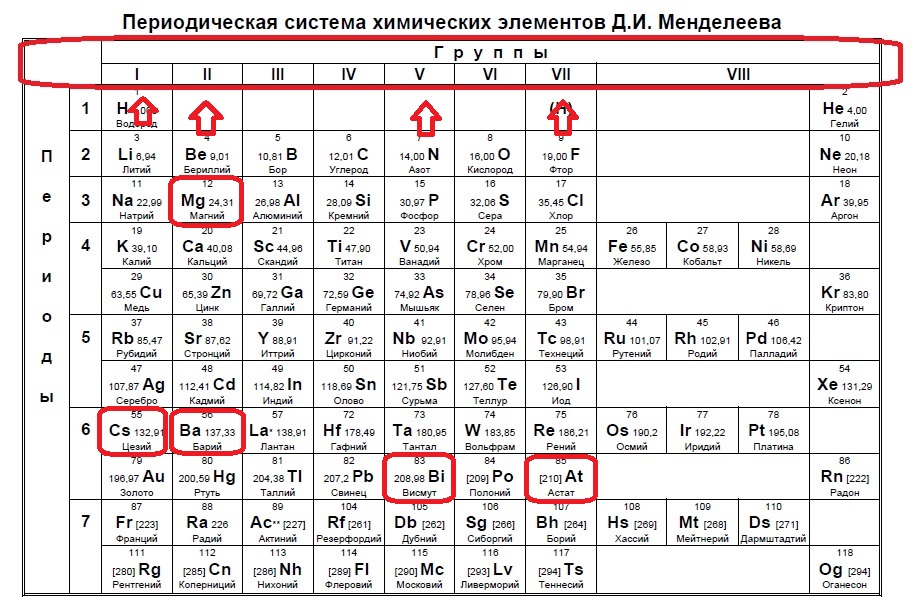
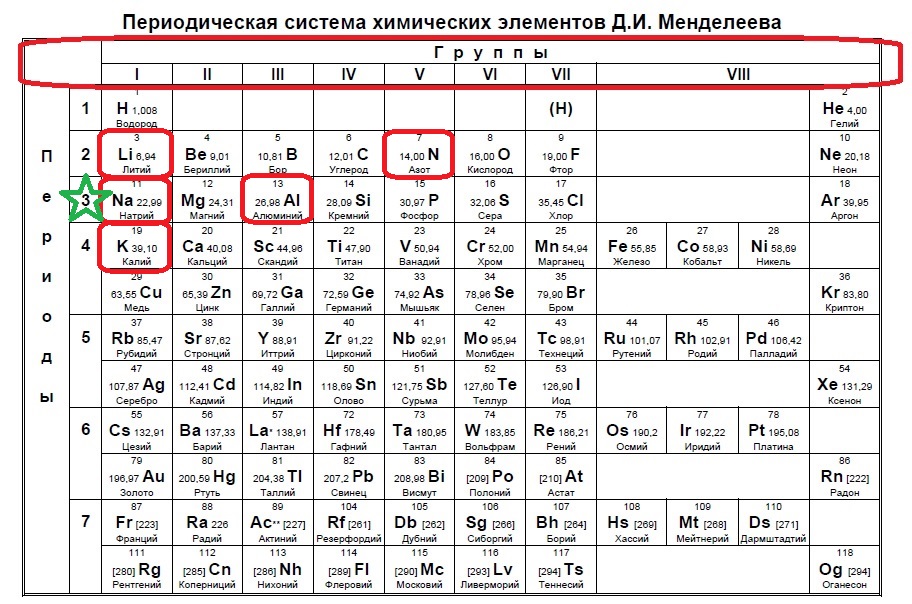
Определите, двум атомам каких из указанных элементов до завершения внешнего уровня не хватает шести электронов.
Ba
At
Bi
Mg
Cs
Данное задание немного другого типа, в нем необходимо определить элементы, которым не хватает какого-то количества электронов до завершения внешнего уровня. В этом случае наш алгоритм прост: мы знаем, что на внешнем уровне должно быть 8 электронов (2 и 3 период, или главные группы 4,5,6.. — в заданиях в основном фигурируют именно эти элементы), а значит вычитаем из 8 заданное число — в нашем случае 6: 8-6=2. Значит, в нашем элементе должно быть два электрона на внешнем уровне и, следовательно, расположен он во второй группе. Определяем группы элементов из условия:
В данном случае элементы второй группы — магний и барий.
Ответ: 14
Вариант 1ЕХ3
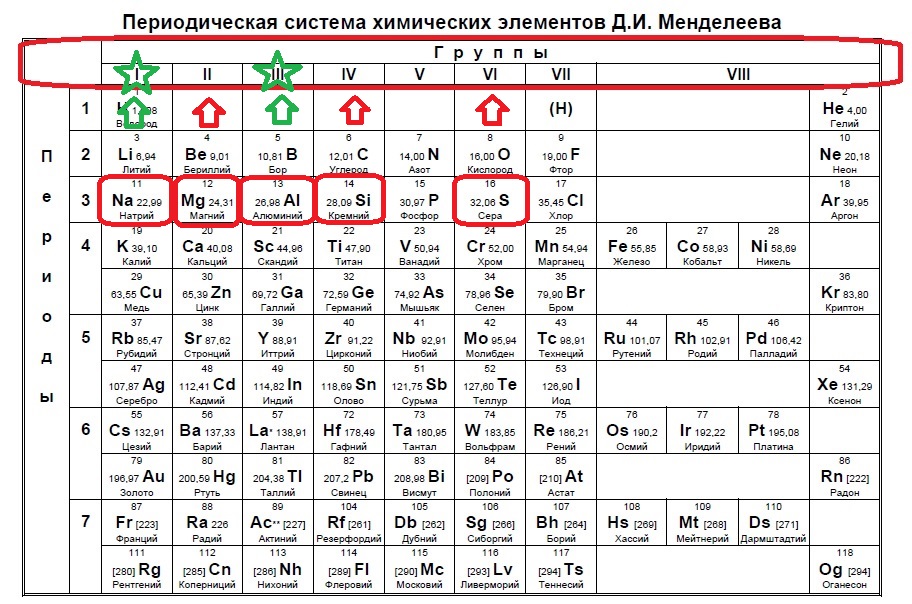
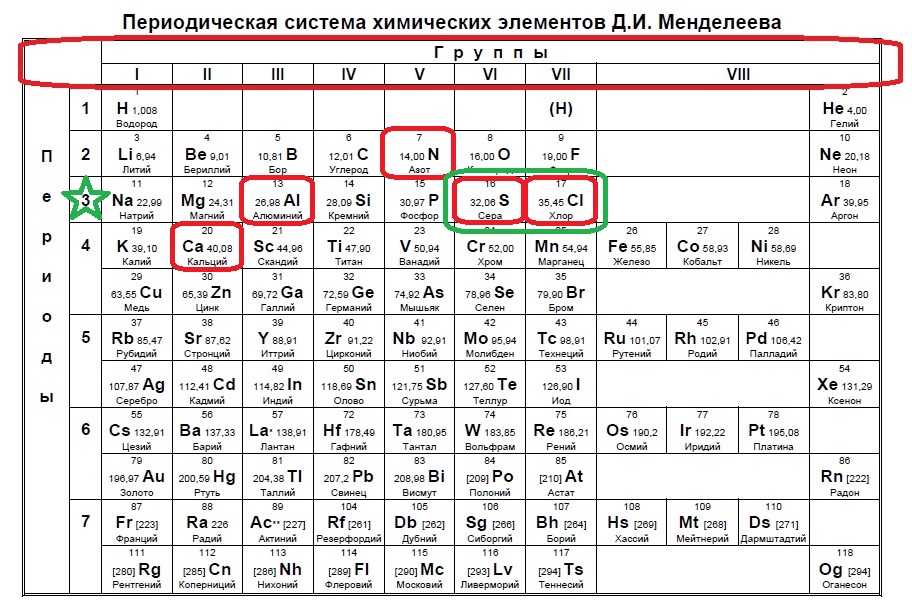
Определите, атомы каких двух из указанных в ряду элементов в основном состоянии содержат один неспаренный электрон.
S
Na
Al
Si
Mg
Следующий вид задания на поиск элементов с неспаренным электроном. Тут все достаточно просто. Так как электроны у нас в орбиталях всегда располагаются по парам (если помните, то есть квадратик, в котором мы рисуем стрелочку вверх и низ), то логично, что неспаренный электрон образуется, когда количество электронов на внешнем уровне нечетно, то есть в элемент должен быть расположен в нечетной группе, а именно 1,3,5,7. Определяем группы указанных нам элементов:
Итак, натрий в первой группе, магний во второй, алюминий в третьей, кремний в четвертой, а сера в шестой.
Выбираем элементы в нечетных группах — это натрий и алюминий!
Ответ: 23
Вариант 1ЕХ4
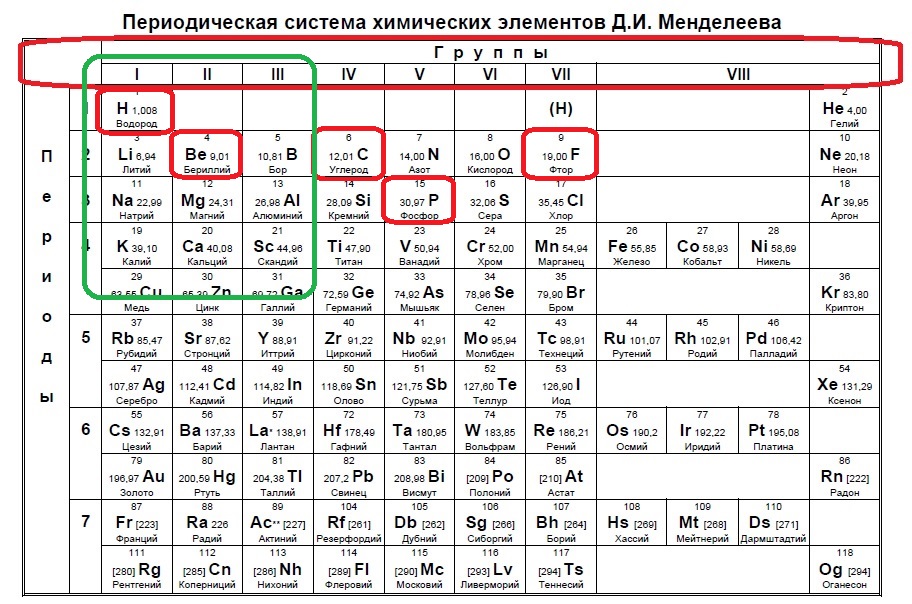
Определите, атомы каких двух из указанных в ряду элементов в основном состоянии содержат два неспаренных электрона.
S
Mg
C
B
Li
В данном задании нужно найти два неспаренных электрона. Данное распределение можно найти, начиная с p-подуровня, а именно два неспаренных электрона образуются в четвертой группе, так как на s -подуровне два электрона + 2 должно быть на p-подуровне, и в шестой группе, где 2s+2p(спаренные)+2p(неспаренные) (так как в p-подуровне три орбитали по два электрона на каждой). Таким образом нужно найти элементы четвертой группы или шестой:
В нашем случае это углерод и сера.
Ответ: 13
Вариант 1ЕХ5
Определите, какие два из указанных элементов образуют устойчивый положительный ион, содержащий 10 электронов.
Na
K
N
Li
Al
В данном варианте задания речь идет уже об ионе, причем положительном, который содержит 10 электронов. В такого вида заданиях необходимо определить, сколько заполнено уровней у иона в зависимости от количества электронов. В нашем случае 10 электронов — это полностью заполненные первый (2) и второй (8) уровни (или периоды в таблице). Так мы говорим о положительном ионе — значит элемент потерял электроны, но у него их было больше чем 10, а значит, он расположен в третьем периоде. Ищем такие элементы:
Нам подходят натрий и алюминий.
Ответ: 15
Вариант 1ЕХ6
Определите, какие из указанных элементов образуют устойчивый отрицательный ион, содержащий 18 электронов.
N
Al
S
Cl
Ca
Отрицательный ион получается путем добавления электронов к атому. 18 электронов — это полностью заполненный третий уровень или период, значит, наши элементы расположены именно в нем (в отличии от предыдущего задания, где мы искали в следующем периоде, так как ион положительный). Смотрим на предоставленные в условии элементы:
В данном случае в третий период попали алюминий, сера и хлор. Алюминий не может принять электроны до 18, так как является металлом и отдает электроны. Наиболее типичные элементы-любители электронов расположены правее. Это сера и хлор для данного задания.
Ответ: 34
Вариант 1ЕХ7
Определите, какие из указанных элементов на внешнем уровне содержат больше s-электронов, чем p-электронов (в основном состоянии).
H
C
F
Be
P
Такие виды заданий часто встречаются в тренировочных вариантах, нужно либо определить кого меньше, когда равно или кого больше. Разберем для наглядности данный пример. s-электронов всего два, значит p-электронов должно быть 1, чтобы было меньше. В сумме у элемента на внешнем уровне получается максимум 3 электрона (но может быть и ноль p-электронов и один или два s!), а значит он в третьей, второй или первой группе.
Нам подходит водород и бериллий.
Ответ: 14.
Остальные задания очень похожи на разобранные, поэтому вы их точно сможете решить, разобравшись с выше представленными решениями.
по электронной формуле
к примеру возьмём углерод, у которого электронная формула — 1s2 2s2 2p2
видишь на s-орбиталях по 2 электрона? это значит, что они СПАРЕНЫ
на p-орбиталях по два электрона, но 2р орбиталей — 3, а значит по правилу Гунда, два электрона займут две разных р-орбитали, отсюда следует что у углерода 2 неспаренных электрона!
Объяснение:
Электроны располагаются вне ядра на различных уровнях, а на каждом уровне есть определенные орбитали.
Орбиталь – пространство вокруг ядра, где наиболее вероятно расположение электрона.
Если на орбитали находится один электрон, то он называется неспаренным, а если два – то это спаренные электроны.
Чтобы понять, как образуются неспаренные электроны, нужно научиться изображать электронно-графическое строение атома. Электроны стремятся занять сначала сободные орбитали, а кому не хватает свободной орбитали, он подселяется к электрону первой орбитали.
Например,
1) Калий:
порядковый номер — № 19 ,
Заряд ядра атома калия Z=+19 Вокруг ядра атома 4 энергетических уровня, на которых располагаются 19 электронов.
Изобразим модели строение атома калия:
а). Модель атома калия при помощи дуг:
₊₁₉K)₂)₈ )₈)₁
б). Модель атома -электронная формула калия
₊₁₉K 1s²2s²2p⁶3s²3p⁶4s¹
в).Электронно-графическая модель атома:
4 уровень s↑
p ⇅ ⇅ ⇅
3уровень s⇅
p ⇅ ⇅ ⇅
2уровень s⇅
1уровень s⇅
₊₁₉K
У калия легко определить неспареный электрон, так как он на последнем уровне всего один.
2) Азот
порядковый номер — № 7 ,
Заряд ядра атома калия Z=+7 Вокруг ядра атома 2 энергетических уровня, на которых располагаются 7 электронов.
Изобразим модели строение атома азота:
а). Модель атома азота при помощи дуг:
₊₇N)₂)₅
б). Модель атома -электронная формула калия
₊₇N 1s²2s²2p³
в).Электронно-графическая модель атома:
p ↑↑↑
2уровень s⇅
1уровень s⇅
₊₇N
У азота на p-орбитали 3 электрона, орбиталей тоже 3 вот электроны и расположились каждый на отдельной орбитали и получилось3 неспаренных электрона.
3) Хлор
порядковый номер — № 17 ,
Заряд ядра атома калия Z=+17 Вокруг ядра атома 3 энергетических уровня, на которых располагаются 17 электронов.
Изобразим модели строение атома хлора:
а). Модель атома калия при помощи дуг:
₊₁₇CI)₂)₈ )₇
б). Модель атома -электронная формула калия
₊₁₇CI 1s²2s²2p⁶3s²3p⁵3d⁰
в).Электронно-графическая модель атома:
d — — — — —
p ⇅ ⇅ ↑
3уровень s⇅
p ⇅ ⇅ ⇅
2уровень s⇅
1уровень s⇅
₊₁₇CI
У хлора один неспаренный электрон.
Но у хлора есть еще d-орбиталь и в возбужденном состоянии электроны из s-орбитали и р-орбитали могут распариться и занять место на d-орбиталь:
г).Электронно-графическая модель атома хлора в возбужденном состоянии:
spd ↑↑ ↑↑↑↑↑
3уровень
p ⇅ ⇅ ⇅
2уровень s⇅
1уровень s⇅
₊₁₇CI*
Таким образом у хлора в возбужденном состоянии будет 7 неспаренных электронов, он может в таком состоянии, иметь степень окисления -7 , например оксид хлора(VII) CI₂⁺⁷O₇⁻²
Химия 5 — 9 классы 
02.17.19
Решено
40
ОТВЕТЫ
Спаренные электроны находятся на одной орбитали. А неспаренный электрон — это один электрон на орбитали. Чтоб их найти надо написать электронную конфигурацию.А число электронов можно определить, посмотрев на номер элемента, дальше рисуешь квадратики — энергетические уровни и заполняешь их стрелками, в одном квадратике может находится только 2 электрона, а когда будет одна стрелка в квадратике это будет неспаренный электрон.
48
Отв. дан
2019-02-17 09:36:17