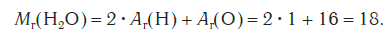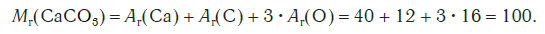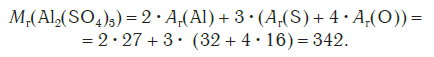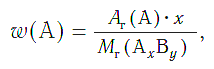В уроке 7 «Относительная молекулярная и относительная формульная массы» из курса «Химия для чайников» научимся вычислять относительную молекулярную массу, а также относительную формульную массу веществ; кроме того, выясним что такое массовая доля и приведем формулу для ее вычисления. Напоминаю, что в прошлом уроке «Валентность» мы дадим определение валентности, научились ее определять; рассмотрели элементы с постоянной и переменной валентностью, кроме того научились составлять химические формулы по валентности.
Каждый химический элемент характеризуется определенным значением относительной атомной массы. Состав любого вещества выражается молекулярной или простейшей формулой его структурной единицы. Такая структурная единица состоит из определенного числа атомов химических элементов. Поэтому масса структурной единицы может быть выражена в атомных единицах массы.
Содержание
- Относительная молекулярная масса
- Относительная формульная масса
- Вычисление массовой доли химического элемента по формуле вещества
Относительная молекулярная масса
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Mr.
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды H2O:
Относительная молекулярная масса серной кислоты H2SO4:
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными. Значение Мr показывает, во сколько раз масса молекулы данного вещества больше атомной единицы массы u. Например, если Mr(H2O) = 18, это значит, что масса молекулы H2O в 18 раз больше 1/12 части массы атома углерода, т. е. в 18 раз больше атомной единицы массы. Соответственно, масса молекулы H2SO4 в 98 раз больше 1/12 части массы атома углерода.
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr. При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:
Относительная формульная масса вещества Al2(SO4)3 равна:
Относительная формульная масса показывает, во сколько раз масса формульной единицы данного вещества больше 1/12 части массы атома углерода, или атомной единицы массы u.
Вычисление массовой доли химического элемента по формуле вещества
По формуле вещества можно рассчитать массовую долю атомов каждого химического элемента, который входит в состав этого вещества, т. е. определить, какую часть от общей массы вещества составляет масса атомов данного элемента.
Массовая доля (w) атомов химического элемента в веществе показывает, какая часть относительной молекулярной (формульной) массы вещества приходится на атомы данного элемента.
Массовая доля атомов элемента А в сложном веществе АxBy рассчитывается по формуле:
где w («дубль-вэ») — массовая доля элемента А;
Ar(А) — относительная атомная масса элемента А;
х, у — числа атомов элементов А и В в формуле вещества;
Mr(АхBy) — относительная молекулярная (формульная) масса вещества АхBy.
Массовые доли выражаются в долях единицы или в процентах.
Пример. Определите массовые доли элементов в фосфорной кислоте H3PO4
Спойлер
[свернуть]
Краткие выводы урока:
- Относительная молекулярная (формульная) масса вещества — это физическая величина, равная отношению массы молекулы (формульной единицы) вещества к 1/12 части массы атома углерода.
- Эта величина равна сумме относительных атомных масс химических элементов, входящих в состав молекулы (формульной единицы) данного вещества, с учетом числа атомов каждого элемента.
Надеюсь урок 7 «Относительная молекулярная и относительная формульная массы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Масса атома обозначается символом
ma
и может выражаться в единицах массы: килограммах или граммах.
Массы атомов малы. Так, масса атома водорода равна
ma(H)=1,67⋅10−24г
, а масса атома углерода —
ma(C)=19,94⋅10−24г
. Использовать такие числа неудобно, поэтому в химии применяется относительная атомная масса
Ar
.
Относительная атомная масса — это отношение массы атома к атомной единице массы.
В качестве атомной единицы массы (а. е. м.) выбрана (1/12) часть массы атома углерода. Эта единица обозначается буквой (u) (от английского «unit» — единица):
.
Относительная атомная масса — безразмерная величина, которая показывает, во сколько раз масса атома больше атомной единицы массы.
Относительные атомные массы химических элементов приведены в Периодической таблице. В расчётах обычно используют их значения, округлённые до целых.
Пример:
в Периодической таблице приведено значение относительной атомной массы магния — (24,305). Округлённое значение — (24). Значение атомной массы углерода — (12,011), а её округлённое значение — (12).
Исключение — относительная атомная масса хлора:
Ar(Cl)=
(35,5).
Значения относительных атомных масс некоторых элементов
| Элемент | H | He | Li | C | N | O | F | Ne | Na | Mg | Al | P | S | Cl | Ar | Ca | Fe | Cu | Zn |
|
Ar |
1 |
4 |
7 |
12 |
14 |
16 |
19 |
20 |
23 |
24 |
27 |
31 |
32 |
35,5 |
40 |
40 |
56 |
64 |
65 |
Относительная молекулярная масса
Mr
— это отношение массы молекулы или формульной единицы к атомной единице массы.
,
Относительная молекулярная масса показывает, во сколько раз масса молекулы или формульной единицы больше атомной единицы массы. Это тоже безразмерная величина. Она равна сумме относительных атомных масс всех химических элементов с учётом индексов в формуле вещества.
Пример:
относительная молекулярная масса углекислого газа:
.
Относительная молекулярная масса фосфата натрия:
.
Относительная молекулярная масса сульфата алюминия:
.
Каждый химический элемент характеризуется определенным значением относительной атомной массы. Состав любого вещества выражается формулой его структурной единицы (молекулярной формулой или формульной единицей). Такая формула состоит из определенного числа атомов химических элементов. Поэтому масса структурной единицы также может быть выражена в атомных единицах массы.
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Мr.
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс химических элементов, образующих данную молекулу. При этом, конечно, необходимо учитывать индексы у символов атомов в молекулярной формуле. Например, рассчитаем относительную молекулярную массу воды Н20:
$mathrm{M_{r}(H_{2}O)=2 cdot A_{r}(H)+A_{r}(O)=2 cdot 1+16=18~а.е.м.}$
Относительная молекулярная масса серной кислоты H2S04:
$mathrm{M_{r}(H_{2}SO_{4})=2 cdot A_{r}(H)+A_{r}(S)+4 cdot A_{r}(O)=2 cdot 1+32+16 cdot 4=98~а.е.м.}$
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Мr. Например, относительная формульная масса мела СаСО3, равна:
$mathrm{M_{r}(CaCO_{3})=A_{r}(Ca)+A_{r}(C)+3 cdot A_{r}(O)=40+12+16 cdot 4=100~а.е.м.}$
Относительная формульная масса Al2(S04)3 равна:
$mathrm{M_{r}(Al_{2}(SO_{4})_{3})=2 cdot A_{r}(Al)+3 cdot (A_{r}(S)+4 cdot A_{r}(O))=2 cdot 27+3 cdot(32+16 cdot 4)=342~а.е.м.}$
Исходя из химической формулы вещества, можно рассчитать массовую долю атомов каждого химического элемента, входящего в его состав.
Массовая доля (W) атомов химического элемента в веществе показывает, какая часть относительной молекулярной (формульной) массы вещества приходится на атомы данного элемента.
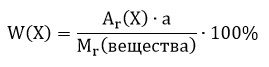
где w («дубль-вэ») — массовая доля элемента Х;
Аr(Х) — относительная атомная масса элемента Х;
а — количество атомов элемента Х в веществе;
Мr(вещества) — относительная молекулярная (формульная) масса вещества, в состав которого входит данный элемент Х.
Массовую долю выражают в долях единицы, например 0,07; 0,26; 0,99. Значение массовой доли можно выразить и в процентах. Для этого значение в долях нужно умножить на 100, например W(О) = 0,22, или 22 %.
Масса любого вещества равна сумме входящих в его состав атомов. Т.е. массовая доля всего вещества равна 100%, что составляет сумму массовых долей атомов, входящих в состав вещества.
Итак, сегодня мы узнали:
— Относительная молекулярная масса (Mr) — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
— Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой Мr и высчитывается также как и относительная молекулярная масса.
— Массовая доля химического элемента в веществе равна отношению массы атомов этого элемента к массе всего вещества.
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов — вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика — лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем — объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как — VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. — константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор — Cl2.


Моль (количество вещества) — самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи — выполнена 

Относительная плотность и газы — D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): «Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества»

Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
23
ГОСУДАРСТВЕННОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«БЕЛОРУССКО-РОССИЙСКИЙ УНИВЕРСИТЕТ»
Кафедра «Технологии металлов»
ХИМИЯ
Методические указания к практическим
занятиям
и для самостоятельной подготовки
студентов всех
специальностей дневной и заочной форм
обучения
Строение атома и
химическая связь
Могилев
2011
УДК 54
ББК 24
Х 46
Рекомендовано к опубликованию
учебно-методическим управлением
ГУ ВПО «Белорусско-Российский университет»
Одобрено
кафедрой «Технологии металлов» « » мая
2011 г., протокол №
Составители: канд. хим. наук, доцент И.
М. Лужанская
канд. биол. наук, ст. преподаватель И. А.
Лисовая
Рецензент
ст. преподаватель В.Ф. Пацей
В методических указаниях рассмотрены
современные представления о строении
атома, структура периодической системы
элементов, дается объяснение свойств
химических элементов в зависимости от
их положения в периодической системе.
Представлены основные виды химической
связи и механизмы их образования. Даны
примеры составления электронных
конфигураций атомов и схемы образования
химических соединенийэ.
ХИМИЯ
Ответственный за
выпускД. И.
Якубович
Технический редакторА. Т. Червинская
Компьютерная
верстка Н. П.
Полевничая
Подписано
в печать .
Формат 60×84/16.
Бумага офсетная. Гарнитура Таймс.
Печать
трафаретная. Усл.- печ. л. .
Уч.-изд. л. .
Тираж 180 экз. Заказ №
Издатель и
полиграфическое исполнение
Государственное
учреждение высшего профессионального
образования
«Белорусско-Российский
университет»
ЛИ № 02330/375 от
29.06.2004 г.
212000, г. Могилев,
пр. Мира, 43
©
ГУ ВПО «Белорусско-Российский
университет»,
2011
1
Основные понятия химии
Химия
— одна из важнейших и обширных областей
естествознания, наука о веществах, их
свойствах, строении и превращениях,
происходящих в результате химических
реакций, а также фундаментальных законах,
которым эти превращения подчиняются.
Вещество — вид
материи, которая обладает массой покоя.
Состоит из элементарных частиц:
электронов, протонов, нейтронов, мезонов
и др. Химия изучает главным образом
вещество, организованное в атомы,
молекулы, ионы и радикалы. Такие вещества
принято подразделять на простые и
сложные (химические соединения).
1.1
Простые и сложные
вещества. Аллотропия
Простые веществаобразованы
атомами одного химического элемента и
поэтому являются формой его существования
в свободном состоянии, например, сера,
железо, озон, алмаз, азот.
Сложные веществаобразованы разными
элементами и могут иметь состав постоянный
(стехиометрические соединения или
дальтониды) или меняющийся в некоторых
пределах (нестехиометрические соединения
или бертоллиды).
Химический элемент— множество
атомов с одинаковым зарядом ядра, числом
протонов, совпадающим с порядковым
номером в Периодической системе элементов
Менделеева. Каждый химический элемент
имеет свое название и символ.
Атом
— наименьшая химически
неделимая часть химического элемента,
являющаяся носителем его свойств.
Понятие
простое вещество
нельзя отождествлять с понятием
химический элемент.
Свойства химического элемента относятся
к его отдельным атомам. Свойства простого
вещества: плотность, растворимость,
температуры плавления и кипения относятся
к совокупности атомов. Один и тот же
химический элемент может существовать
в виде двух и более простых веществ,
различных по строению и свойствам. Это
явление называется аллотропией,
а образующие вещества — аллотропными
модификациями или аллотропными формами.
Химический
элемент кислород образует две аллотропные
модификации: кислород и озон, элемент
углерод образует четыре аллотропные
модификации: алмаз, графит, карбин,
фуллерен.
Явление
аллотропии вызывается двумя причинами:
различным числом атомов в молекуле
(например, кислород О2
и озон О3)
либо образованием различных кристаллических
форм (например, углерод образует
аллотропные модификации, такие как
алмаз, графит, карбин, фуллерен).
В структуре алмаза каждый атом углерода
расположен в центре тетраэдра, вершинами
которого служат четыре ближайших атома.
В кристаллической структуре графита
атомы углерода формируют шестиугольные
кольца, образующие, в свою очередь,
прочную и стабильную сетку, похожую на
пчелиные соты. Сетки располагаются друг
над другом слоями, которые слабо связаны
между собой.
В молекуле карбина атомы углерода
соединены в цепочки либо тройными и
одинарными связями, либо двойными
связями.
В фуллерене плоская
сетка шестиугольников свернута и сшита
в замкнутую сферу. Атомы углерода,
образующие сферу, связаны между собой
сильной связью.
Сложные
вещества состоят не
из простых веществ, а из химических
элементов. Так, водород и кислород,
входящие в состав воды, содержатся в
воде не в виде газообразных водорода и
кислорода с их характерными свойствами,
а в виде элементов
водорода и кислорода.
Вещества подразделяются на вещества
молекулярного и немолекулярного
строения.
Вещества молекулярного строения – это
вещества, основной структурной единицей
которых является молекула.
Вещества немолекулярного строения –
это вещества, основными структурными
единицами которых являются атомы или
ионы.
Для отображения качественного и
количественного состава вещества
используется формульная единица.
Формульная
единица (ФЕ)
– реальная или условная частица,
обозначаемая химической формулой.
Химическая формула – условная запись
состава вещества при помощи химических
символов и индексов.
Формульной единицей вещества молекулярного
строения является молекула.
Молекула– электронейтральная
частица вещества, представляющая собой
замкнутую совокупность конечного числа
атомов, связанных между собой силами
ковалентной связи и образующих
определенную структуру.
Формульной
единицей простого вещества немолекулярного
строения является атом. Например,
формульная единица кремния атом Si.
Формульной
единицей сложного вещества немолекулярного
строения является «условная молекула».
Например, формульной единицей оксида
кремния является условная частица,
состоящая из одного атома кремния (Si
) и двух атомов кислорода (О). Она является
условной потому, что в кристалле оксида
кремния(IV) нет отдельных
молекул SiO2,
он состоит из множества атомов кремния
и кислорода. Но весь кристалл можно
условно разделить на группы, в каждой
из которых будет один атом Si
и два атома О. Таким образом, формульная
единица оксида кремния (IV)
–условная, реально не существующая
частица – SiO2.
Если
вещество немолекулярного строения
образует ионную кристаллическую решетку,
например хлорид натрия. Его формульной
единицей будет условная частица,
состоящая из одного иона Na+
и одного иона Cl—.
Она является условной потому, что в
кристалле хлорида натрия нет молекул
NaCl, так как он состоит из
ионов. Но весь этот кристалл можно
разделить на группы ионов, в каждой из
которых будет один ион Na+
и один ион Cl—.
Следовательно, формульной единицей
хлорида натрия является условная
частица, состоящая из двух ионов – NaCl.
1.2
Относительная
атомная масса
Современные
методы исследования позволяют определить
чрезвычайно малые массы атомов с большой
точностью. Так, например, масса атома
водорода составляет 1,674
10-27
кг, углерода – 1,993
10-26
кг.
В
химии традиционно используются не
абсолютные значения атомных масс, а
относительные. Относительными они
называются потому, что вычисляются по
отношению к массе эталона. В настоящее
время в качестве эталона выбрана 1/12
часть абсолютной массы атома изотопа
углерода 12С
— атомная
единица массы (сокращенно
а.е.м.).
а.е.м.
= ma(12C)/12
= 19.9272 · 10-27
кг/12 = 1,66· 10-27
кг = 1,66 ·10-24
г
Относительная
атомная масса –
безразмерная величина, равная отношению
абсолютной массы данного атома к 1/12
части массы изотопа углерода 12С.
Химические элементы в природе представляют
собой смесь изотопов с различной массовой
долей. Исходя из этого, под абсолютной
массой атома химического элемента
подразумевается средняя величина.
Средняя абсолютная масса атома элемента– масса атома элемента, выраженная в
кг, вычисленная с учетом его изотопного
состава.
Относительная
атомная масса элемента
(или просто атомная
масса) – безразмерная величина, равная
отношению средней абсолютной массы
атома элемента к 1/12 части массы изотопа
12С.
Атомные
массы элементов обозначают Аr,
где индекс r
– начальная буква английского слова
relative – относительный.
Записи Ar(H),
Ar(O),
Ar(C)
– это относительная атомная масса
водорода, относительная атомная масса
кислорода, относительная атомная масса
углерода соответственно.
1.3
Относительная
молекулярная масса
Относительной
молекулярной массой вещества (Мr)
называется величина, равная отношению
массы молекулы вещества к 1/12 массы атома
углерода 12С.
Молекулярная
масса численно равна сумме относительных
атомных масс всех атомов, входящих в
состав молекулы вещества.
Относительная
молекулярная масса показывает, во
сколько раз масса молекулы данного
вещества больше 1/12 массы атома 12С.
Так, молекулярная масса кислорода Mr(O2)
равна 32. Это означает, что масса молекулы
кислорода в 32 раза
больше, чем 1/12 массы атома 12C.
К
сложным веществам немолекулярного
строения нельзя применить понятие
«относительная молекулярная масса».
Поскольку структурными единицами таких
веществ являются не молекулы, а условные
формульные единицы, к ним применим
термин «относительная формульная
масса»(Мfr).
Относительная формульная
масса – величина, равная
отношению массы одной формульной единицы
вещества к 1/12 части массы изотопа 12С.
1.4
Моль. Молярная масса
В химических процессах участвуют
мельчайшие частицы – молекулы, атомы,
ионы, электроны. Число таких частиц даже
в малой порции вещества очень велико.
Поэтому, чтобы избежать математических
операций с большими числами, для
характеристики количества вещества,
участвующего в химической реакции,
используется специальная единица –
моль.
Моль
– количество вещества, содержащее в
своем составе столько атомов, молекул,
ионов, электронов или других структурных
единиц, сколько атомов содержится в
0,012 кг углерода 12С.
Число
атомов в 0,012 кг углерода, или в 1 моль
называется числом Авогадро (NA)
и составляет 6,02 · 1023
.
Исходя
из этого, можно сказать, что моль
– это количество вещества, которое
содержит 6,02
1023
структурных единиц (молекул, атомов,
ионов, электронов и др.)
Применяя
понятие моль, необходимо в каждом
конкретном случае точно указать, какие
именно структурные единицы имеются в
виду. Например, моль атомов Н, моль
молекулы H2,
моль ионов H+.
Масса
одного моля вещества называется
молярной массой
вещества (M).
Масса
вещества (m) численно равна
произведению его количества (n)
на молярную массу:
Поскольку
в одном моле любого вещества содержится
одинаковое количество структурных
единиц, то молярная масса вещества
пропорциональна массе соответствующей
структурной единицы, т. е. относительной
молекулярной массе (Мr):
М =
К · Мr
К
= 1, т. к. для углерода М r
= 12 а.е.м., а молярная масса равна 12 (по
определению понятия моля), следовательно,
численные значения
М
(г/моль) = М r.
Отсюда
следует, что молярная масса вещества,
выраженная в граммах, имеет то же
численное значение, что и его относительная
молекулярная масса.
1.5
Эквивалент. Фактор
эквивалентности. Молярная масса
эквивалента
Эквивалент
(Э)
– реальная или условная частица вещества,
которая может замещать, присоединять
или быть каким-либо другим способом
эквивалентна (то есть равноценна) одному
атому или иону водорода в обменных
реакциях или одному электрону в
окислительно-восстановительных реакциях.
Частица
вещества, называемая эквивалентом,
может быть равна или в целое число раз
меньше формульной единицы, соответствующей
данному веществу.
И
так же, как состав молекул, атомов или
ионов, состав эквивалента выражается
с помощью химических знаков и формул.
Для того чтобы определить состав
эквивалента вещества и правильно
записать его химическую формулу, надо
исходить из конкретной реакции, в которой
участвует данное вещество.
Приведены несколько примеров определения
формулы эквивалента.
В обменной реакции
KOH + HCl = KCl + H2O; (1)
K++ OH–+ H++ Cl–=
K++ Cl–+ H2O;
H+ + OH–
= H2O
с одним ионом водорода реагирует один
ион гидроксила.
Согласно определению
эквивалента, Э(ОН–)
= ОН–,
а эквивалент гидроксида калия будет
соответственно равен формульной единице
КОН:
Э(КОН) = КОН.
В обменной реакции
Ca(OH)2+ 2HCl = CaCl2+ 2H2O
(2)
Ca2++ 2OH–+ 2H++
2Cl–= Ca2++ 2Cl–= 2H2O
один ион водорода эквивалентен
1/2 иона ,
одному иону OH–
и одному иону Cl–.
Следовательно, Э(Cl–)
= Cl–;
Э(Са2+)
= 1/2Са2+;
Э(ОН–)
= ОН–.
Вместе
с тем, согласно молекулярному уравнению,
с одной молекулой гидроксида кальция
взаимодействует две молекулы соляной
кислоты, то есть два иона водорода.
Следовательно, один ион водорода
потребуется на взаимодействие с 1/2
Са(ОН)2.
Тогда по определению эквивалентом
гидроксида кальция является частица,
равная
формульной единицы,
то есть ½ Са(ОН)2
. .
В реакции восстановления катиона цинка
Zn2+
+ 2e = Zn0
(3)
с
одним ионом цинка взаимодействуют два
электрона, следовательно, одному
электрону эквивалентна 1/2 иона Zn2+
и Э(Zn2+)
= 1/2Zn2+.
В реакции
Fe3+
+ e = Fe2+
(4)
ион Fe3+
реагирует с одним
электроном, и, соответственно,
В реакции
Fe3+
+ 3e = Fe0
(5)
ион Fe
присоединяет три электрона, следовательно,
Э(Fe3+)
= 1/3Fe3+.
Число,
показывающее, какая часть формульной
единицы вещества соответствует
эквиваленту, называется фактором
эквивалентности (fэ).
По
реакции (1): fэ(OH)
= 1; fэ(КOH)
= 1.
По
реакции (2) : fэ(OH)
= 1; fэ((Cа2+)
= 1/2; fэ
(Cа(ОН)2)
= 1/2.
По
реакции (3) fэ
(Zn2+)
= 1/2.
По
реакции (4) fэ
(Fe)
= 1.
По
реакции (5) fэ(Fe)
= 1/3.
Таким образом, сочетая фактор
эквивалентности и формульную единицу
вещества, можно составить формулу
эквивалента какой-либо частицы, где
фактор эквивалентности записывается
как коэффициент перед формулой частицы:
fэ
(формульная единица вещества) = эквивалент.
Следует
учитывать, что
эквивалент одного и того же вещества
меняется в зависимости от того, в какую
реакцию он вступает. Эквивалент элемента
также может быть различным в зависимости
от вида соединения, в состав которого
он входит.
Фактор эквивалентности химического
элемента.
где
B
–
валентность элемента в данном соединении.
Например,
в H2S
– fэ(S)
= 1/2, Э(S) = 1/2; в NH
— fэ(N)
= 1/3,
Э(N)
= 1/3N; в AlCl
— fэ(Al)
= 1/3, Э(Al) = 1/3Al,
fэ(Cl)
= 1, Э(Cl) = Cl.
Фактор
эквивалентности кислоты зависит
от ее основности, которая определяется
числом ионов водорода, замещающихся в
реакции на атомы металла (n(H+)):
Если
кислота многоосновная, то fэ
может принимать различные значения.
Например, в реакции
H2SO4
+ KOH =
KHSO4
+ H2O
(6)
серная кислота обменивает
на металл один атом водорода, fэ(Н2SO4)
= 1,
Э(H2SO4)
= H2SO4.
В реакции
H2SO4
+ 2KOH = K2SO4
+2H2O
(7)
серная кислота обменивает
на металл два атома водорода, т. е. ведет
себя как двухосновная кислота, поэтому
fэ(H2SO4)
= 1/2, Э(H2SO4)
= 1/2 H2SO4.
Фактор
эквивалентности основания
зависит от кислотности основания,
которая определяется числом гидроксильных
групп, обменивающихся в реакции на
кислотный остаток (n(OH—):
Для
многокислотных оснований fэ
– величина переменная и зависит от
условий проведения реакции. Например,
в реакции
Al(OH)3 + 2HCl
= Al(OH)2Cl + 2H2O (8)
гидроксид алюминия обменивает
одну гидроксильную группу на кислотный
остаток, поэтому fэ(Al(OH)3)
= 1, Э(Al(OH)3)
= Al(OH)3.
В реакции
Al(OH)3 + 2HCl = Al(OH)Cl2
+ 2H2O (9)
гидроксид алюминия обменивает
две гидроксильные группы на кислотный
остаток, поэтому fэ(Al(OH)3)
= 1/2, Э(Al(OH)3)
= 1/2Al(OH)3.
В реакции
Al(OH)3 + 3HCl = AlCl3
+ 3H2O (10)
гидроксид алюминия обменивает
три гидроксильные группы на кислотный
остаток, поэтому fэ(Al(OH)3)
= 1/3, Э(Al(OH)3)
= 1/3Al(OH)3.
Фактор эквивалентности средней соли
определяется формулой
где В – валентность метала,
n – число атомов металла.
Например, fэ(Na2SO4)
= 1/(1·2) = 1/2;
fэ(Fe2SO4)3)
= 1/(2·3) =1/6.
Фактор
эквивалентности кислых и основных солей
определяется исходя
из уравнения реакции с учетом того, что
вещества взаимодействуют друг с другом
в эквивалентных количествах.
B
реакции
NaHSO4 +NaOH = Na2SO4
+ H2O
(11)
одна молекула гидросульфата
натрия взаимодействует с одним
эквивалентом NaOH,
следовательно, fэ(NaHSO4)
= 1, Э(NaHSO4)
= NaHSO4.
В реакции
NaHSO4 + BaCl2 =
BaSO4 + NaCl + HCl (12)
одна молекула гидросульфата
натрия взаимодействует с двумя
эквивалентами хлорида бария, т.к.
fэ(ВаCl2)
= 1/2 и Э(BaCl2)
= 1/2BaCl2,
следовательно, fэ(NaHSO4)
также равен 1/2 и Э(NaHSO4)
= 1/2NaHSO4.
В реакции
Al(OH)Cl2+ HCl = AlCl3+ H2O
(13)
одна молекула дихлорида
гидроксоалюминия взаимодействует с
одним эквивалентом HCl,
поэтому fэ(Al(OH)Cl2)
= 1, Э(Al(OH)Cl2)
= Al(OH)Cl2.
В реакции
Al(OH)Cl2 + 2NaOH= Al(OH)3+ 2NaCl (14)
однамолекуладихлоридагидроксоалюминиявзаимодействуетсдвумяэквивалентамиNaОН(fэ(NaOH)
= 1),следовательно,
fэ(AlOHCl2) = 1/2,Э(AlOHCl2) = 1/2 AlOHCl2.
В реакции
Al(OH)Cl2 + Na3PO4
= AlPO4 + 2NaCl= Na(OH)
(15)
одна молекула дихлорида
гидроксоалюминия взаимодействует с
тремя эквивалентами Na3PO4(fэ(Na3PO4)
= 1/3), поэтому fэ(AlOHCl2)
= 1/3, Э(AlOHCl2)
= 1/3AlOHCl2.
Фактор эквивалентности оксидов,
проявляющих основные свойства,
определяется по формуле
где
В – валентность металла,
n
– число атомов металла в оксиде.
Например:
CaO fэ(СaO)
= 1/2, Э(CaO) = 1/2 CaO;
Na2O fэ(Na2O)
= 1/2,Э(Na2O) = 1/2Na2O;
Al2O3fэ(Al2O3)
= 1/6,Э(Al2O3) =
1/6 Al2O3.
Фактор
эквивалентности оксидов,
проявляющих кислотные
свойства, определяется
исходя из уравнения реакции.
В
реакции
SO3
+ 2NaOH =
Na2SO4
+ H2O
(16) одна молекула оксида серы
(VI) взаимодействует с
двумя эквивалентами гидроксида натрия
(fэ(NaOH)
= 1),
cледовательно, fэ(SO3)
= 1/2, Э(SO3)
= 1/2SO3.
В реакции
Al2O3
+ 2NaOH = 2NaAlO2
+ H2O
(17)
одна молекула оксида алюминия
взаимодействует с двумя эквивалентами
гидроксида натрия, поэтому fэ(Al2O3)
равен 1/2, Э(Al2O3)
= 1/2 Al2O3.
Таким образом, на основании всех
вышеприведенных примеров можно сделать
вывод, что фактор эквивалентности любого
вещества равен единице, деленной на
число образующихся либо перестраивающихся
связей.
Для эквивалента справедливы все понятия,
характеризующие структурные единицы
вещества, в том числе количество вещества
и молярная масса вещества.
Количество вещества эквивалентов
измеряется в молях.
Моль
эквивалентов – это
количество вещества, которое соединяется
с 1 молем атомов водорода или 1/2 моля
атомов кислорода или замещает те же
количества водорода в их соединениях.
Например, в соединениях HCl,
H2S,
NH3,
CH4
моль эквивалентов хлора, серы, азота,
углерода равен соответственно 1 моль
Cl,
1/2 моля S,
1/3 моля N, 1/4
моля углерода.
Молярная
масса эквивалента (Мэ)
– это масса одного моля эквивалентов.
Для
нахождения молярной массы эквивалентов
химического элемента нужно молярную
массу данного элемента умножить на
фактор эквивалентности:
Например, в соединениях:
HCl
Mэ(Cl)
= fэ(Cl)
· M(Cl)
= 1· 35.5 г/моль;
NH3
Mэ(N)
= fэ(N)
· M(N)
= 1/3· 14 = 4.67 г/моль;
H2SМэ(S)
= fэS) · Ms = 1/2 · 32 = 16г/моль;
CH4
Мэ(C)
= fэ · Mc = 1/4
· 12 = 3 г/моль.
Для кислот, оснований, средних солей и
оксидов, проявляющих основные свойства,
молярная масса эквивалентов может быть
рассчитана как сумма молярных масс
эквивалентов, составляющих данное
соединение ионов или элементов, если
речь идет об оксидах.
Например,
в реакции (6) Мэ(H2SO4)
равна:
Мэ(Н+)
+ Мэ(HSO4–)
= fэ(H+)·
M(H+)
+ fэ(HSO4–)
· M(HSO4–)
= 98 г/моль.
В
реакции (7) Мэ(H2SO4)
равна:
Мэ(Н+)
+Мэ(SO42–)
= fэ(H+) · M(H+)
+ fэ(SO42–)
· M(SO42–) = 49г/моль
В
реакции (8) Мэ(Al(OH)3)
равна:
Мэ(Al(OH)2+)
+ Mэ(OH–)
= fэ(Al(OH)2+)
· M(Al(OH)2+)
+ fэ(OH–)
· Mэ(OH–)
= 78 г/моль
В
реакции (9) Мэ(Al(OH)3)
равна:
Мэ(AlOH2+)
+ Mэ(OH–)
= fэ(Al(OH)2+)
· M(AlOH2+)
+ fэ(OH–)
· Mэ(OH–)
= 39г/моль
В
реакции (10) Мэ(Al(OH)3)
равна:
Мэ(Al3+)
+ Mэ(OH–)
= fэ(Al3+)
· M(Al) +
fэ(OH–)
· M(OH–)
= 26 г/моль
Мэ(Al2(SO4)3)
= fэ(Al3+) · M(Al)
+fэ(SO42-)
· M(SO42-) = 57г/моль
8
г/моль.
Раздел
химии, рассматривающий массовые и
объемные отношения между реагирующими
веществами, называется стехиометрией.
Основу стехиометрии составляют
стехиометрические законы: сохранения
массы веществ, постоянства состава,
эквивалентов, кратных отношений, объемных
отношений, Авогадро. К рассмотрению
предложены некоторые из них.
2.1 Закон сохранения массы вещества
Закон сохранения массы вещества был
сформулирован великим русским ученым
Михаилом Васильевичем Ломоносовым в
1748 г. и подтвержден экспериментально
им самим в 1756 г. и независимо от него
французским химиком А. Л. Лавуазье в
1789 г.
В
настоящее время он формулируется так:
масса веществ, вступающих
в химическую реакцию, равна массе
веществ, образующихся в результате
реакции.
С точки зрения
атомно-молекулярного учения суть закона
сохранения массы веществ заключается
в том, что в химических реакциях атомы
не исчезают и не возникают из ничего,
их число остается неизменным до и после
реакции. Поэтому атомы имеют постоянную
массу и их число в результате реакции
не изменяется, а происходит только
перегруппировка атомов, то масса веществ
до и после реакции остается постоянной.
Закон
сохранения массы является частным
случаем общего закона природы закона
сохранения энергии, который утверждает,
что энергия изолированной системы
постоянна. Энергия — это мера движения
и взаимодействия различных видов
материи. При любых процессах в изолированной
системе энергия не производится и не
уничтожается, она может только переходить
из одной формы в другую.
Одной из форм энергии является так
называемая энергия покоя, которая
связана с массой уравнением Эйнштейна:
Е = m
· C2
где E — энергия тела,
m
—масса тела,
c
— скорость света в вакууме, равная 299
792 458 м/с.
Это соотношение выражает эквивалентность
массы и энергии. Эквивалентность массы
и энергии — физическая концепция, согласно
которой масса тела является мерой
энергии, заключённой в нём. Самое важное
состоит в том, что формула Эйнштейна
раскрывает возможность взаимных
превращений энергии и массы или, иначе
говоря, возможность превращений энергии
покоя в другие виды энергии. Следовательно,
масса и энергия сохраняются не по
отдельности, а вместе, что дает основание
говорить об объединенном законе
сохранения массы и энергии.
В химических реакциях изменением массы,
вызванным выделением или поглощением
энергии, можно пренебречь. Типичный
тепловой эффект химической реакции по
порядку величины равен 100 кДж/моль. При
этом изменение массы
моль.
Таким образом, совершенно правомерно
использование закона сохранения массы
вещества при составлении химических
уравнений и при проведении стехиометрических
расчетов.
2.2 Закон постоянства состава
Согласно
закону постоянства состава каждое
химически чистое соединение всегда
имеет один и тот же количественный
состав независимо от способа его
получения. Этот закон
появился в результате длительного
(18011808)
спора французских химиков Ж.Пруста,
считавшего, что отношения между
элементами, образующими соединения,
должны быть постоянными, и К.Бертолле,
который считал, что состав химических
соединений является переменным. В
результате тщательной экспериментальной
проверки восторжествовала точка зрения
Пруста, считавшего состав соединений
постоянным. Закон постоянства состава
сыграл важную роль в развитии химии и
до сих пор сохранил свое значение, однако
выяснилось, что не все соединения имеют
постоянный состав. В 1912–1913 гг Н. С.
Курнаков установил, что существуют
соединения переменного состава, которые
он предложил назвать бертоллидами.
Согласно
современным представлениям, постоянство
состава свойственно лишь соединениям
с молекулярной структурой.
Таким
образом, постоянный и неизменный
химический состав наблюдается только
для молекул (например, NH3
, H2O,
SO2 и
т. п.), а также кристаллов с молекулярной
структурой, составляющих от 3 до 5 % от
общего числа неорганических твердых
тел. Хорошо известными примерами являются
твердый йод, кислород, азот, диоксид
углерода, благородные газы в твердом
состоянии.
В настоящее время установлено, что к
соединениям переменного состава
относятся не только металлические
соединения (металлиды), но и многочисленные
оксиды, сульфиды, селениды, теллуриды,
нитриды, фосфиды, карбиды, силициды.
Природа
отклонений от стехиометрии в соединениях
переменного состава состоит в том, что
при любых температурах, отличных от
абсолютного нуля, в реальном кристалле
существуют дефекты структуры. При
повышении температуры концентрация
этих дефектов возрастает, что приводит
к увеличению энтропии (неупорядоченности)
системы. Абсолютно упорядоченной
структурой обладает так называемый
идеальный кристалл, в котором каждый
атом занимает предназначенный ему узел
в подрешетке. При этом все узлы заняты,
а междоузлия вакантны. Такая идеализированная
структура обладает полным порядком
(энтропия равна нулю) и может быть
реализована только при температуре
абсолютного нуля. При повышении
температуры нарушения идеальной
структуры возможны за счет возникновения
незанятых узлов в кристаллической
решетке, появления атомов в междоузлиях
или существования в узлах решетки
чужеродных атомов. Возникновение таких
дефектов в реальных кристаллах приводит
к нестехиометрии. Хорошо изученным
соединением переменного состава является
сульфид железа FeS. Для
природных кристаллов сульфида железа
наблюдается недостаток от 10 до 20 % атомов
железа против формульного состава.
Для оксида титана (II)
нарушение стехиометрического состава
наблюдается относительно обоих сортов
атомов. В TiO в зависимости
от условий получения (температура,
давление кислорода) атомная доля
кислорода может меняться от 0,58 до 1,33.
Это значит, что все составы оксида титана
(II) от 0,58 до 1,00 будут
характеризоваться недостатком атомов
кислорода (соответственно избытком
атомов титана) против стехиометрии. А
составы от 1,00 до 1,33 будут иметь избыток
атомов кислорода (или недостаток атомов
титана) по сравнению со стехиометрическим
составом.
Закон
постоянства состава был в свое время
сформулирован применительно к молекулам,
а потому справедлив для молекулярной
формы существования вещества. В настоящее
время этот закон формулируется с учетом
существования молекулярной и немолекулярной
структуры вещества.
Состав
молекулярного соединения остается
постоянным независимо от способа его
получения. В отсутствие молекулярной
структуры в данном агрегатном состоянии
состав вещества зависит от условий его
получения и предыдущей обработки.
Например,
аммиак независимо от способов получения
(прямой синтез из элементов, разложение
аммонийных солей, действие кислот на
нитриды активных металлов и т. п.) имеет
постоянный состав молекулы: на один
атом азота приходится три атома водорода.
А для оксида титана (II)
состав соединения зависит от условий
получения температуры и давления пара
кислорода.