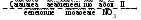Алгоритмы составления химических формул
Составление
химических формул для соединений двух
химических элементов в тех случаях,
когда для каждого элемента существует
только одна стехиометрическая валентность.
|
Алгоритм |
Составление |
|
|
Установление |
Аl |
О |
|
Определение |
АIII |
ОII |
|
Вычисление |
6 |
|
|
Определение |
2 |
3 |
|
Указание числового |
2 |
|
|
Указание |
Аl2 |
О3 |
|
Составление |
Аl2О3 |
Составление
химических формул для соединений,
которые существуют в водном растворе
в виде ионов.
|
Алгоритм |
Составление |
|
|
Установление |
Аl3+ |
SО42– |
|
Определение |
3 |
2 |
|
Вычисление |
6 |
|
|
Определение |
2 |
3 |
|
Указание числового |
2 |
|
|
Указание |
Аl2 |
(SО4)3 |
|
Составление |
Аl2(SО4)3 |
Написание химических формул
Для
указания в химических формулах
стехиометрических индексов и зарядов
ионов существуют следующие правила.
1. Если
стехиометрический индекс относится к
группе атомов, обозначающие эту группу
химические символы ставятся в скобки:
С3Н5(ОН)3
– в молекуле глицерина содержатся 3
гидроксигруппы;
Ca(NО3)2
– в формульной единице нитрата кальция
содержатся ионы кальция и нитрат-ионы
в соотношении 1 : 2.
2.
Данные о заряде сложного многоатомного
иона в химической формуле относятся ко
всему иону:
SО42–
– сульфат-ион – имеет двухкратный
отрицательный заряд;
NН4+
– ион аммония – имеет одинарный
положительный заряд.
3.
Химическая формула комплексного иона
ставится в квадратные скобки, за которыми
указывается его заряд; она состоит из:
– химического
символа центрального атома;
– химической
формулы лиганда в круглых скобках;
– нижнего
индекса, указывающего число лигандов.
[Fe(CN)6]4–
– гексацианоферрат(II)-ион; в имеющем
четыре отрицательных заряда ионе шесть
лигандов СN–
(цианид-ион) связаны с центральным атомом
FеII
(катион железа Fe2+).
[Cu(NH3)4]2+
–
ион тетраамминмеди (II); в имеющем два
положи-тельных заряда ионе четыре
лиганда NH3
(молекула аммиака) связаны с центральным
атомом меди (ион Сu2+).
4.
Химическая формула воды в гидратах и
кристаллогидратах отделяется точкой
от химической формулы основного
вещества.
CuSO4
· 5H2O
– пентагидрат сульфата меди (II)
(медный купорос).
Классификация неорганических веществ и их свойства
Все
неорганические вещества делятся на
простые и сложные.
Простые
вещества подразделяются на металлы,
неметаллы и инертные газы.
Важнейшими
классами сложных неорганических веществ
являются: оксиды,
основания, кислоты, амфотерные гидрооксиды,
соли.
Оксиды
—
это соединения двух элементов, один из
которых кислород. Общая формула
оксидов:
ЭmOn
где
m
–
число
атомов элемента Э;
n
– число атомов кислорода.
Примеры
оксидов: К2О,
CaO,
SO2,
P2O5
Основания
– это сложные вещества, молекулы которых
состоят из атома металла и одной или
нескольких гидроксидных групп – ОН.
Общая формула оснований:
Me(ОН)y
где у
– число
гидроксидных групп, равное валентности
металла (Me).
Примеры
оснований: NaOH,
Ca(OH)2,
Со(ОН)3
Кислоты
—
это сложные вещества, содержащие атомы
водорода, которые могут замещаться
атомами металла.
Общая
формула кислот
НхАсу
где
Ас – кислотный остаток (от англ., acid
– кислота);
х
– число
атомов водорода, равное валентности
кислотного остатка.
Примеры
кислот: НС1, HNO3,
H2SO4,
H3PO4
Амфотерные
гидроксиды
– это сложные вещества, которые имеют
свойства кислот и свойства оснований.
Поэтому формулы амфотерных гидроксидов
можно записывать в форме оснований
и в форме кислот. Примеры амфотерных
гидроксидов:
Zn(OH)2
= H2ZnO2
Al(OH)3
= H3AlO3
форма
форма
оснований
кислот
Соли
– это сложные вещества, которые являются
продуктами замещения атомов водорода
в молекулах кислот атомами металла или
продуктами замещения гидроксидных
групп в молекулах оснований кислотными
остатками. Например:
|
НСl |
|
NаСl |
|
Са(ОН)2 |
|
Са(NО3)2 |
Состав
нормальных солей выражается общей
формулой:
Мех
(Ас)
у
где х
— число
атомов металла; у
—
число кислотных остатков.
Примеры
солей: K3PO4;
Mg
SO4;
Al2(SO)3;
FeCl3.
Оксиды
|
Название |
= |
«Оксид» |
+ |
Название (в |
+ |
Валентность |
Например:
СО – оксид углерода (II)
– (читается: «оксид углерода два»);
СО2
– оксид углерода (IV);
Fe2O3
– оксид железа (III).
Если
элемент имеет постоянную валентность,
ее в названии оксида не указывают.
Например: Nа2О
– оксид натрия; Аl2О3
– оксид алюминия.
Классификация
Все
оксиды делятся на солеобразующие и
несолеобразующие (или индифферентные).
Несолеобразующие
(индифферентные) оксиды
— это оксиды, которые не образуют
солей при взаимодействии с кислотами
и основаниями. Их немного. Запомните
четыре несолеобразующих оксида: СО,
SiO,
N2O,
NO.
Солеобразующие
оксиды
— это оксиды, которые образуют соли
при взаимодействии с кислотами или
основаниями. Например:
Na2O
+ 2НС1 = 2NaCl
+ Н 2О
оксид
кислота соль
|
SO3 |
+ |
2NaOH |
= |
Na2SO4 |
+ |
Н2О |
|
оксид |
основание |
соль |
Многие
солеобразующие оксиды взаимодействуют
с водой. Продукты взаимодействия оксидов
с водой называются гидратами оксидов
(или гидроксидами). Например:
|
Na2O |
= |
H2O |
+ |
2NaOH |
|
оксид |
гидроксид |
Некоторые
оксиды с водой не взаимодействуют, но
им соответствуют гидроксиды, которые
можно получить косвенным (непрямым)
путем. В зависимости от характера
соответствующих гидроксидов все
солеобразующие оксиды делятся на три
типа: основные, кислотные, амфотерные.
Основные
оксиды
— это оксиды, гидраты которых являются
основаниями. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
Основные |
Основания |
Все
основные оксиды являются оксидами
металлов.
Кислотные
оксиды
— это оксиды, гидраты которых являются
кислотами. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
Кислотные |
Кислоты |
Большинство
кислотных оксидов являются оксидами
неметаллов. Кислотными оксидами
являются также оксиды некоторых металлов
с высокой валентностью. Например:

Амфотерные
оксиды
— это оксиды, которым соответствуют
амфотерные гидроксиды.
Все
амфотерные оксиды являются оксидами
металлов.
Следовательно,
неметаллы
образуют только кислотные
оксиды;
металлы
образуют
все основные,
все амфотерные
и некоторые кислотные
оксиды.
Все
оксиды одновалентных
металлов (Na2O,
K2O,
Cu2O
и др.) являются основными. Большинство
оксидов двухвалентных
металлов (CaO,
BaO,
FeO
и др.) также являются основными. Исключения:
BeO,
ZnO,
PbO,
SnO,
которые являются амфотерными. Большинство
оксидов трех-
и
четырехвалентных
металлов являются
амфотерными:



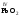
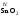
V,
VI,
VII
.являются
кислотными:
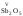


др.
Металлы
с переменной валентностью могут
образовывать оксиды всех трех типов.
Например:
СrО – основный оксид, Сr2О3
– амфотерный оксид, СrО3
– кислотный оксид.
Графические
формулы
В
молекуле оксида атом металла непосредственно
соединяется с атомами кислорода.
Соседние файлы в папке Химия(лабы+теория)
- #
- #
- #
Алгоритмы составления химических формул и уравнений химических реакций.
Валентность
Составление формул по валентности
|
Алгоритм решения |
Пример |
|
1. Запишите символы элементов (согласно ряду электроотрицательности) |
Аl О |
|
2. Запишите валентность элементов (по периодической системе) |
III II Аl О |
|
3. Найдите наименьшее общее кратное (нок) между числовыми значениями валентности |
6 III II Аl О НКО =6 |
|
4. Найдите соотношение между атомами элементов (деля НОК на соответствующую валентность). Полученные значения являются индексами |
6 III II Аl О 6 : 3=2 6 : 2= 3 →2:3 |
|
5. Запишите формулы веществ |
Аl2 О3 |
Определение валентности по формуле
|
Алгоритм решения |
Пример |
|
1. Запишите формулу вещества |
Р2 О5 |
|
2. Обозначьте известную валентность элемента |
II Р2 О5 |
|
3. Найдите наименьшее общее кратное (нок) между числовыми значениями валентности |
10 II Р2 О5 НОК =10 |
|
4. Поделите наименьшее общее кратное на количество атомов другого элемента. Полученный ответ и является искомой валентностью |
10 V II Р2 О5 10: 2=5 |
|
5. Сделайте проверку перемножьте валентность на индекс каждой части формулы. Их производные должны быть равны |
V II Р2 О5 10 = 10 |
Степень окисления
1.Элемент в простом веществе имеет нулевую степень окисления. 2.Все металлы имеют положительную степень окисления. 3. Водород имеет в соединениях степень окисления (+1), исключая гидриды ( соединения водорода с металлами главной подгруппы первой, второй групп, степень окисления -1, например Na+H— ); 5.Кислород имеет степень окисления (-2),за исключением соединения кислорода со фтором O+2F—2 и в перекисях( Н2О2 — степень окисления кислорода (-1). 6.Фтор имеет степень окисления (-1)
7. Алгебраическая сумма степеней окисления равна 0
Алгоритм определения степени окисления по формуле
|
Задание . Определите степень окисления в соединении Р2О5 |
|
|
1.Запишите формулу заданного вещества |
Р2О5 |
|
2. Запишите значение степени окисления элемента, у которого она постоянна |
Р2О5 -2 |
|
3. Найдите общее число степени окисления известного элемента |
(-2) ∙ 5= — 10 |
|
4. Общее число положительной степени окисления численно равно общему числу отрицательной степени окисления |
Р2 О5 -2 +10 -10 |
|
5. Найдите величину положительной степени окисления, разделив ее на индекс у этого элемента |
(+10) ꞉ 2 = +5 |
|
6. Поставьте значение степени окисления |
Р2 +5 О5 -2 |
Определить степени окисления в соединении K2Cr2O7 У двух химических элементов калия и кислорода степени окисления постоянны и равны соответственно +1 и -2. Число степеней окисления у кислорода равна (-2)·7=(-14), у калия (+1)·2=(+2). Число положительных степеней окисления равно числу отрицательных.
Следовательно (-14)+(+2)=(-12). Значит у атома хрома число положительных степеней равно 12, но атомов 2, значит на один атом приходится (+12):2=(+6), записываем степени окисления над элементами К+2Cr+62O-27
Алгоритм составление химических формул по степени окисления
|
1. Записать химические знаки элементов |
Аl S |
|
2. Определить степень окисления |
Аl+3 S-2 |
|
3. Найти наименьшее общее кратное и определить индексы |
Аl+3 S-2 НОК =6 |
|
4.Формула |
Аl2+3 S3-2 |
Алгоритм составления уравнений реакций
|
Последовательность действий |
Пример |
|
1. В левой части уравнения приведем формулы веществ, вступающих в реакцию (реагентов) |
Р+ O2→ |
|
2. В правой части после стрелки пишем формулы веществ, образующихся в результате реакции(продуктов) |
Р + O2→Р2O5 |
|
3 С помощью коэффициентов начинаем уравнивать число тех атомов ,которых в реакцию вступает больше (через НОК) |
нок 10 Р+ 5O2→2Р2O5 |
|
4. С помощью коэффициентов уравниваем число других атомов |
4Р+ 5O2→2Р2O3 |
Составление уравнений окислительно-восстановительных реакций
В методе электронного баланса сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, при этом руководствуемся правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединённых окислителем.
Алгоритм составления окислительно- восстановительных реакций
|
Последовательность действий |
Пример |
|
Составить схему реакции. |
CuCl2 + Al ® AlCl 3 + Cu |
|
Определить элементы, атомы которых изменили степень окисления в результате реакции. |
+2-1 0 +3-1 0 CuCl2 + Al ® AlCl3 + Cu |
|
Найти окислитель и восстановитель. |
+2 0 Cu + 2ē = Cu восстановление окислитель 0 +3 Al — 3ē = Al окисление Восстановитель |
|
Составить электронные уравнения для процессов окисления и восстановления |
+2 0 Cu + 2ē = Cu 3 восстановление окислитель 0 +3 Al — 3ē = Al 2 окисление Восстановитель |
|
Найденные коэффициенты поставить перед формулами продуктов окисления и восстановления, а затем – перед формулами окислителя и восстановителя |
3 CuCl2 + 2Al ® 2AlCl3 + 3Cu |
Составление ионных уравнений реакций
|
Последовательность действий |
Пример |
|
1. Записать молекулярное уравнение реакции, подобрать коэффициенты |
АlСl3 + 3КОН→Аl(ОН)3↓+ 3КСl |
|
2. С помощью таблицы растворимости определить растворимость каждого вещества |
АlСl3 – р; КОН – р; Аl(ОН)3↓- н; КСl — р |
|
3. Составить полное ионное уравнение реакции, записав электролиты в виде ионов, неэлектролиты – в молекулярном виде |
Аl3+ +3Сl— + 3К++3ОН—→Аl(ОН)3↓+ 3К++3Сl— |
|
4. Составить сокращенное ионное уравнение реакции, сократив одинаковые ионы в левой и правой частях уравнения |
Аl3+ +3ОН—→Аl(ОН)3↓ |
Просмотр содержимого документа
«Алгоритмы составления формул и уравнений химических реакций»

Одной из самых главных задач в химии является правильное составление химических формул. Химическая формула – это письменное представление состава химического вещества с помощью латинского обозначения элемента и индексов. Для правильного составления формулы нам обязательно понадобится таблица Менделеева и знание простых правил. Они достаточно простые и запомнить их смогут даже дети.
Как составлять химические формулы
Основным понятием при составлении химических формул является “валентность“. Валентность – это свойство одного элемента удерживать определенное число атомов в соединении. Валентность химического элемента можно посмотреть в таблице Менделеева, а также нужно помнить и уметь применять простые общие правила.
- Валентность металла всегда равна номеру группы, при условии, что он находится в главной подгруппе. Например, калий имеет валентность 1, а кальций – 2.
- С неметаллами немного сложнее. Неметалл может иметь высшую и низшую валентности. Высшая валентность равна номеру группы. Низшую валентность можно определить вычтя номер группы элемента из восьми. При соединении с металлами неметаллы всегда имеют низшую валентность. Кислород всегда имеет валентность 2.
- В соединении двух неметаллов низшую валентность имеет тот химический элемент, который находится в таблице Менделеева правее и выше. Однако, фтор всегда имеет валентность 1.
- И еще одно важное правило при расстановке коэффициентов! Общее число валентностей одного элемента всегда должно быть равно общему количеству валентностей другого элемента!
Закрепим полученные знания на примере соединения лития и азота. Металл литий имеет валентность, равную 1. Неметалл азот располагается в 5 группе и имеет высшую валентность 5 и низшую – 3. Как мы уже знаем, в соединениях с металлами неметаллы всегда имеют низшую валентность, поэтому азот в данном случае будет иметь валентность равную трем. Расставляем коэффициенты и получаем искомую формулу: Li3N.
Вот так, достаточно просто, мы научились составлять химические формулы! А для лучшего запоминания алгоритма составления формул мы подготовили его графическое представление.
Составление химических формул: алгоритм
Пошаговый алгоритм определения степени окисления атомов. Составление формул веществ.
Шаг 1. Выяснить, что понимают под степенью окисления.
С.О.-условный заряд атома, вычисленный из предположения, что все связи атома ионные.
Шаг 2. Вспомнить что такое электроотрицательность.
ЭО- способность атомов химических элементов оттягивать к себе общие электронные пары.
Закономерности изменений значений ЭО в группах и периодах ПС с ростом порядкового номера:
Шаг 3. Выучить правила определения С.О.
Правила определения степеней окисления
1. В простом веществе степень окисления атомов равна 0
2. Сумма степеней окисления атомов в нейтральном соединении равна 0
3. В бинарном соединении С.О. более электроотрицательного атома «-«
менее электроотрицательного « +»
4. Cтепени окисления атомов некоторых элементов в соединениях:
а) фтора (F) –1;
б) металлов Iа группы (Li, Na, K, Rb, Cs) +1, металлов IIа группы (Be, Mg, Ca, Sr, Ba) +2, алюминия (Al) +3;
в) водорода (Н) в соединениях с металлами -1, в остальных соединениях+1;
г) кислорода (О) во фториде OF2 +2,
в перфториде O2F2 +1 ,в остальных пероксидах (содержат группу –О–О–) –1,
в остальных соединениях -2
У остальных неМЕ СО (как правило) — переменная.
-maxСО =№ группы
-minСО=№ группы -8
-между ними такая же четная или нечетная как № группы (иск. фтор, кислород, азот).
Шаг 4.Определить СО по молекулярной формуле.
Алгоритм определения степеней окисления по формуле:
1.Определение степеней окисления начинают с того элемента, у которого С.О. постоянная или известна в соответствии с правилами (см. выше); (Р2О-25);
2.Умножить эту С.О. на индекс атома (или группы) (– 2 * 5 = – 10);
3.Полученное число разделить на индекс второго элемента (или группы) (– 10 / 2 = – 5);
4.Записать полученную С.О. с противоположным знаком (Р+52О-25).
Шаг 5. Научись составлять эмпирические формулы веществ по СО атомов или групп атомов.
Алгоритм составления формул:
1.Запиши знаки элементов, образующих соединение, укажи СО атомов; Al +3O-2
2. Для СО найди наименьшее общее кратное (НОК); НОК (2,3)=6
3. Рассчитай число атомов в соединении, для этого раздели НОК на значения СО; 6/3=2; 6/2=3 Al 2+3O—32
Шаг 6. Научись определять СО по структурной формуле (задание повышенной сложности).
Алгоритм определения:
1.Составь структурную формулу вещества.
2. Обозначь стрелкой на валентном штрихе направление смещения электронной плотности, используя значения ЭО.
3. Рассчитай значения СО атомов.
Cl-1
Ca+2
O-2 Cl+1 ;